Содержание
- 2. ЭЛЕКТРОХИМИЯЛЫҚ ПРОЦЕСТЕР Ехим → Еэлектр (ГАЛЬВАНИКАЛЫҚ ЭЛЕМЕНТТЕР) Нернст теңдуін қолдануға негізделген Еэлектр→Ехим (ЭЛЕКТРОЛИЗ) Фарадей заңын қолдануға
- 3. Электрохимиялық талдаудың әдістерінің жіктелуі: Фарадей заңдарын қолдануға негізделген электроталдау әдістері - кулонометрия, электрогравиметрия Нернст теңдеуін қолданып,
- 4. Потенциометрия – әртүрлі тізбектердің электр қозғаушы күшін ЭҚК немесе қайтымды электролитті тізбектегі рН не рХ электродтарға
- 5. Потенциометриялық әдістің негізгі артықшылығы: оның дәлдігі, сенімділігі, сезімталдығы, қайталануы, сұйытылған, боялған әрі лайланған ерітінділерге қолданылу мүмкіндігі.
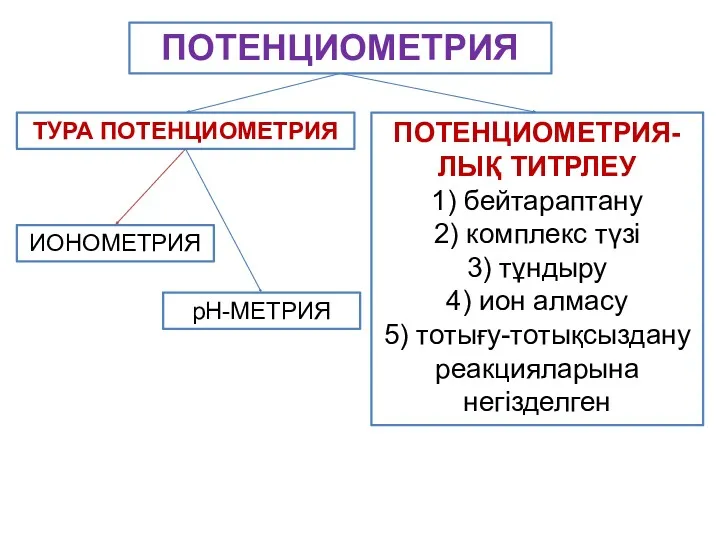
- 6. ТУРА ПОТЕНЦИОМЕТРИЯ ПОТЕНЦИОМЕТРИЯ-ЛЫҚ ТИТРЛЕУ 1) бейтараптану 2) комплекс түзі 3) тұндыру 4) ион алмасу 5) тотығу-тотықсыздану
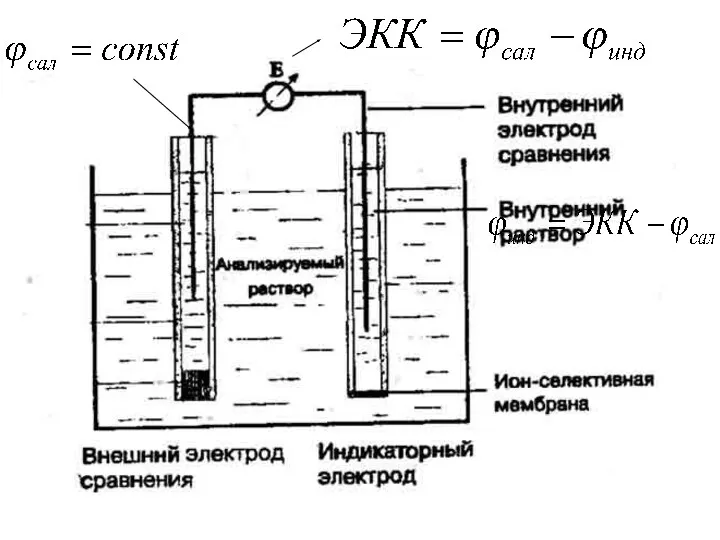
- 7. Бұл әдісте индикаторлық және салыстыру деп аталатын екі электродтан тұратын гальваникалық элемент қолданылады. Индикаторлық электродтың потенциалы
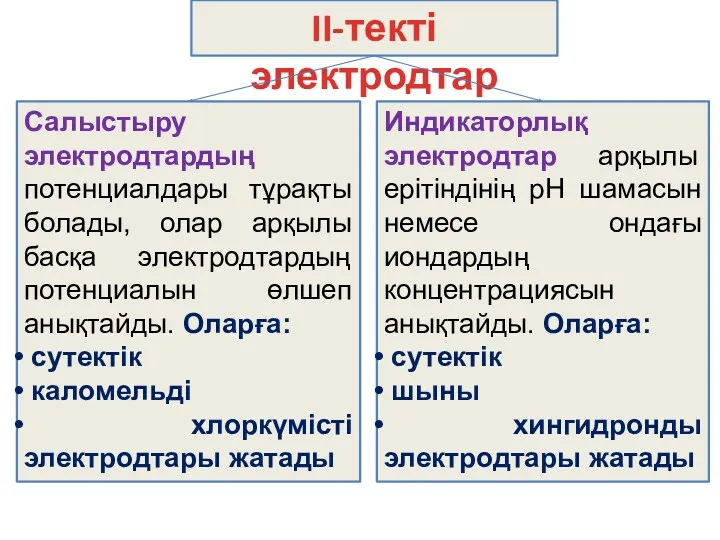
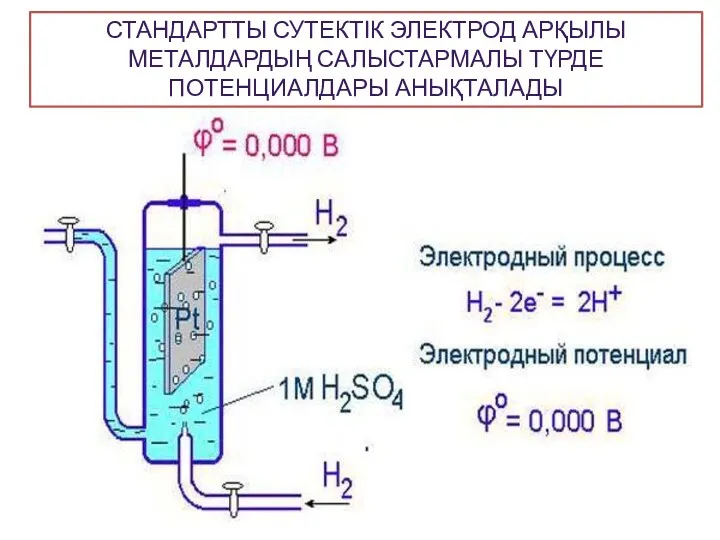
- 8. II-текті электродтар Салыстыру электродтардың потенциалдары тұрақты болады, олар арқылы басқа электродтардың потенциалын өлшеп анықтайды. Оларға: сутектік
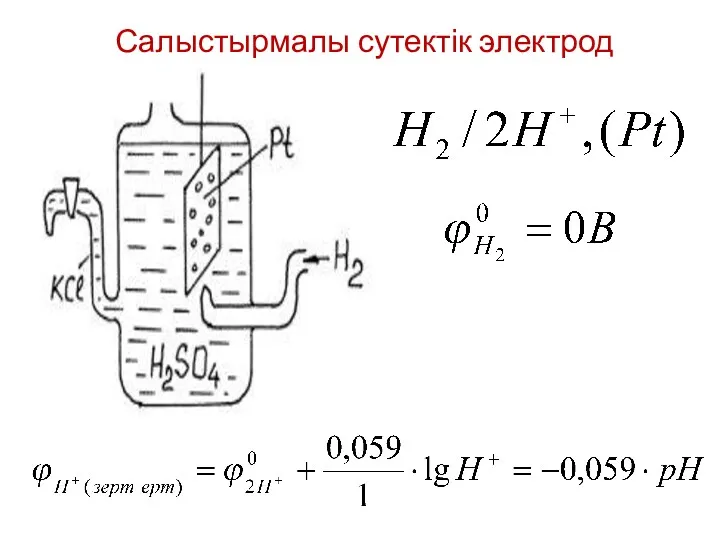
- 10. Салыстырмалы сутектік электрод
- 11. СТАНДАРТТЫ СУТЕКТІК ЭЛЕКТРОД АРҚЫЛЫ МЕТАЛДАРДЫҢ САЛЫСТАРМАЛЫ ТҮРДЕ ПОТЕНЦИАЛДАРЫ АНЫҚТАЛАДЫ
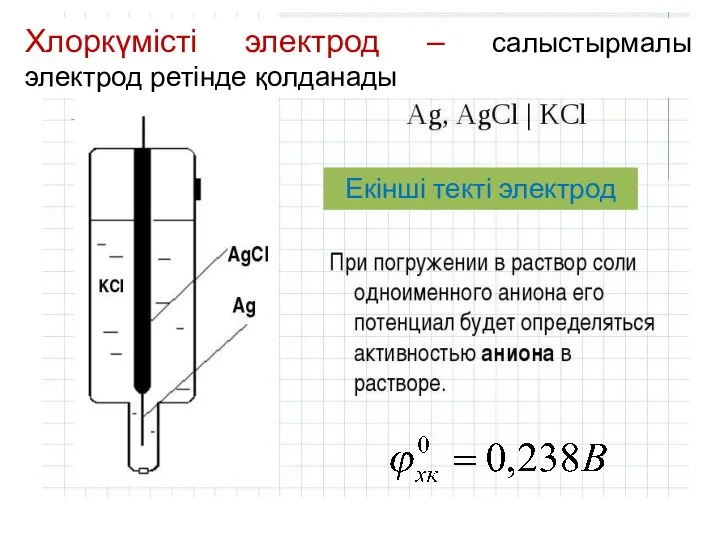
- 12. Хлоркүмісті электрод – салыстырмалы электрод ретінде қолданады Екінші текті электрод
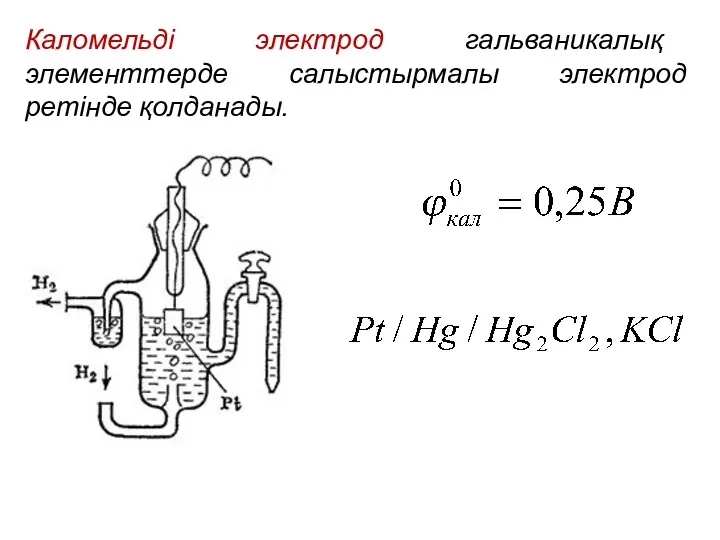
- 13. Каломельді электрод гальваникалық элементтерде салыстырмалы электрод ретінде қолданады.
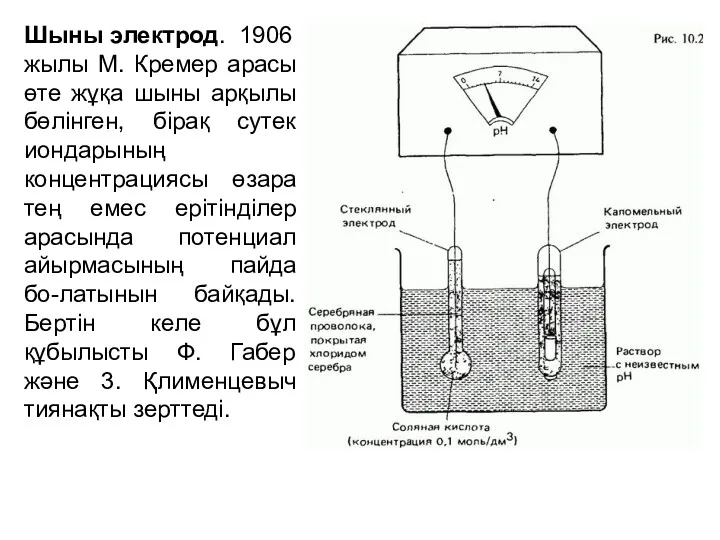
- 14. Шыны электрод. 1906 жылы М. Кремер арасы өте жұқа шыны арқылы бөлінген, бірақ сутек иондарының концентрациясы
- 17. Потенциометрия әдістері тура (ионометрия) потенциометрия және потенциометриялық титрлеу деп бөлінеді. Тура потенциометрия әдістері Нернст теңдеуін тікелей
- 18. ВОЛЬТАМПЕРМЕТРИЯ ӘДІСІ Бұл әдіс электролиз кезінде, талданатын зат ерітіндісінің кернеуін жоғарылата отырып ток күшін өлшеу нәтижесінде
- 19. Вольтамперометрия поляризацияланған немесе вольтамперлік қисықтарды қарастырады, олар талданатын зат ерітіндісінің электролизі кезінде біртіндеп кернеуді жоғарылатқанда және
- 20. Поляризацияланатын индикаторлық микроэлектрод ретінде көбінесе сынаптың тамшылайтын электроды қолданылады, бұл жағдайда әдіс полярография деп аталады. Бұл
- 21. Әдістің теориялық негізі: зерттеуге тиісті зат ерітіндісінің құрамын, мөлшерін индикаторлық электродтың поляризациясы нәтижесінде алынған ток күші
- 22. Полярографиялық әдістің басты ерекшелігі зерттелетін зат ерітіндісіндегі иондар құрамын және мөлшерін анықтай алуы: Әдіс өте дәл,
- 23. Катод ретінде поляризацияланатын сынаптың тамшылайтын электроды, ал анод ретінде мүлдем поляризацияланбайтын каломельді электрод алынатын жүйедегі электролизді
- 24. Зерттелетін кернеу аймақтарында сынап электродында тотықсыздана алатын заттардың қатысуында, токтың кернеуге тәуелділік қисығының түрі өзгереді. Тотықсыздану
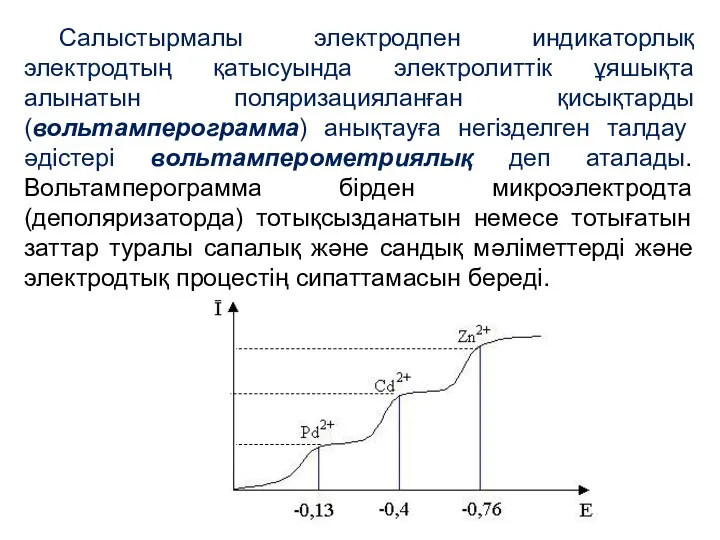
- 25. Салыстырмалы электродпен индикаторлық электродтың қатысуында электролиттік ұяшықта алынатын поляризацияланған қисықтарды (вольтамперограмма) анықтауға негізделген талдау әдістері вольтамперометриялық
- 26. Потенциалдың аз шамасында катодтың ток күші басында кернеуді арттырғанда баяу жоғарылайды – бұл ток шамасы қалдық
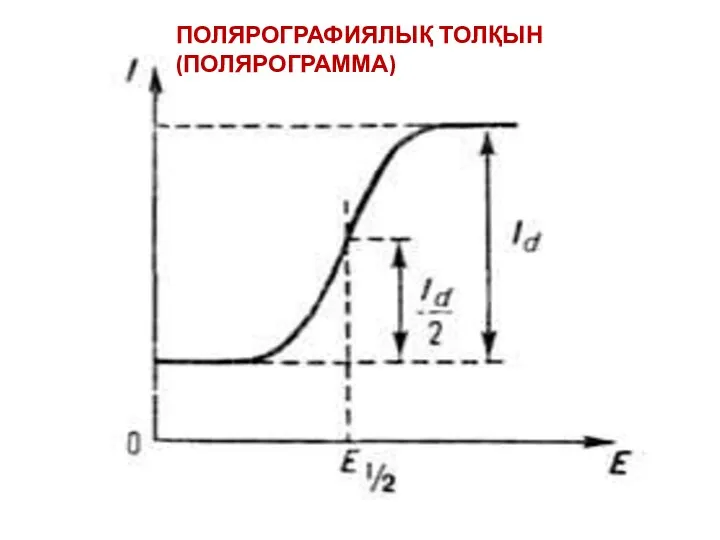
- 27. ПОЛЯРОГРАФИЯЛЫҚ ТОЛҚЫН (ПОЛЯРОГРАММА)
- 28. Бұл теңдеу жартылай толқын потенциалының (E1/2) токқа және тотықсызданатын иондардың концентрациясына тәуелсіз екенін көрсетеді. Сонымен, жартылай
- 29. Сандық полярографиялық талдау Илькович теңдеуін қолдануға негізделген, бұл теңдеу диффузиялық токтың (Id) ионның концентрациясымен С байланысын
- 30. Полярографиялық талдудың маңызды әдістерінің бірі – амперометриялық титрлеу. Мұнда титрлеудің соңғы нүктесін табу титрлеу барысында диффузиялық
- 32. Полярограф универсальный ПУ-1
- 33. Полярографтың қолдануы: Химиялық реактивтерде, жартылайөткізгіштерде, құймаларда қоспалардың үлесін анықтау; Фармацевтикалық препарттардың, тағамдардың, ауаның, ауыз сулардың тазалығы
- 34. Кондуктометрия әдісі электролит ерітінділерінің (ондағы жеке иондардың) концентрацияларын олардың электрөткізгіш-тіктерін өлшеуге негізделген. Кондуктометрияның артықшылығы: Қарапайым және
- 35. Ерітіндідегі ион саны электролиттің табиғатына (күшті және әлсіз) және оның концентрациясына тәуелді. Кондуктометрия әдісінің аналитикалық сигналы
- 37. Кондуктометрлік титрлеу аналитикалық мақсатта кенінен қолданылады. Меншікті электрөткізгіштікті қосылған титрант мөлшерімен өлшейді. Нәтижелері бойынша χ –
- 38. Электролит ерітінділерінің электр тоғын өткізу қабілеті ондағы иондардың қозғалғыштығына байланысты болады. Заттың электр тоғын өткізу мүмкіндігі
- 39. Ерітінділердің кедергісі (R) кондуктометриялық ұяшық арқылы өлшенеді, ондағы электродтар бір қалыпты орнатылған, яғни: мұндағы Кс –
- 40. Меншікті электрөткізгіштік (χ) ерітіндінің концентрациясына тәуелсіз шама, сондықтан есептеулерде оның орнына эквиваленттік электрөткізгіштік шамасы алынады: Эквиваленттік
- 41. Кондуктометр Кондуктометрическое титрование
- 42. ЭЛЕКТРОТАЛДАУ ӘДІСТЕРІ Электроталдау әдістері негізінде электр тоғының әсерінен заттардың химиялық ыдырау реакциялары жатыр. Электроталдау әдістері электролиз
- 43. Кулонометрия әдісі электрохимиялық реакцияға түскен заттың мөлшері мен электролит ерітіндісі арқылы өткен ток мөлшері арасындағы байланысты
- 44. Кулонометрия процесіндегі электродтық реакция барысында анализденетін зат электродта қатты түрде бөлінбейді. Мысалы: Катод (-): Fe3+ +
- 45. Электрогравиметрия кезіндегі электродта электролит құрамынан металл катионы таза металл күйінде, не оның тотығы (оксид) мен тұзы
- 46. Электрогравиметрия әдісі арқылы кендегі, балқымадағы, әр түрлі ерітінділердегі металдарды, радиоактивті заттарды анықтайды. Ең бастаса тотықсызданатын катионның
- 47. Электрогравиметрияда анализденетін зат электродта қатты түрде (майда кристалды тұнба түрінде) бөлінетін электродтық реакция қолданылады. Мысалы: Катод
- 49. Скачать презентацию




































 Основы молекулярно-кинетической теории и термодинамики. (Лекция 9)
Основы молекулярно-кинетической теории и термодинамики. (Лекция 9) Razele x
Razele x Коллиматор. Разновидности коллиматоров. Виды тест-объектов. Зрительная труба. Диоптрийная трубка
Коллиматор. Разновидности коллиматоров. Виды тест-объектов. Зрительная труба. Диоптрийная трубка Устройство колесных пар
Устройство колесных пар Геометрическая оптика. Законы распространения света
Геометрическая оптика. Законы распространения света Тепловые двигатели и их влияние на окружающую среду
Тепловые двигатели и их влияние на окружающую среду Аналогии физических свойств сегнетоэлектрических и ферромагнитных кристаллов
Аналогии физических свойств сегнетоэлектрических и ферромагнитных кристаллов Голограми
Голограми Фазированные антенные решетки и их назначение. Типы диаграммоформирования
Фазированные антенные решетки и их назначение. Типы диаграммоформирования Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. Расчет количества теплоты. 8 класс
Количество теплоты. Единицы количества теплоты. Удельная теплоемкость. Расчет количества теплоты. 8 класс Равноускоренное прямолинейное движение
Равноускоренное прямолинейное движение Конвективный теплообмен
Конвективный теплообмен Ходовая часть гусеничного трактора
Ходовая часть гусеничного трактора К отчету по качеству
К отчету по качеству Поляризация света
Поляризация света Инерция
Инерция Lektsia_14_Lazery
Lektsia_14_Lazery Овощи и фрукты как альтернативные источники энергии
Овощи и фрукты как альтернативные источники энергии Спин – орбитальная связь
Спин – орбитальная связь Развёрнутый план - конспект урока по физике в 8 классе Кипение
Развёрнутый план - конспект урока по физике в 8 классе Кипение Law of conservation of momentum
Law of conservation of momentum Анализ физико-химического состава почвы пришкольного участка
Анализ физико-химического состава почвы пришкольного участка Дополнение к трехфазным цепям. Лекция 15
Дополнение к трехфазным цепям. Лекция 15 Звуковые волны. 9 класс
Звуковые волны. 9 класс Феромагнетики. Феромагнітне тіло
Феромагнетики. Феромагнітне тіло Дизельное топливо
Дизельное топливо Пара сил. Момент
Пара сил. Момент Галерея автомобилей
Галерея автомобилей