Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер презентация
Содержание
- 2. I. Кіріспе Ерітінділердің жалпы сипаты II.Негізгі бөлім a)Ерітінділер түрлері b) Идеал ертітінділер және реал ерітінділер c)
- 3. Ерітінділер— кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді (біртекті) жүйелер. Ерітінділер газ тәрізді, сұйық
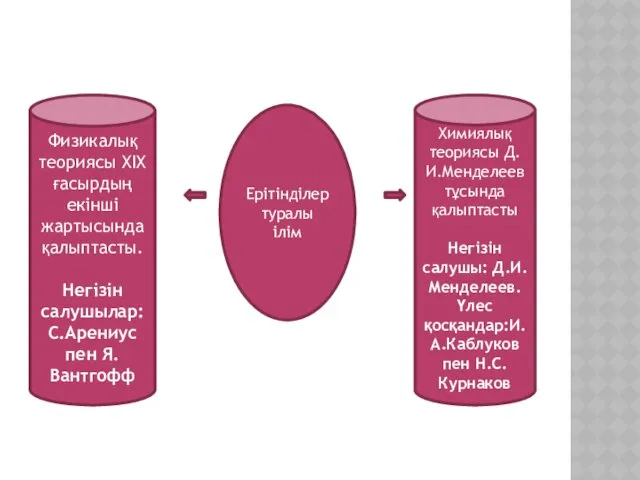
- 4. Ерітінділер туралы ілім Физикалық теориясы ХІХ ғасырдың екінші жартысында қалыптасты. Негізін салушылар: С.Арениус пен Я.Вантгофф Химиялық
- 5. Ерітінділер қаныққан қанықпаған аса қаныққан Қанықпаған ерітінді – еріген заттың жаңа мөлшерін әлі еріте алатын ерітінді.
- 6. Кез келген затты еріткенде еріткіш буының қысымы төмендейтінін көптеген тәжірибе жүзінде көрсетті . Осы негізде ерітінді
- 7. Реалды ерітінділер – біртекті және әртекті молекулалар (А-А, В-В және А-В) арасындағы байланыс күші бірдей емес
- 8. Химияда суда еріген зат пен еріткіштің арасындағы сандық қатынасты анықтау үшін ерітіндінің концентрациясы деген ұғым енгізілген.
- 9. Ерітіндінің концентрациясын химияда әр түрлі тәсілдермен көрсетуге болады. Мысалы, пайыздық, молярлық, т.б. Ерітіндінің концентрациясын көрсететін ең
- 10. Еріген заттың массалық үлесі деп еріген зат массасының ерітінді массасына қатынасымен өлшенетін шаманы айтамыз. Оны пайыз
- 11. Ерітіндінің пайыздық концентрациясына есептеулер: 1-есеп. 20г зат 90г ерітіндіде болса оның массалық үлесі қандай? Берілгені: Шешуі:
- 12. 2-есеп. Тұздың 15%-дық 200 г ерітіндісін даярлау үшін қанша тұз және қанша су қажет? Берілгені: Шешуі:
- 14. Скачать презентацию










 Гидравлика и гидропривод
Гидравлика и гидропривод Контур с током в магнитном поле
Контур с током в магнитном поле Влажность, влагоемкость, водо- нефте- газонасыщенность
Влажность, влагоемкость, водо- нефте- газонасыщенность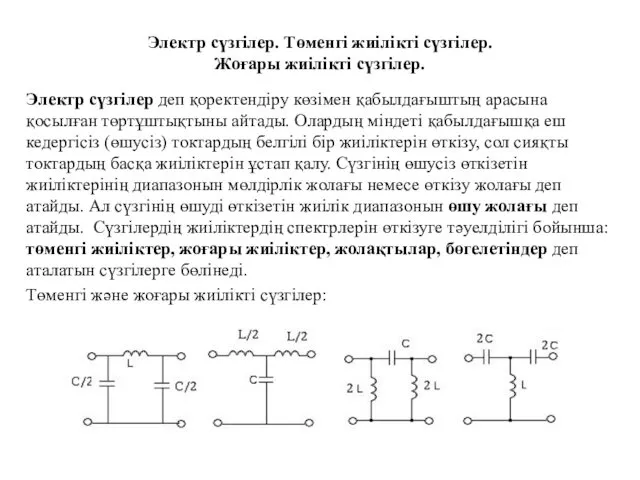 Электр сүзгілер. Төменгі жиілікті сүзгілер. Жоғары жиілікті сүзгілер
Электр сүзгілер. Төменгі жиілікті сүзгілер. Жоғары жиілікті сүзгілер Трансформатор. Қазіргі трансформаторлар
Трансформатор. Қазіргі трансформаторлар Мікро- і наноелектроніка
Мікро- і наноелектроніка Система L-Jetronic
Система L-Jetronic Электромагнитные волны
Электромагнитные волны Влияние фазовых искажений на направленные свойства излучающей поверхности. Лекция № 11. АФУ
Влияние фазовых искажений на направленные свойства излучающей поверхности. Лекция № 11. АФУ ВКР: Получение нанодисперсной магнитной жидкости на полярной основе методом химической конденсации
ВКР: Получение нанодисперсной магнитной жидкости на полярной основе методом химической конденсации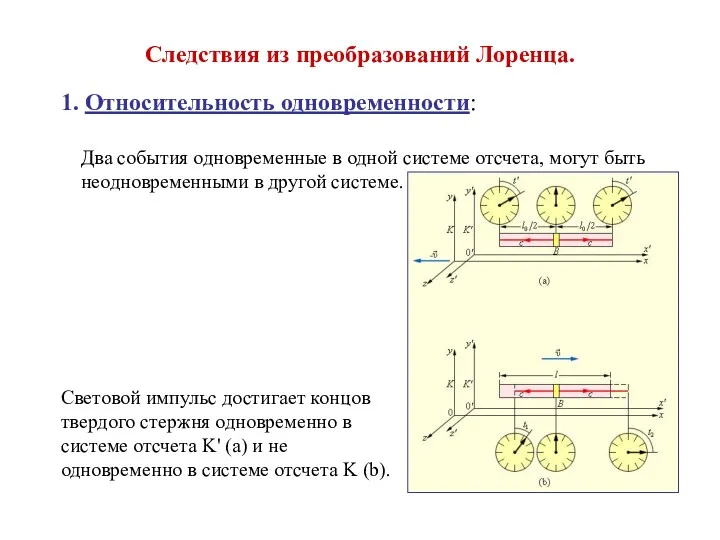 Следствия из преобразований Лоренца
Следствия из преобразований Лоренца Система Motronic. Die Motronic
Система Motronic. Die Motronic Влияние алюминия на удельную электропроводность нанокомпозитного материала на основе кремний-углеродной матрицы
Влияние алюминия на удельную электропроводность нанокомпозитного материала на основе кремний-углеродной матрицы Электрооборудование автомобилей. Системы автоматического управления оборудованием автомобиля. (Урок 12)
Электрооборудование автомобилей. Системы автоматического управления оборудованием автомобиля. (Урок 12) Orbit quantization rule. Lecture №3
Orbit quantization rule. Lecture №3 Электрическое поле. Напряжённость электрического поля
Электрическое поле. Напряжённость электрического поля Огляд конструкцій плугів спец. призначення. Огляд конструкцій фрезерних машин, ямокопачів, площадкоутворювачів. Лекція 4 (ч. 2)
Огляд конструкцій плугів спец. призначення. Огляд конструкцій фрезерних машин, ямокопачів, площадкоутворювачів. Лекція 4 (ч. 2) Электростатическое поле в вакууме
Электростатическое поле в вакууме Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8
Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8 Тормозная система автомобиля
Тормозная система автомобиля Тепловые двигатели и охрана окружающей среды
Тепловые двигатели и охрана окружающей среды Термодинамические свойства воды и водяного пара
Термодинамические свойства воды и водяного пара Резонанс напряжений
Резонанс напряжений pril1
pril1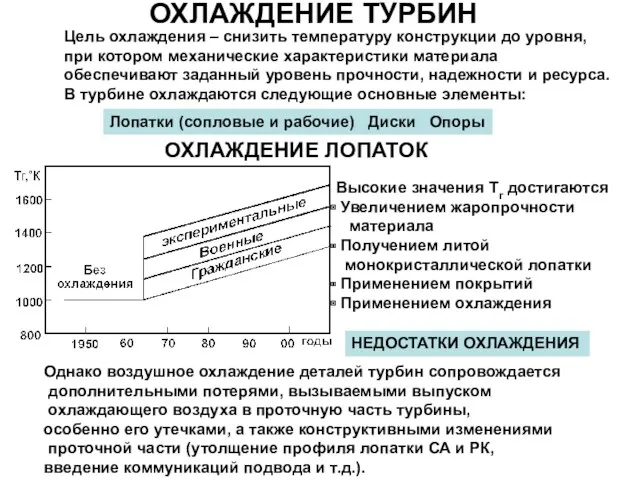 Охлаждение турбин
Охлаждение турбин Устойчивое равновесие тела, имеющую одну точку опоры
Устойчивое равновесие тела, имеющую одну точку опоры Механические и технологические испытания: испытания на растяжение
Механические и технологические испытания: испытания на растяжение Тепловые явления
Тепловые явления