Содержание
- 2. ЕРІТІНДІЛЕР Ерітінділердің табиғат пен техникадағы маңызы зор.Жануарлар мен адам организмінде тіршілік әрекетіне байланысты жүретін көптеген про-цестер
- 3. Күнделікті тіршілікте кездесетін заттардың барлығы таза болып есептелінбейді, олардың көбі қоспалар болып табылады.Бұл қоспалар гомогенді (біртектес)
- 4. Дисперстік фаза дегеніміз ұсақ бөл-шектер түрінде таралған зат, ал сол бөлшектер таралған орта – дисперсиялық орта
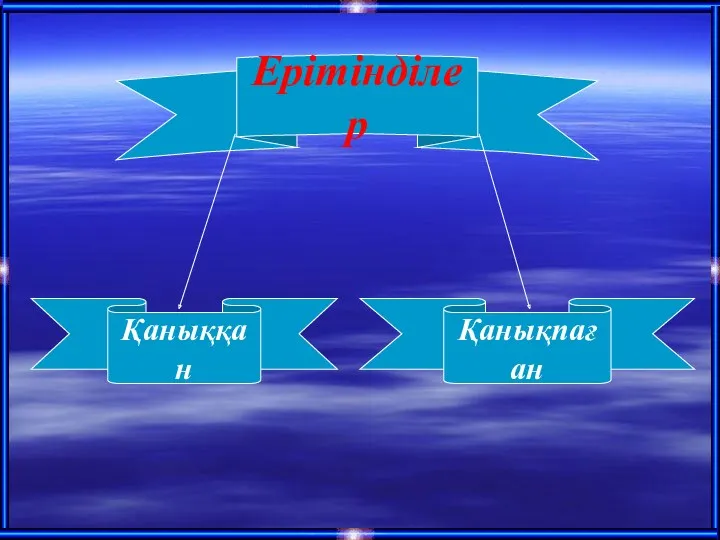
- 5. Ерітінділер Қаныққан Қанықпаған
- 6. Медицина және биологияда,өндіріс пен техникада аса маңызды ерітінгділерге сұйық ерітінділер жатады. Зат еріген кезде екі түрлі
- 7. Концентрациясы қанық ерітіндінің концентрациясынан аз ерітіндіні қанықпа-ған ерітінді деп атайды,яғни белгілі бір температурада заттың біраз мөлшері
- 8. Ерітіндідегі еріген заттың мөлшері кон-центрация арқылы анықталады. Ерітінді-лердің концентрациясын өрнектеудің бірне-ше тәсілдері бар. Ерітінділердің концентраиясын анықтау
- 9. 1.Массалық (пайыздық) үлесі- еріген зат массасының ерітінді массасына қатынасы: 2.Мольдік үлес- еріген зат мөлшерінің еріген зат
- 10. 4. Эквивалентті немесе нормальды концентрациясы - еріген заттың эквивалент санының ерітінді көлеміне қатынасы Заттың эквиваленті деп
- 11. ЕРІТІНДІЛЕРДІҢ ФИЗИКАЛЫҚ ТЕОРИЯСЫ ХІХ ғ. соңында ерітінді физикалық түзіліс, онда еріткіш пен еріген зат арасында ешбір
- 12. Бұл теория бойынша еріген зат пен ерітінді бір - бірімен әрекеттеспейді.Еру диффузия салдарынан болатын физикалық процесс.
- 13. ЕРІТІНДІЛЕРДІҢ ХИМИЯЛЫҚ ТЕОРИЯСЫ. Д.И.Менделеев ерітінділерді зерттеуге 40 жылдай ғылыми жұмысын арнаған оның ерітінділердің химиялық теориясы 1887ж
- 14. ЕРІТІНДІЛЕРДІҢ МЕДИЦИНАДА ҚОЛДАНЫЛУЫ
- 15. МЕДИЦИНАДА ҚОЛДАНЫЛУЫ
- 16. Алғашқы медициналық көмекте қолданылуы
- 17. Калий перманганаты
- 18. Өндіріс орындарында қолданылуы
- 22. ЕРІТІНДІЛЕРДІҢ КОЛЛИГАТИВТІ ҚАСИЕТТЕРІ Коллигативті деп еріген заттың табиғатына тә-уелсіз ,тек оның мольдік концентрациясына байланысты қасиеттерді айтады.Сұйылтылған
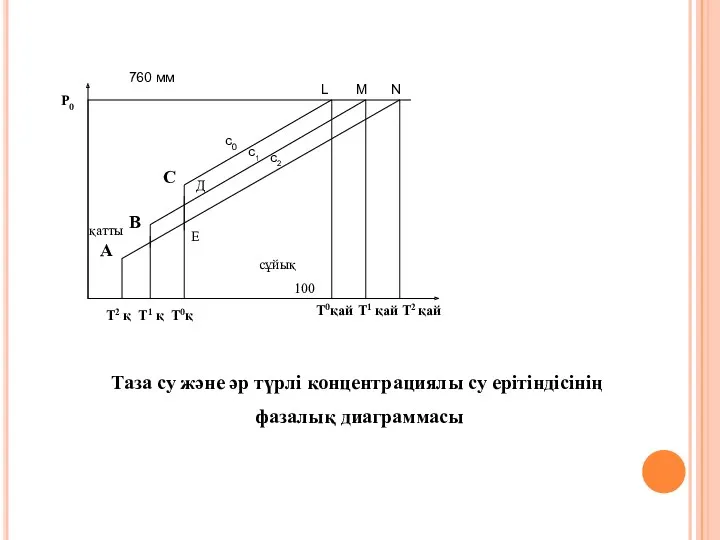
- 23. А В С с0 с1 с2 L M N T0қай Т1 қай Т2 қай Т2 қ
- 24. ОСМОС ҚЫСЫМЫ Ерітінділердің тағы бір коллигативті қасиеттерінің бірі осмос қысымы,ол осмос құбылысы нәтижесінде пайда бо-лады. Осмос
- 25. Сонымен, мембраналар биожүйелердің қа-жетті құрылымдық бірлігі болып табылады. Мембраналар түрлері сан алуан,олардың біреуі су үшін,басқалары –
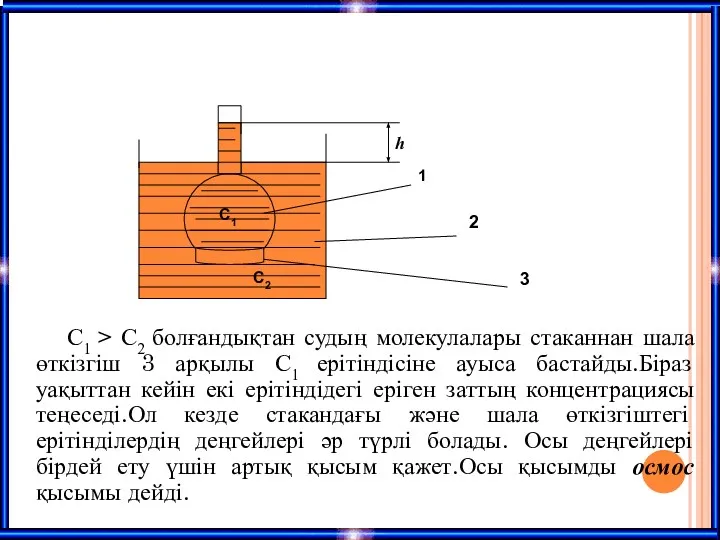
- 26. C1 > C2 болғандықтан судың молекулалары стаканнан шала өткізгіш 3 арқылы C1 ерітіндісіне ауыса бастайды.Біраз уақыттан
- 27. Осмос қысымы Вант-Гофф заңы арқылы анықталады: “Ерітіндінің осмос қысымы еріген зат сол темпе-ратурада газ күйінде болып,
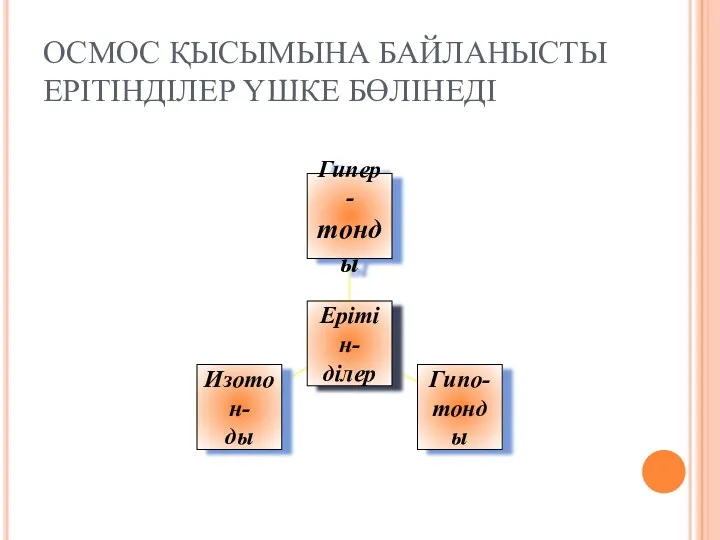
- 28. ОСМОС ҚЫСЫМЫНА БАЙЛАНЫСТЫ ЕРІТІНДІЛЕР ҮШКЕ БӨЛІНЕДІ
- 29. Осмос қысымдары тең әр түрлі ерітінділер изотондық болып саналады.Ал бір ерітіндінің осмос қысымы екіншіерітіндінің осмос қысы-мынан
- 31. Скачать презентацию





















 Люминесцентная лампа
Люминесцентная лампа ЗСИ и реактивное движение
ЗСИ и реактивное движение Закон Ома
Закон Ома Изучение устройства ракеты
Изучение устройства ракеты Механические свойства металлов
Механические свойства металлов Воздушный винт самолета
Воздушный винт самолета атомы
атомы Части и подразделения связи соединений сухопутных войск
Части и подразделения связи соединений сухопутных войск Барометрическая формула. (Лекция 6)
Барометрическая формула. (Лекция 6) Явление электромагнитной индукции
Явление электромагнитной индукции Тербелістер мен толқындар
Тербелістер мен толқындар Реактивний рух у природі та техніці
Реактивний рух у природі та техніці Реактивное движение в животном и растительном мире
Реактивное движение в животном и растительном мире Резка металла
Резка металла Электрическое поле в диэлектриках
Электрическое поле в диэлектриках Давление
Давление Явление инерции. Масса
Явление инерции. Масса Электр тогы. Электр тізбегі
Электр тогы. Электр тізбегі презентация к уроку Инерция
презентация к уроку Инерция Physical chemistry of nanostructured systems.( lecture no. 7)
Physical chemistry of nanostructured systems.( lecture no. 7) Проводниковые материалы
Проводниковые материалы Мореходные качества судна
Мореходные качества судна Производство, передача и потребление электроэнергии
Производство, передача и потребление электроэнергии Магнитное поле Земли
Магнитное поле Земли Параллельное и последовательное соединения проводников. Урок–закрепление в 8 классе
Параллельное и последовательное соединения проводников. Урок–закрепление в 8 классе Законы Ньютона. Повторение (9 класс)
Законы Ньютона. Повторение (9 класс) Нелинейная оптика
Нелинейная оптика Электрические цепи постоянного тока • Электрические цепи синусоидального тока • Трёхфазные цепи
Электрические цепи постоянного тока • Электрические цепи синусоидального тока • Трёхфазные цепи