Содержание
- 2. Основные понятия Ф\х (инструментальные методы анализа или физические методы в химии) основаны на измерении с помощью
- 3. Основные понятия Качественный анализ (определение качественного состава) всегда предшествовал количественному анализу (определение количественного соотношения компонентов). Основоположник
- 4. Основные понятия На всех стадиях любого производства осущ-ся технический контроль – контроль качества продукции в ходе
- 5. Классификация методов анализа 1 По объектам анализа: неорганический и органический. 2 По цели: качественный и количественный.
- 6. Классификация ф\х методов анализа Спектроскопические методы Дифракционные методы Оптические методы Масс-спектромертия и спектроскопия электронов Диэлькометрия и
- 7. Требования, предъявляемые к методам анализа 1 Точность анализа 2 Предел обнаружения (ПО) 3 Чувствительность 4 Избирательность,
- 8. Краткая характеристика ф\х методов анализа
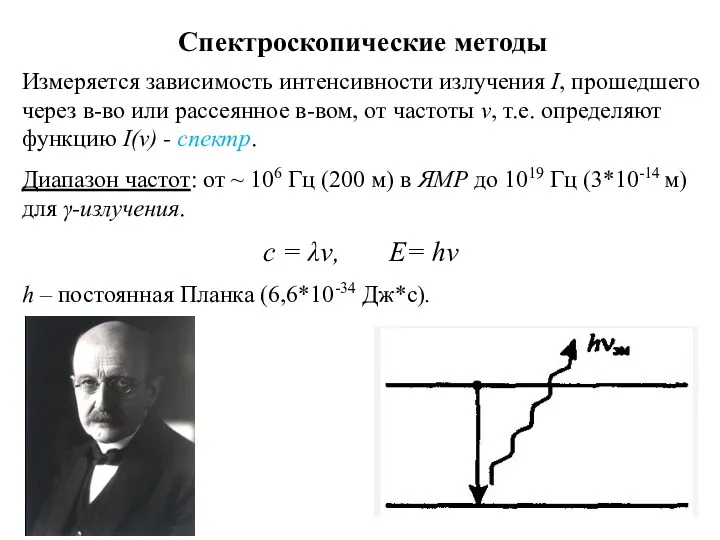
- 9. Спектроскопические методы Измеряется зависимость интенсивности излучения I, прошедшего через в-во или рассеянное в-вом, от частоты ν,
- 10. Спектроскопические методы
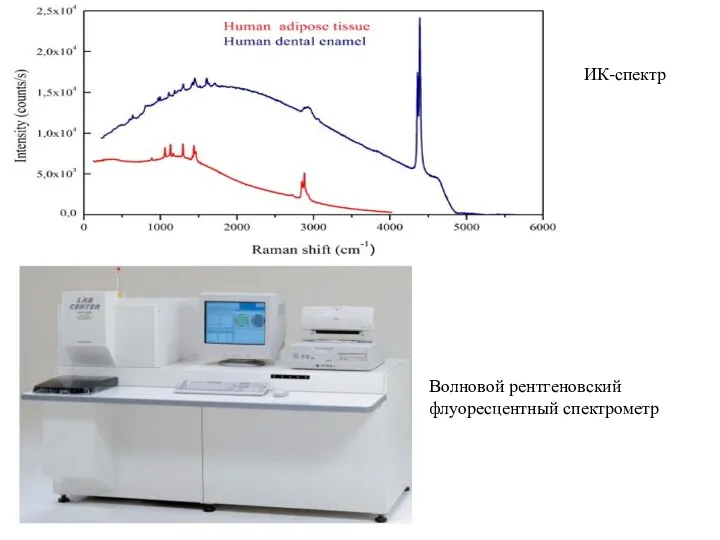
- 11. Волновой рентгеновский флуоресцентный спектрометр ИК-спектр
- 12. Дифракционные методы Использование волновых св-в рентгеновского излучения и потока частиц электронов и нейтронов (дифракция). Волновые свойства
- 13. Луи де Бройль (1892 -1987) французский физик-теоретик, лауреат Нобелевской премии по физике Макс фон Лауэ (1879
- 14. Дифракционные методы В основе: соотношение для λ и расстояния между рассеивающими атомами r: λ ≤ r.
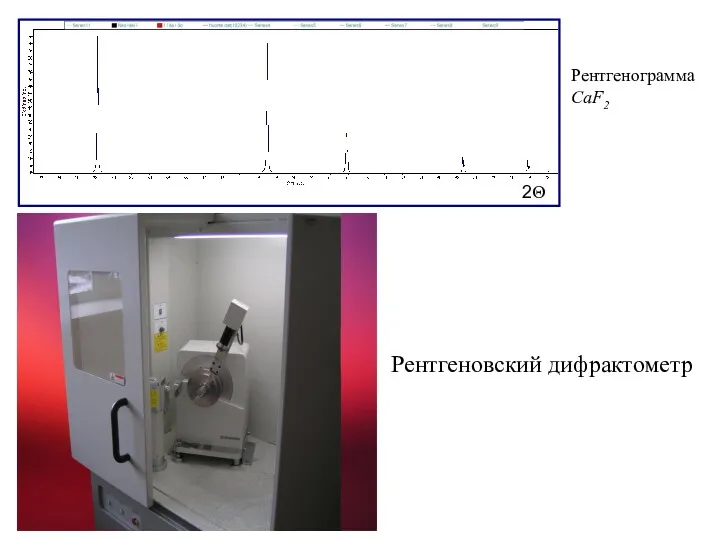
- 15. 2Θ Рентгенограмма CaF2 Рентгеновский дифрактометр
- 16. Оптические методы Изучение распространения, рассеяния и поглощения света в в-ве. Физические величины, которые мерят: 1) n
- 17. Оптические методы 3) ρ – коэффициент деполяризации, т.е. отношение интенсивности рассеянного под углом 90° света с
- 18. Оптические методы 5) α (B) – эффект Фарадея – зависимость угла поворота плоскости поляризации света от
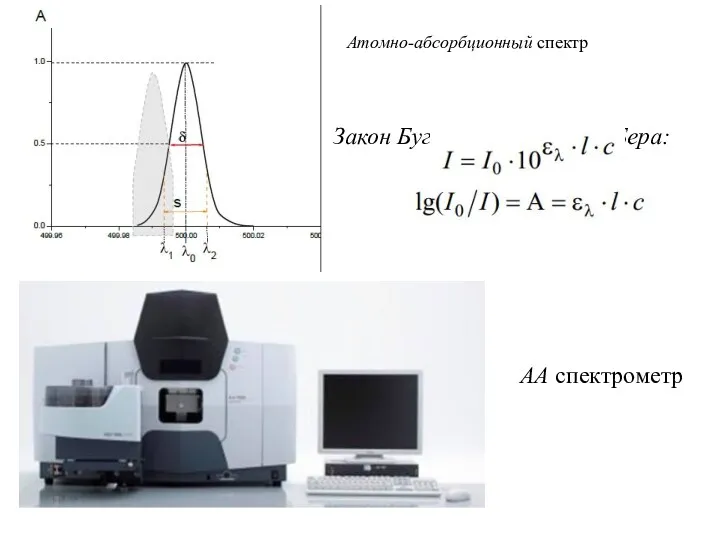
- 19. Атомно-абсорбционный спектр Закон Бугера - Ламберта - Бера: АА спектрометр
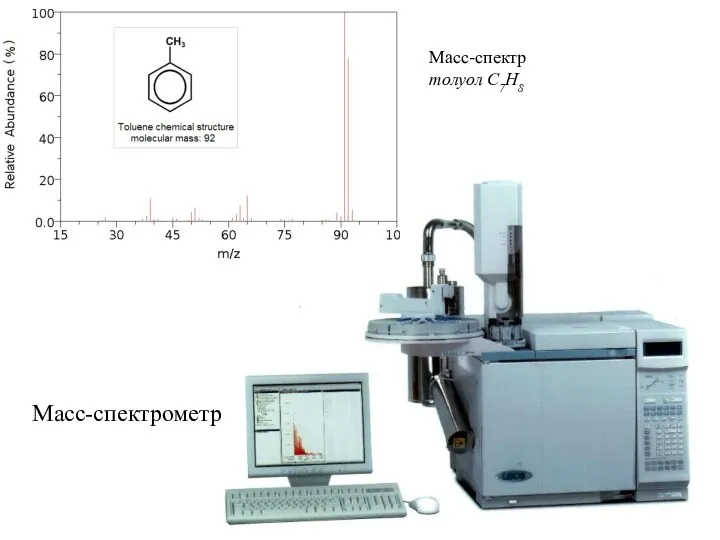
- 20. Масс-спектрометрия Суть: При взаимодействии какого-либо падающего излучения или потока частиц на в-во измеряют потоки других частиц.
- 21. Масс-спектрометр Масс-спектр толуол C7H8
- 22. Спектроскопия ē В методах рентгеновской электронной спектроскопии (РЭС) и оптической электронной спектроскопии (ФЭС): Падающее излучение –
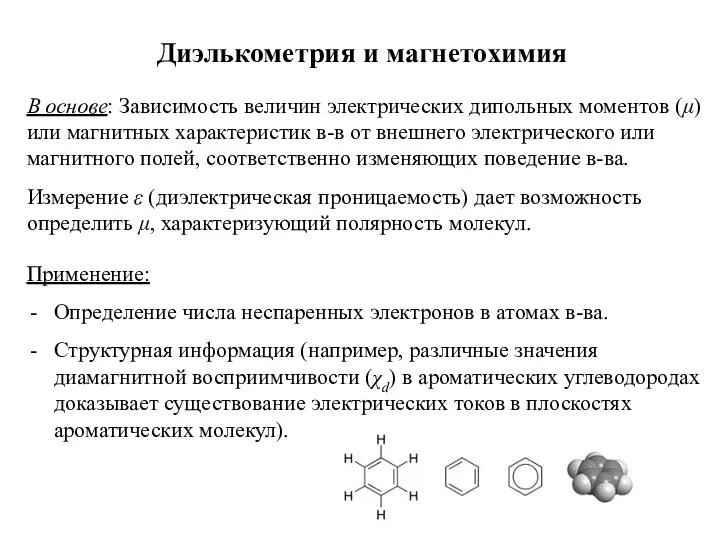
- 23. Диэлькометрия и магнетохимия В основе: Зависимость величин электрических дипольных моментов (μ) или магнитных характеристик в-в от
- 24. Электрохимические методы анализа В основе: Измерение электрических параметров: силы тока, напряжения, равновесных электродных потенциалов, электрической проводимости,
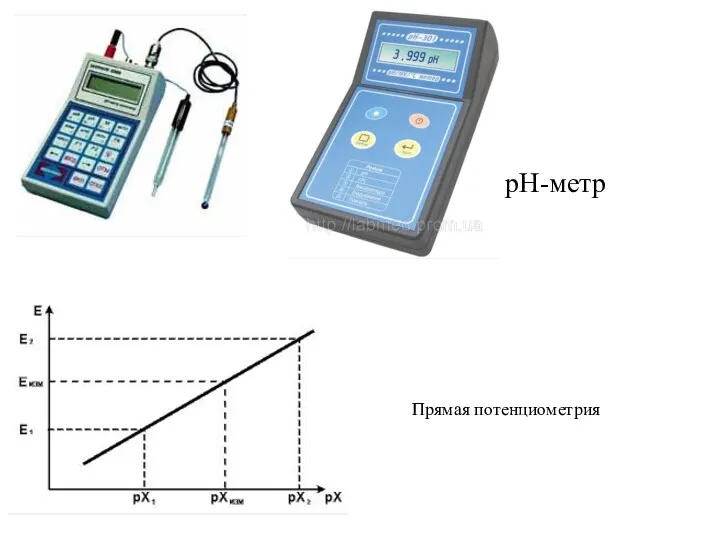
- 25. Потенциометрия В основе: Использование зависимости ЭДС электрохимической цепи от активности (концентрации) анализируемого иона. Применяют электрохимические цепи
- 26. Прямая потенциометрия pH-метр
- 27. Кулонометрия В основе: Измерение количества электричества (кулонов), затраченного на электроокисление или восстановление анализируемого в-ва. Количество вещества
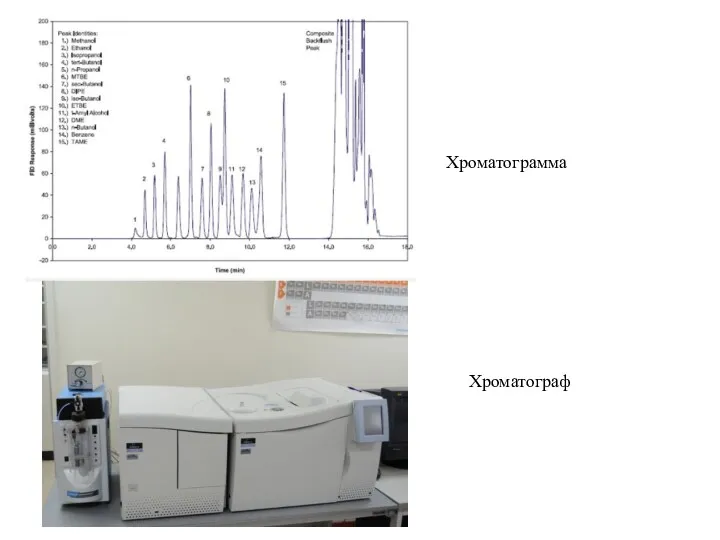
- 28. Хроматографические методы (русский ботаник М.С. Цвет в 1903 г.) Суть: Разделение однородных многокомпонентных смесей на отдельные
- 29. Хроматографические методы Классификация методов хроматографии: - По агрегатному состоянию фаз, Способу их относительного перемещения, Аппаратурному оформлению
- 30. Хроматографические методы По механизму взаимодействия сорбента и сорбата: -адсорбционная хроматография; -распределительная хроматография; -ионообменная хроматография; -эксклюзионная хроматография;
- 31. Хроматограмма Хроматограф
- 33. Скачать презентацию






















 Презентация урока по теме Количество теплоты
Презентация урока по теме Количество теплоты Хроматографические методы. (Часть 2)
Хроматографические методы. (Часть 2) Редуктор конический одноступенчатый горизонтальный
Редуктор конический одноступенчатый горизонтальный Термодинамика. Основы термодинамики
Термодинамика. Основы термодинамики Сабақтың тақырыбы Электр тогының жұмысы мен қуаты. Джоуль –Ленц заңы. Ток көзінің пайдалы әсер коэффициенті
Сабақтың тақырыбы Электр тогының жұмысы мен қуаты. Джоуль –Ленц заңы. Ток көзінің пайдалы әсер коэффициенті Буксовый узел грузового вагона. Техническая ревизия буксового узла колесный пары РУ1-Ш
Буксовый узел грузового вагона. Техническая ревизия буксового узла колесный пары РУ1-Ш What is the brake calipers?
What is the brake calipers? Полярография. Ртутно-капающий электрод. Роль метода в медицине и фармации
Полярография. Ртутно-капающий электрод. Роль метода в медицине и фармации Сила Лоренца
Сила Лоренца сила упругости
сила упругости Своя игра. Физика. 7 класс.
Своя игра. Физика. 7 класс. Электромагнитные колебания
Электромагнитные колебания Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас
Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас Трехфазные цепи переменного тока
Трехфазные цепи переменного тока Энергия топлива- урок физики в 8 классе
Энергия топлива- урок физики в 8 классе Влияние на работу дороги природных факторов
Влияние на работу дороги природных факторов Жұмыс орындарындағы электромагниттік сәулеленулер
Жұмыс орындарындағы электромагниттік сәулеленулер Скорость света
Скорость света Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма
Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма Основные законы идеального газа
Основные законы идеального газа Механика. Основные понятия кинематики
Механика. Основные понятия кинематики Аеродинаміка та динаміка польоту літака. Аеродинамічні характеристики крила. (Лекція 5.2.1)
Аеродинаміка та динаміка польоту літака. Аеродинамічні характеристики крила. (Лекція 5.2.1) Совершенствование коробки передач автомобиля УАЗ ПАТРИОТ
Совершенствование коробки передач автомобиля УАЗ ПАТРИОТ Метод кругового дихроизма и дисперсии оптического вращения
Метод кругового дихроизма и дисперсии оптического вращения Constraints application. Solution and computation of reactions, displacements, rotations, stresses and strains. 19 lesson
Constraints application. Solution and computation of reactions, displacements, rotations, stresses and strains. 19 lesson Рулевое управление
Рулевое управление Електричний струм у різних середовищах
Електричний струм у різних середовищах Модальный метод синтеза непрерывных систем
Модальный метод синтеза непрерывных систем