Содержание
- 2. План: Введение 1.Сущность вольтамперометрического анализа 2. Метод полярографии 3. Индикаторные электроды применяемые в полярографии 4. Сущность
- 3. Введение: В настоящее время, когда фармацевтическая промышленность, химическая промышленность и химия как наука в нашей стране
- 4. 1.Сущность вольтамперометрического анализа Вольтамперометрическими называют методы анализа, основанные на регистрации и изучении зависимости тока, протекающего через
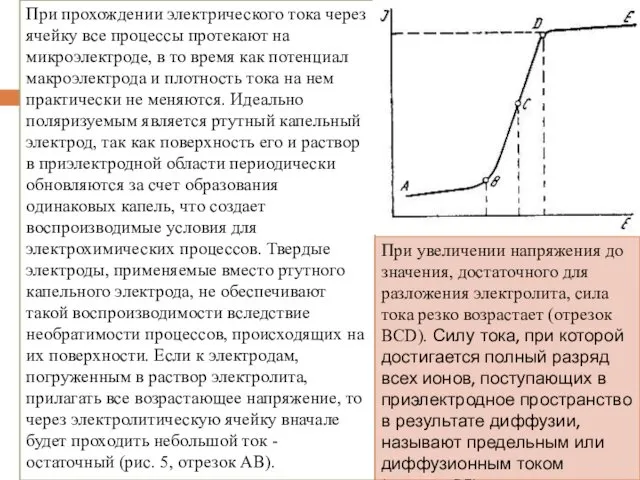
- 5. При прохождении электрического тока через ячейку все процессы протекают на микроэлектроде, в то время как потенциал
- 6. Таким образом, предельный ток пропорционален концентрации определяемого иона в растворе. Кривая зависимости силы тока от напряжения
- 7. Уравнение Ильковича: где Id - сила диффузионного тока, мкА; n - число электронов; С - концентрация,
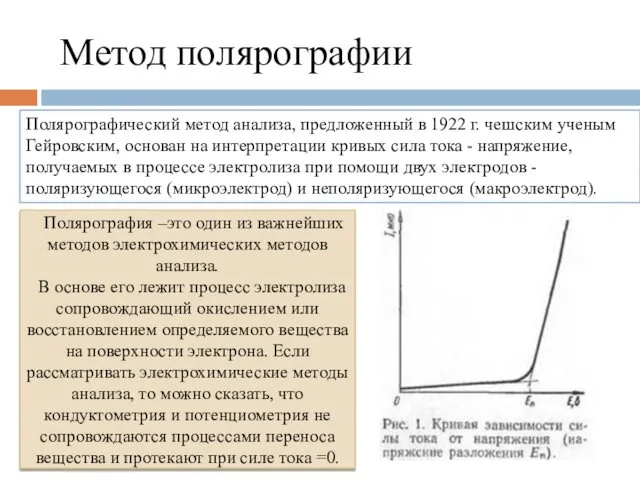
- 8. Метод полярографии Полярографический метод анализа, предложенный в 1922 г. чешским ученым Гейровским, основан на интерпретации кривых
- 9. Вольтамперная кривая в отличие от всех прочих методов позволяет одновременно проводить как качественный, так и количественный
- 10. Поляризацией называется процесс изменения равновесного электродного потенциала, при прохождении через электролит постоянного электрического тока, что бы
- 11. В качестве поляризующегося микроэлектрода часто применяют ртутный капельный электрод, а сам метод называют в этом случаеполярографией,
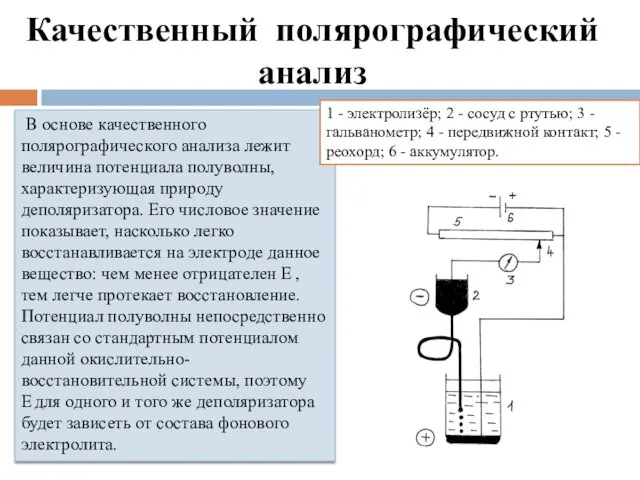
- 12. Качественный полярографический анализ В основе качественного полярографического анализа лежит величина потенциала полуволны, характеризующая природу деполяризатора. Его
- 13. Количественный полярографический анализ Прямая пропорциональная зависимость между диффузионным током (или высотой волны) и концентрацией деполяризатора позволяет
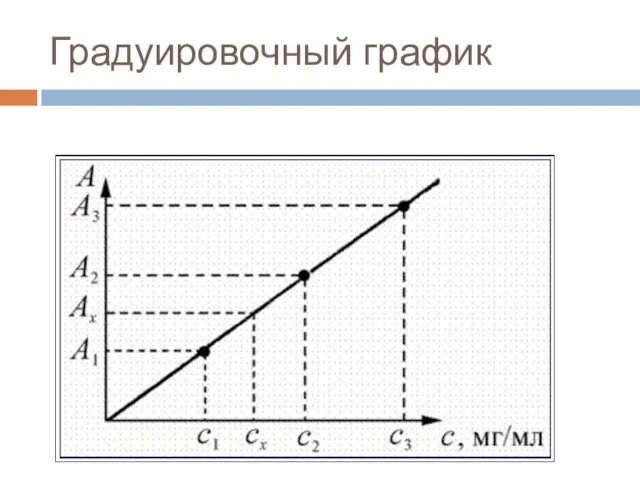
- 14. Метод градуировочного графика. Для построения градуировочного графика готовят серию из 4 – 5 растворов определяемого вещества
- 15. Градуировочный график
- 16. Метод стандартов. При наличии пропорциональной зависимости между высотой волны и концентрацией определяемого вещества можно значительно сократить
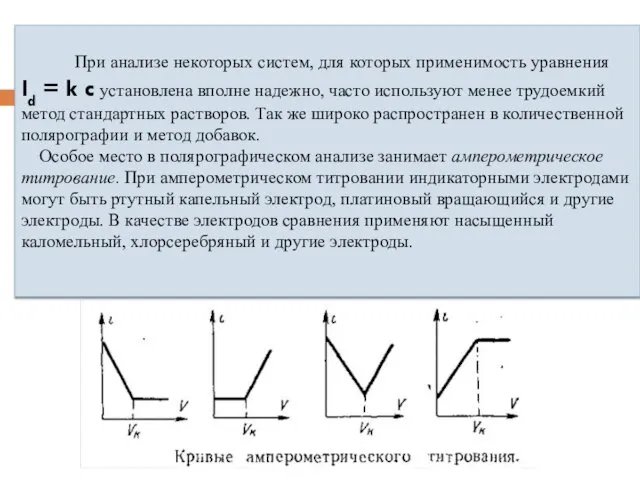
- 17. При анализе некоторых систем, для которых применимость уравнения Id = k c установлена вполне надежно, часто
- 18. Амперометрическое титрование представляет собой разновидность полярографического метода анализа. Амперометрическое титрование проводится следующим образом: часть исследуемого раствора
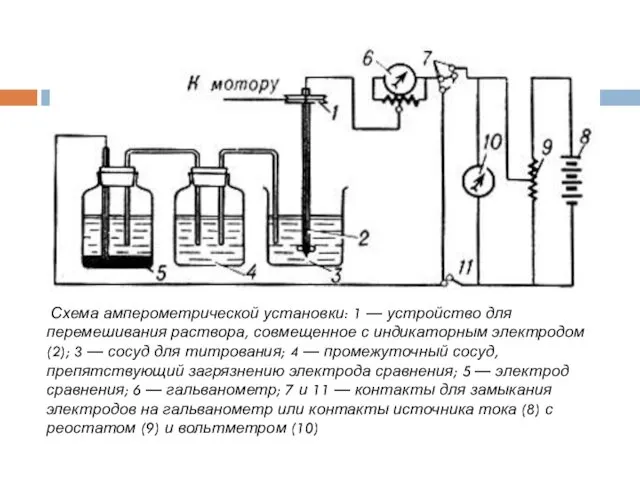
- 19. Схема амперометрической установки: 1 — устройство для перемешивания раствора, совмещенное с индикаторным электродом (2); 3 —
- 20. В полярографическом анализе применяют два вида полярографов: визуальные и автоматические. Фоторегистрирующие полярографы относятся к числу автоматических.
- 21. А. С. Беневольский и С. Б. Цфасман разработали электронный самопишущий полярограф ЦЛА. В этом полярографе кривые
- 22. Заключение Полярография используется для определения малых количеств неорганических и органических веществ. Разработаны тысячи методик количественного полярографического
- 24. Скачать презентацию















 Презентация о Потенциальной и Кинетической энергии
Презентация о Потенциальной и Кинетической энергии Резание металла ручной слесарной ножовкой. 6 класс
Резание металла ручной слесарной ножовкой. 6 класс Трехфазные цепи
Трехфазные цепи Физический биатлон на тему Атмосферное давление
Физический биатлон на тему Атмосферное давление Урок физики в 8 классе Энергия топлива. Удельная теплота сгорания топлива
Урок физики в 8 классе Энергия топлива. Удельная теплота сгорания топлива Анализ сигналов
Анализ сигналов Механизация приготовления грубых кормов на ферме КРС
Механизация приготовления грубых кормов на ферме КРС Принцип суперпозиции электростатических полей. Примеры расчета полей
Принцип суперпозиции электростатических полей. Примеры расчета полей Физические основы магнитопорошкового метода контроля
Физические основы магнитопорошкового метода контроля Источники звука. Высота, тембр, громкость звука.
Источники звука. Высота, тембр, громкость звука. Электронные свойства низкоразмерных электронных систем. Принцип размерного квантования
Электронные свойства низкоразмерных электронных систем. Принцип размерного квантования Звук. Акустика
Звук. Акустика Урок по теме Последовательное соединение проводников 8,9 класс
Урок по теме Последовательное соединение проводников 8,9 класс Равновесие системы тел. Лекция 4
Равновесие системы тел. Лекция 4 Електричний струм в газах. Фізика. 8 клас
Електричний струм в газах. Фізика. 8 клас Электромагниттік өріс
Электромагниттік өріс Some unusual subwavelength resonances and effects: EIT, Fano-resonance, Anapoles. Review
Some unusual subwavelength resonances and effects: EIT, Fano-resonance, Anapoles. Review Электрическое сопротивление
Электрическое сопротивление Закон Ома для участка цепи
Закон Ома для участка цепи Урок-соревнование Восхождение на пик механики
Урок-соревнование Восхождение на пик механики Физический диктант. Электромагнитные явления
Физический диктант. Электромагнитные явления Характеристика жидкого состояния вещества. Лекция 10
Характеристика жидкого состояния вещества. Лекция 10 Агрегатные состояния. Плавление и отвердевание
Агрегатные состояния. Плавление и отвердевание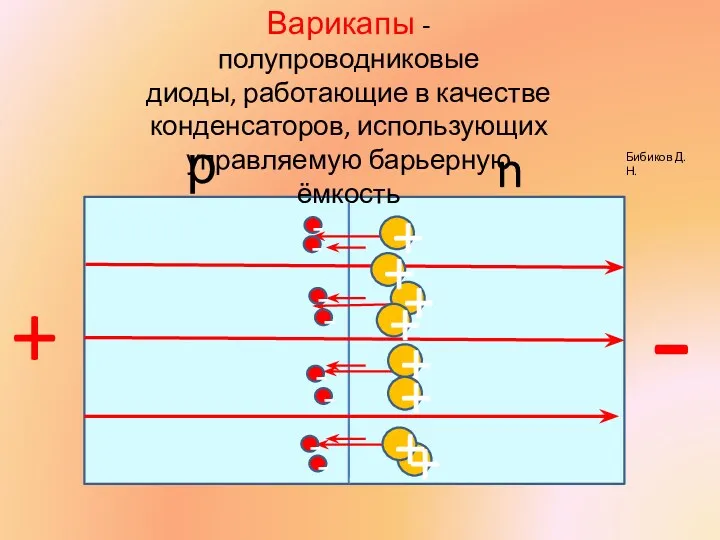 Варикап
Варикап Изопроцессы в газах, решение графических задач
Изопроцессы в газах, решение графических задач Оптическое излучение импульсного объемного разряда в инертных газах высокого давления
Оптическое излучение импульсного объемного разряда в инертных газах высокого давления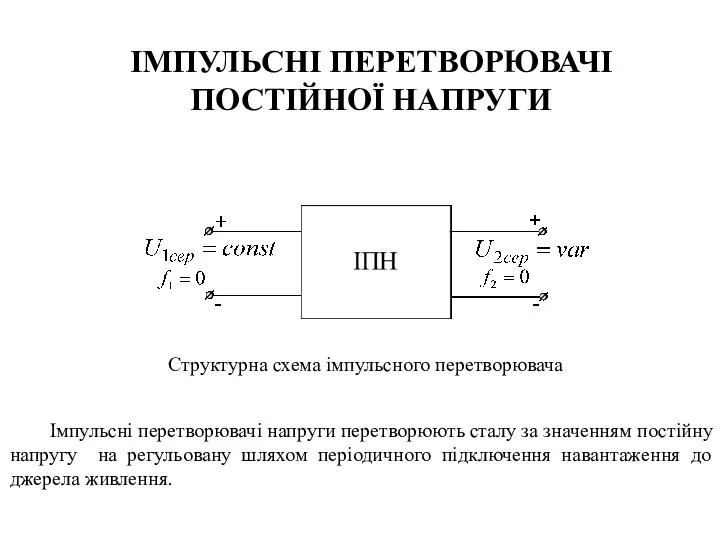 Імпульсні перетворювачі постійної напруги
Імпульсні перетворювачі постійної напруги Тепломассообмен. Теплопроводность
Тепломассообмен. Теплопроводность