Содержание
- 2. Уравнение состояния идеального газа Д.И.Менделеев Клапейрон Бэнуа
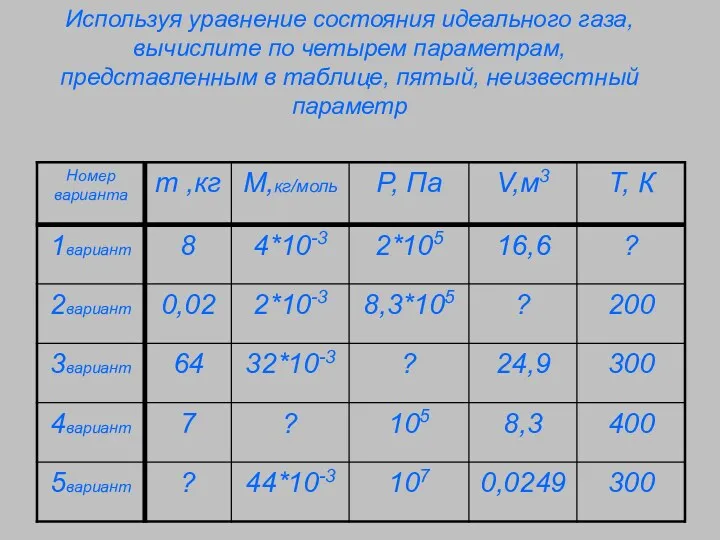
- 3. Используя уравнение состояния идеального газа, вычислите по четырем параметрам, представленным в таблице, пятый, неизвестный параметр
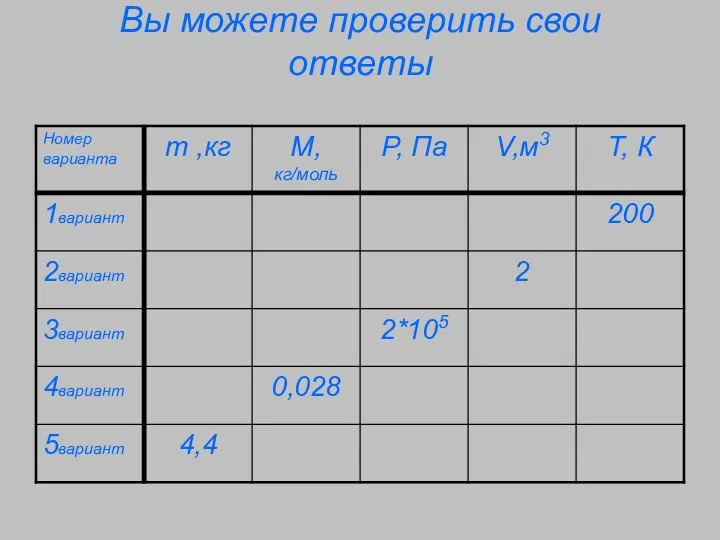
- 4. Вы можете проверить свои ответы
- 5. С помощью Уравнения состояния идеального газа можно исследовать процессы, в которых при постоянной массе один из
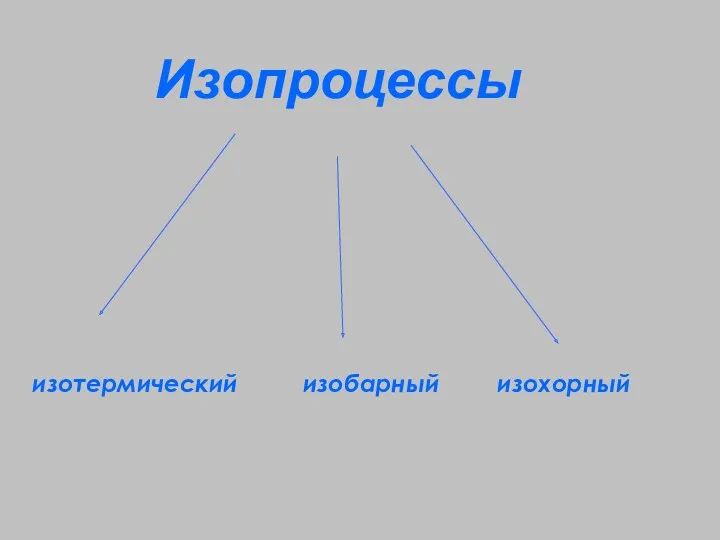
- 6. Изопроцессы – процессы, протекающие при неизменном значении одного из параметров “изо” - постоянство
- 7. Изопроцессы изотермический изобарный изохорный
- 8. PV= m M R T
- 9. Изохорный процесс - процесс изменения состояния термодинамической системы протекающий при постоянном объёме. (от греческих слов isos-
- 10. модель
- 11. 1787 г. Ж. Шарль французский физик экспериментальным путём исследовал зависимость давления газа от температуры.
- 12. Вывод закона для изохорного процесса PV=mRT/M - уравнение Менделеева-Клапейрона при m=const и V=const получаем уравнение: Закон
- 13. р1/T1 = р2/Т2 Для газа данной массы отношение давления к температуре остаётся постоянным при неизменном объёме.
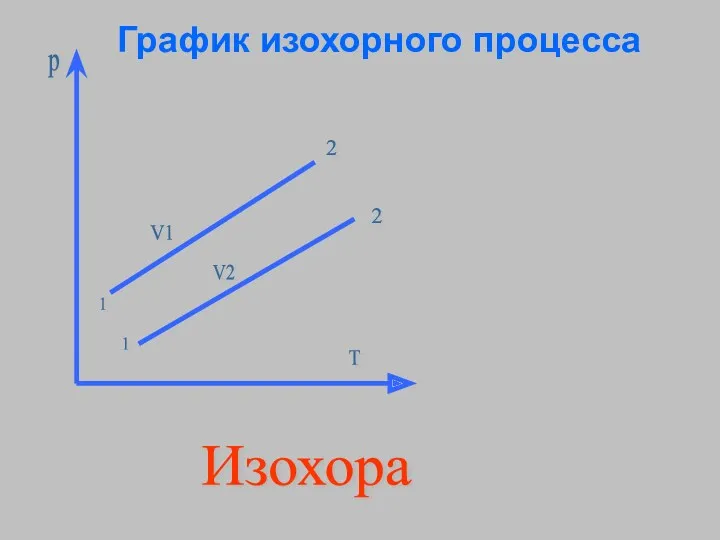
- 14. V1 p T V2 1 2 1 2 Изохора График изохорного процесса
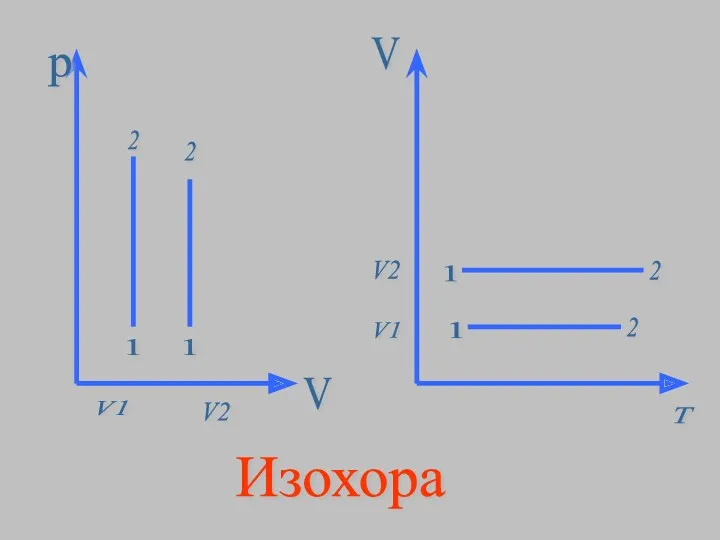
- 15. p V V2 V1 1 2 1 2 V T V1 V2 1 2 1 2
- 16. Изотермический процесс – процесс изменения состояния термодинамической системы протекающий при постоянной температуре (от греческих слов isos-
- 17. модель
- 18. 1662 г. из эксперимента было получено Р. Бойлем (английским учёным) уравнение, устанавливающее связь между давлением и
- 19. Вывод закона для изотермического процесса pave = mRT/μ – закон Менделеева-Клапейрона при m=const и Т=const, получаем
- 20. закон Бойля-Мариотта р1V1 = р2V2 Для газа данной массы произведение давления газа на его объём остаётся
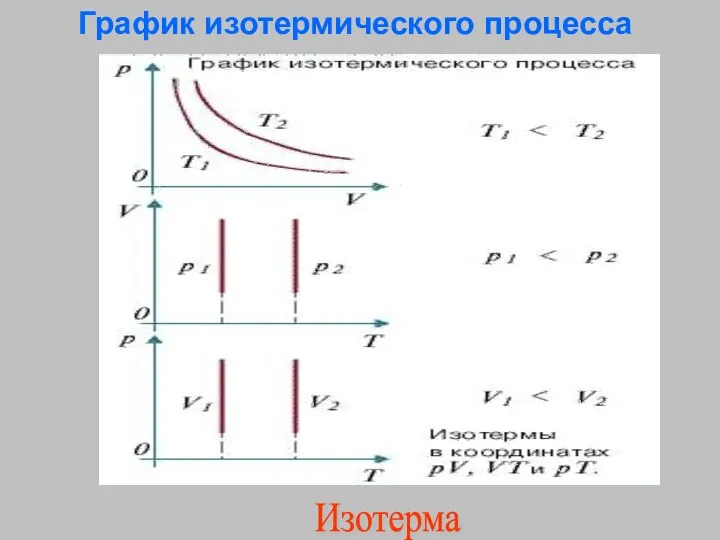
- 21. График изотермического процесса Изотерма
- 22. Изобарный процесс - процесс изменения состояния термодинамической системы протекающий при постоянном давлении. (от греческих слов isos-
- 23. модель
- 24. 1802 г. французский физик Ж. Гей-Люссак провел экспериментальное исследование зависимости объёма газа от температуры. Жозеф Луи
- 25. Вывод закона для изобарного процесса PV=mRT/μ - уравнение Менделеева-Клапейрона при m=const и р=const, получаем уравнение: Закон
- 26. Закон Гей-Люссака V1/Т1 = V2/T2 – Для газа данной массы отношение объёма газа и его температуры
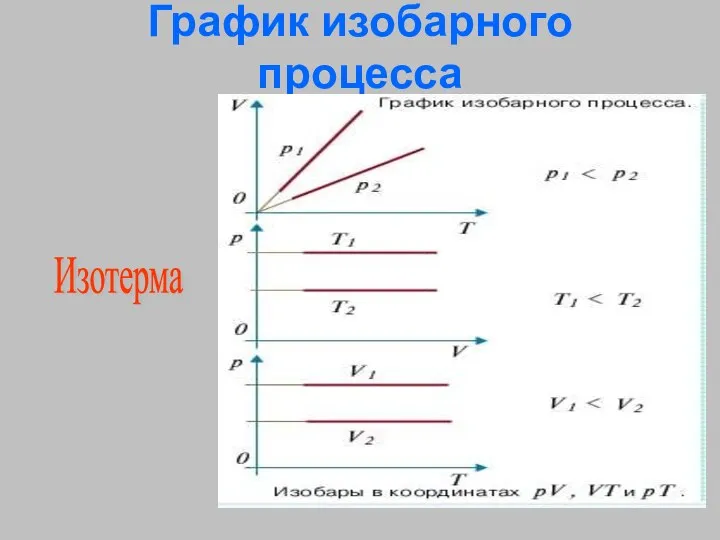
- 27. График изобарного процесса Изотерма
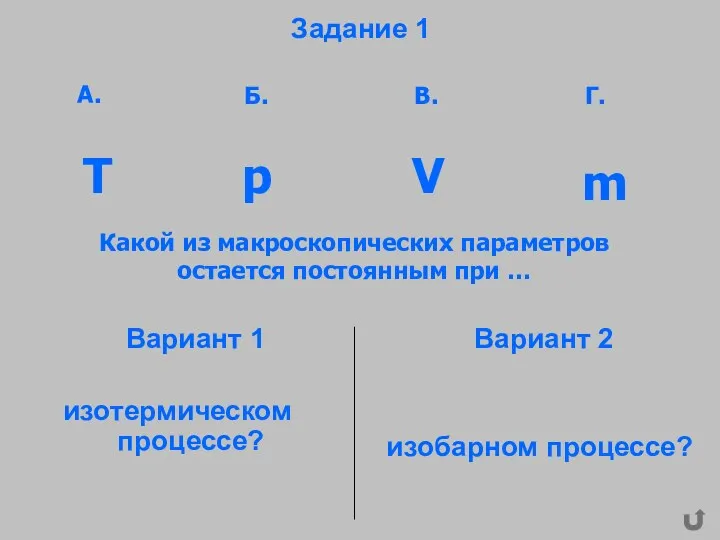
- 28. Задание 1 Вариант 1 изотермическом процессе? Вариант 2 изобарном процессе? Какой из макроскопических параметров остается постоянным
- 29. Задание 2 Какая из формул описывает закон Вариант 1 Вариант 2 Бойля-Мариотта? Гей-Люссака?
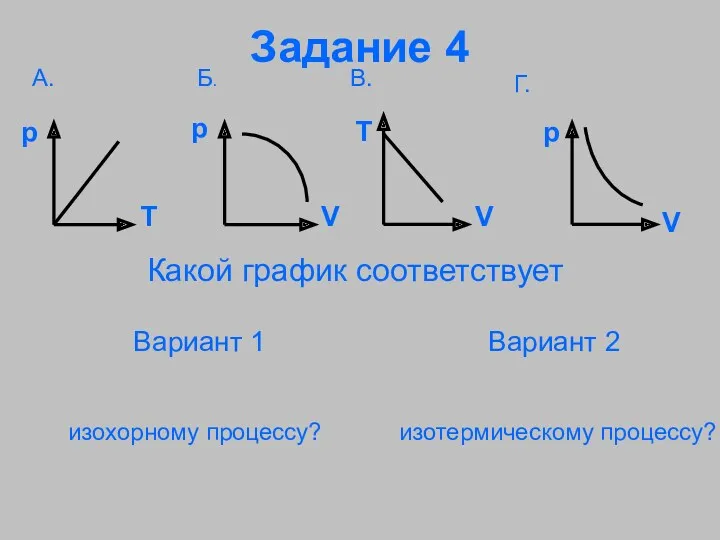
- 31. Задание 4 Какой график соответствует Вариант 1 изохорному процессу? Вариант 2 изотермическому процессу?
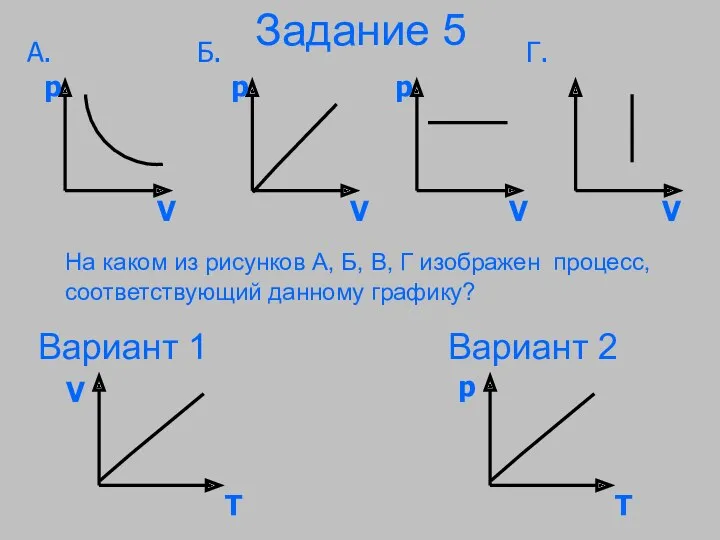
- 32. Задание 5 На каком из рисунков А, Б, В, Г изображен процесс, соответствующий данному графику? Вариант
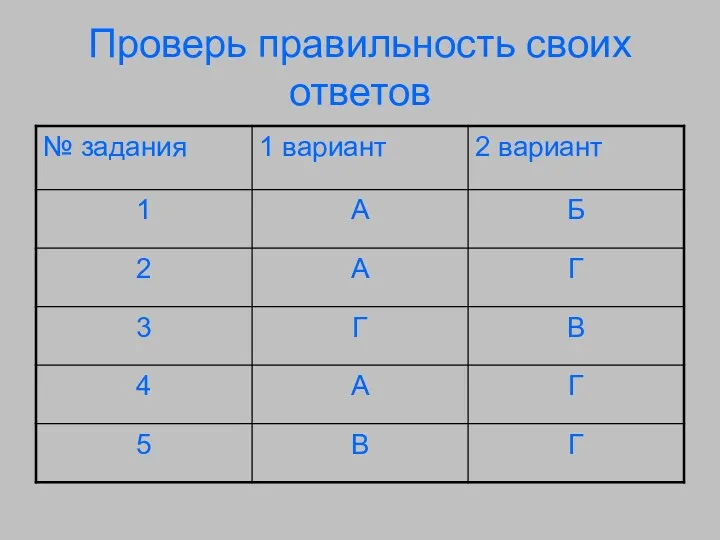
- 33. Проверь правильность своих ответов
- 34. Оцени свои результаты
- 35. Домашнее задание:
- 37. Скачать презентацию



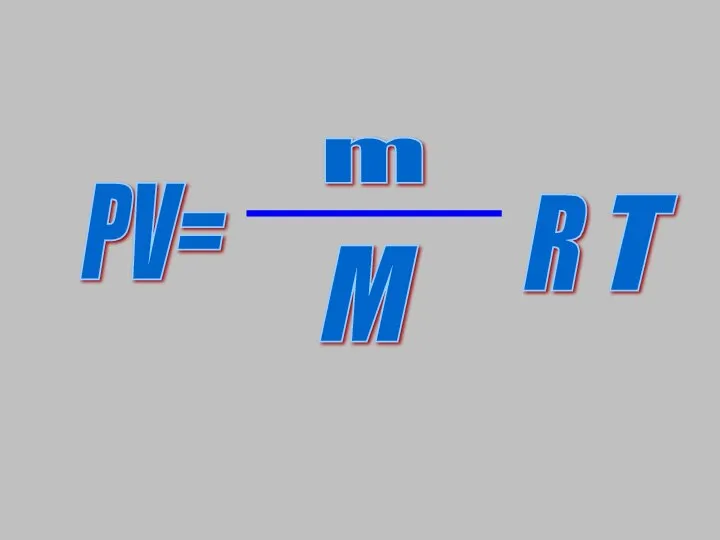



















 Особливості функціонування лінійних та нелінійних кіл. Зворотні зв'язки в електричних колах
Особливості функціонування лінійних та нелінійних кіл. Зворотні зв'язки в електричних колах Машиналар мен аппараттардың технико-экономикалық көрсеткіштері
Машиналар мен аппараттардың технико-экономикалық көрсеткіштері Световые явления природы
Световые явления природы Лазерные сканирующие системы
Лазерные сканирующие системы Лекция 23. Тема 5. Оптика. Волновая оптика. Интерференция света. Принцип суперпозиции волн. Монохроматичность и когерентность
Лекция 23. Тема 5. Оптика. Волновая оптика. Интерференция света. Принцип суперпозиции волн. Монохроматичность и когерентность Распространяющиеся в пространстве возмущения электромагнитного поля
Распространяющиеся в пространстве возмущения электромагнитного поля Зануление
Зануление Механические колебания
Механические колебания The importance of the direct to reverberant ratio in the perception of distance, localization, clarity, and envelopment
The importance of the direct to reverberant ratio in the perception of distance, localization, clarity, and envelopment Кинематика
Кинематика Ремонт автомобилей. Восстановление деталей сваркой и наплавкой. (Тема 3.4)
Ремонт автомобилей. Восстановление деталей сваркой и наплавкой. (Тема 3.4) Простые механизмы
Простые механизмы Холодильные и теплонасосные установки
Холодильные и теплонасосные установки Конструкция и эксплуатация систем двигателя
Конструкция и эксплуатация систем двигателя Измерение работы силы трения, расчет погрешностей косвенных измерений
Измерение работы силы трения, расчет погрешностей косвенных измерений Кривошипно-шатунный механизм
Кривошипно-шатунный механизм Методы и средства статических испытаний летательного аппарата
Методы и средства статических испытаний летательного аппарата История лампы накаливания
История лампы накаливания Звук. Характеристики звука. Акустический резонанс. Эхо. Ультразвук
Звук. Характеристики звука. Акустический резонанс. Эхо. Ультразвук Свет. 9 класс
Свет. 9 класс Разработка урока по теме Механическая работа
Разработка урока по теме Механическая работа Эффект Доплера
Эффект Доплера Физические основы работы оптических волокон
Физические основы работы оптических волокон Топлива, применяемые на воздушных судах и наземной технике. Эксплуатационные свойства топлив. (Тема 2.1)
Топлива, применяемые на воздушных судах и наземной технике. Эксплуатационные свойства топлив. (Тема 2.1) Формула Максвелла для относительных скоростей
Формула Максвелла для относительных скоростей Исследование математических колебаний
Исследование математических колебаний Как появился замок
Как появился замок Решение задач. Закон сохранения заряда . Закон Кулона. Напряженность поля точечного заряда
Решение задач. Закон сохранения заряда . Закон Кулона. Напряженность поля точечного заряда