Содержание
- 2. Системы Гомогенные – системы, представленные одной фазой (истинные растворы: раствор поваренной соли в воде) Гетерогенные –
- 3. Гетерогенное равновесие Равновесие, устанавливающееся на границе раздела фаз Смещением химического равновесия называется процесс, возникающий в равновесной
- 4. Процесс растворения Межмолекулярные взаимодействия между растворителем и веществом с образованием сольватов (ассоциатов из молекул вещества и
- 5. Растворимость Концентрация насыщенного раствора данного вещества при определенной температуре Молярная концентрация вещества – количество растворенного вещества
- 6. Вещества Неограниченно растворимые – смешиваются с растворителем в любом соотношении Хорошо растворимые Малорастворимые Часть малорастворимого вещества
- 7. Растворимость малорастворимого сильного электролита Зависит от: Природы вещества и растворителя Температуры Давления Присутствия других электролитов в
- 8. Классификация растворов Насыщенный – термодинамически устойчивая равновесная система, в которой скорость растворения вещества равна скорости его
- 9. Получение пересыщенного раствора Из насыщенных растворов, изменяя какие-либо условия: температуру, давление или концентрацию растворенных веществ Растворы
- 10. Растворение малорастворимых электролитов При растворении кристаллов в воде протекают два процесса: Ионы соли переходят в раствор
- 11. Константа растворимости КР (произведение растворимости ПР) Характеризует растворимость электролита при данной температуре и зависит от природы
- 12. Произведение растворимости Величина, равная произведению равновесных концентраций ионов данного электролита в его насыщенном растворе в степенях,
- 13. ПР позволяет вычислить концентрацию (растворимость) насыщенного раствора малорастворимого или практически нерастворимого электролита Пример для AgCl [Ag+]
- 14. По значениям ПР можно определять направление протекания ионнообменных реакций в растворах в тех случаях, когда и
- 15. Условия смещения ионного гетерогенного равновесия Подчиняется принципу Ле Шателье Принцип позволяет сделать лишь качественное заключение о
- 16. Растворение осадка Осадок малорастворимого сильного электролита растворяется, если его ионное произведение в растворе станет меньше величины
- 17. Связывание ионов в слабый электролит, газ, или комплексное соединение Mg(OH)2↓ + 2HCl = MgCl2 + 2H2O
- 18. Образование осадка Осадок малорастворимого сильного электролита образуется, если его ионное произведение в растворе станет больше величины
- 19. Условия образования осадка Введение в раствор одноименных ионов Пример AgCl↓ ⮀ Ag+(р) + Cl-(р) добавить HCl
- 20. Последовательность осаждения ионов Если к раствору, содержащему смесь ионов, добавить ион, который осаждает каждый из них,
- 21. Если к раствору, содержащему анионы Cl-, Br-, I-, добавить ион-осадитель – Ag+, осадки будут выпадать в
- 22. Достижение полноты осаждения ионов Для достижения полноты осаждения одного вида ионов малорастворимого сильного электролита из его
- 23. Влияние различных факторов на полноту осаждения осадков и их растворение Природа осаждаемого вещества, осадителя, растворителя Концентрация
- 24. Влияние температуры Процесс электролитической диссоциации – эндотермический, т.к. для разрыва молекулы (или кристалла) необходимо затратить энергию
- 25. Расслоение Характерно для пересыщенных водных растворов ограниченно растворимых органических веществ: большинство спиртов, кетонов, карбоновых кислот, эфиров
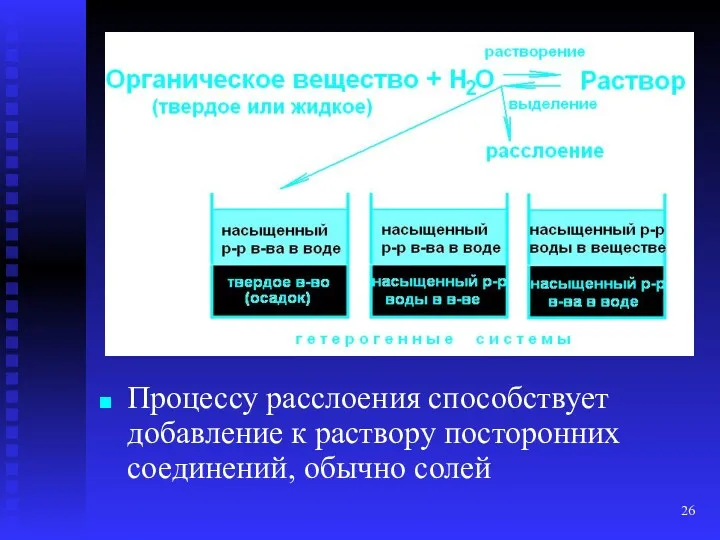
- 26. Процессу расслоения способствует добавление к раствору посторонних соединений, обычно солей
- 27. Процессы расслоения Приводят к резкому изменению биологических функций клетки Анестетики – вещества, в присутствии которых происходит
- 28. Процессы расслоения и выделения в медико-биологической практике Обратимые процессы выделения, при которых осаждаемые вещества не подвергаются
- 29. Практически необратимые процессы выделения, когда наблюдаются глубокие изменения структуры Добавление солей тяжелых металлов (Cu, Ag, Hg,
- 30. Высаливание Уменьшение растворимости веществ в присутствии солей Высаливающее действие ионов тем больше, чем лучше они гидратируются
- 31. Гетерогенные равновесия в живых системах Формирование костной ткани и камней при почечной и желчнокаменной болезнях
- 32. Формирование костной ткани В клетках костной ткани остеобласты (рН = 8,3) минерализация 5Ca2+ + 3HPO42- +
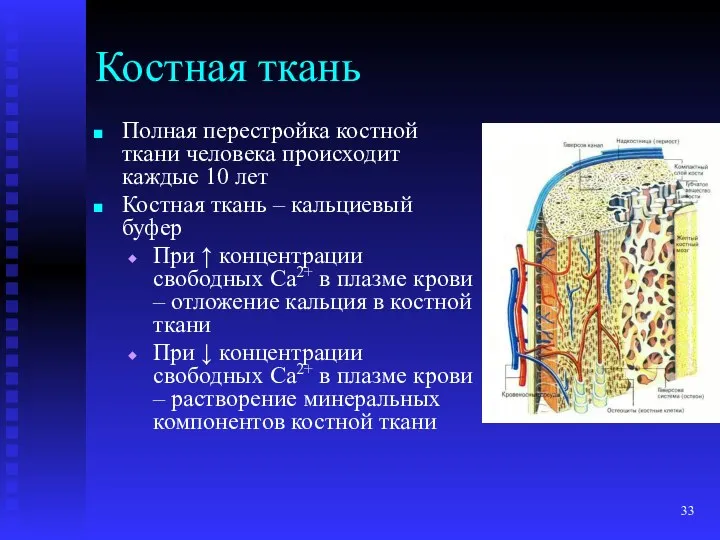
- 33. Костная ткань Полная перестройка костной ткани человека происходит каждые 10 лет Костная ткань – кальциевый буфер
- 34. Регуляторы кальций-фосфорного обмена в организме Витамин D – процессы всасывания ионов кальция и фосфатов из кишечника
- 35. Особенности процесса камнеобразования Камнеобразование – сложный физико-химический процесс, в основе которого лежит не только образование малорастворимых
- 36. В кислой среде мочи (рН В щелочной среде (рН > 7) могут образовываться малорастворимые фосфаты кальция
- 37. Принцип лечения почечнокаменной болезни Растворение камней за счет извлечения из них ионов кальция комплексообразователями (ЭДТА и
- 38. Желчнокаменная болезнь Образование холестериновых камней, билирубината кальция и карбоната кальция
- 40. Скачать презентацию



































 Связанные волны в нелинейной среде
Связанные волны в нелинейной среде Нелинейные цепи
Нелинейные цепи краткий справочник по физике-7
краткий справочник по физике-7 Естественная радиоактивность. Схема по радиоактивности
Естественная радиоактивность. Схема по радиоактивности Сопротивляемость человеческого тела в разных условиях
Сопротивляемость человеческого тела в разных условиях Исследовательский проект Машина Голдберга Разбивалка яйиц
Исследовательский проект Машина Голдберга Разбивалка яйиц Режимы работы промышленных электрических сетей
Режимы работы промышленных электрических сетей Экономия электрической энергии и использование энергоэффективных ламп
Экономия электрической энергии и использование энергоэффективных ламп Философские проблемы физики и астрономии
Философские проблемы физики и астрономии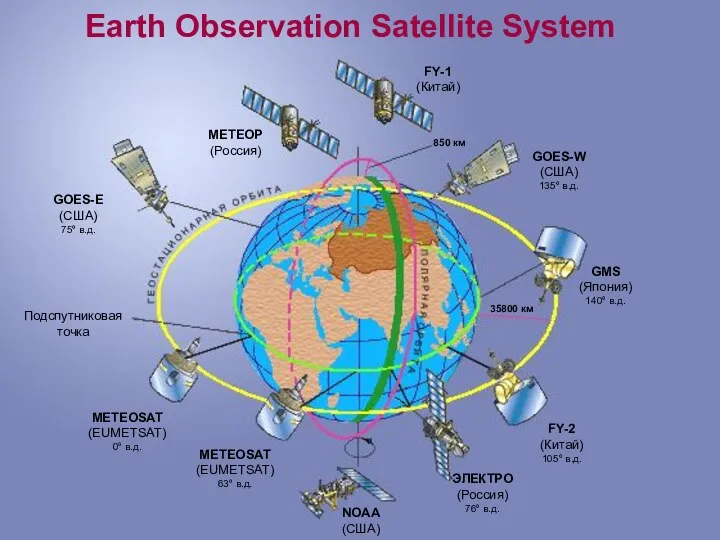 Earth observation satellite system
Earth observation satellite system Параллельное и последовательное соединение
Параллельное и последовательное соединение Молекулярно-кинетические свойства коллоидных систем
Молекулярно-кинетические свойства коллоидных систем Электромагнитная индукция
Электромагнитная индукция Электростатика. Электростатическое поле
Электростатика. Электростатическое поле Термодинамика. Первое начало термодинамики
Термодинамика. Первое начало термодинамики Звуковые волны. Скорость звука.
Звуковые волны. Скорость звука. Есть чем гордится.Достижения мох учеников.
Есть чем гордится.Достижения мох учеников. Интерференция света
Интерференция света Влажность воздуха
Влажность воздуха Закон сохранения и превращения механической энергии
Закон сохранения и превращения механической энергии Компрессор КТ-6
Компрессор КТ-6 Техническое обслуживание и ремонт автомобильного транспорта
Техническое обслуживание и ремонт автомобильного транспорта Уравнение вращения твердого тела вокруг неподвижной оси. Момент инерции
Уравнение вращения твердого тела вокруг неподвижной оси. Момент инерции Интеллектуальная игра по теме: Основы молекулярно-кинетической теории
Интеллектуальная игра по теме: Основы молекулярно-кинетической теории Оценка сложившейся работы вагонов по износу гребня колесной пары
Оценка сложившейся работы вагонов по износу гребня колесной пары Голография. История голографии
Голография. История голографии Атомные спектры
Атомные спектры Поляризация света
Поляризация света