Содержание
- 2. Первое начало термодинамики Формула Майера Постоянная адиабаты:
- 3. Изопроцессы. Работа в изопроцессах (квазистатических, равновесных) Изохорический процесс: V=const. Изобарический процесс: p=const. Изотермический процесс: Т =
- 4. Работа в изопроцессах Адиабатический процесс: δQ = 0. Адиабатическим называется процесс, протекающий при отсутствии теплообмена с
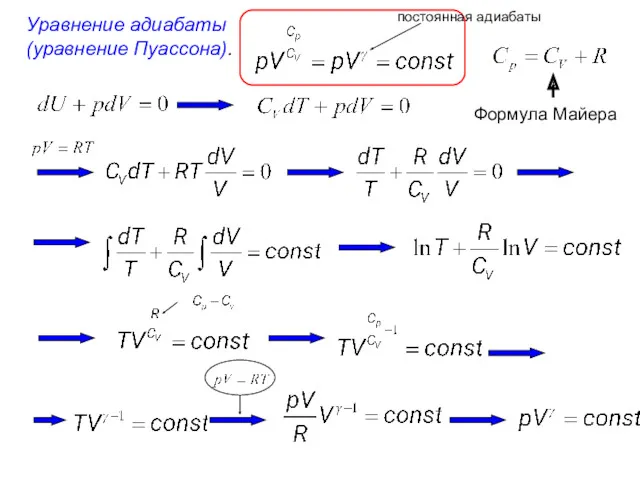
- 5. Уравнение адиабаты (уравнение Пуассона). постоянная адиабаты Формула Майера
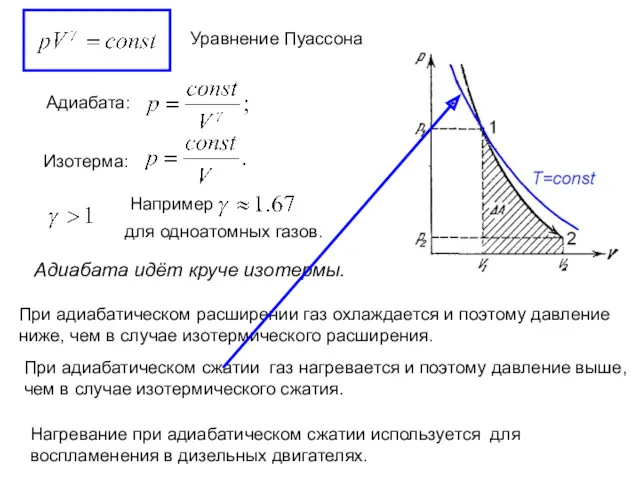
- 6. Уравнение Пуассона Адиабата: Изотерма: Адиабата идёт круче изотермы. При адиабатическом расширении газ охлаждается и поэтому давление
- 7. Работа при адиабатическом процессе (для 1 моля) В двигателях внутреннего сгорания и при истечении газов через
- 8. Изопроцессы. Работа в изопроцессах (квазистатических, равновесных) Изохорический процесс: V=const. Изобарический процесс: p=const. Изотермический процесс: Т =
- 9. Второе начало термодинамики Энергия теплового движения может превратиться в любой другой вид энергии лишь частично. В
- 10. Второе начало термодинамики Другая форма формулировки Кельвина КПД тепловой машины (теплового цикла) Невозможно создать тепловой двигатель
- 11. Вечный двигатель второго рода — воображаемая машина, которая, превращала бы в работу всё тепло, извлекаемое из
- 12. Второе начало термодинамики Энтропия Понятие энтропии было введено Клаузиусом (1865) и является характеристикой необратимости процессов. Понятие
- 13. Второе начало термодинамики Энтропия , При таком введении энтропии можно вычислять только разность энтропий для разных
- 14. Второе начало термодинамики Энтропия Важнейшее свойство энтропии: Энтропия замкнутой (теплоизолированной, внешние силы не совершают работу) макросистемы
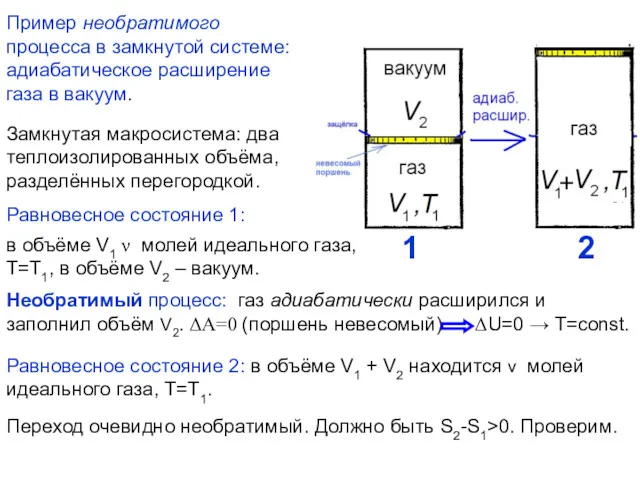
- 15. Пример необратимого процесса в замкнутой системе: адиабатическое расширение газа в вакуум. Замкнутая макросистема: два теплоизолированных объёма,
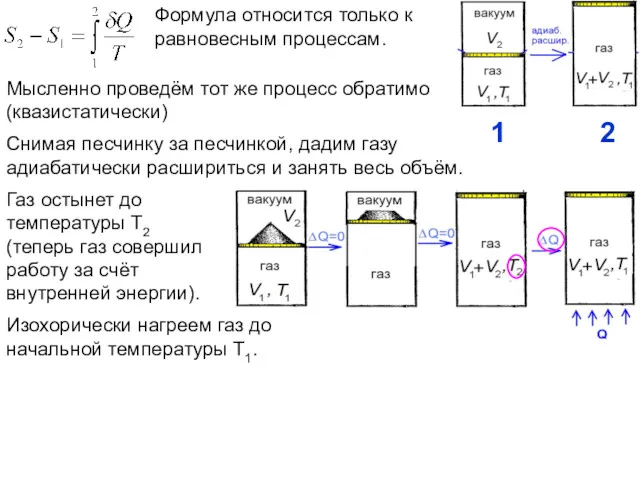
- 16. Мысленно проведём тот же процесс обратимо (квазистатически) Снимая песчинку за песчинкой, дадим газу адиабатически расшириться и
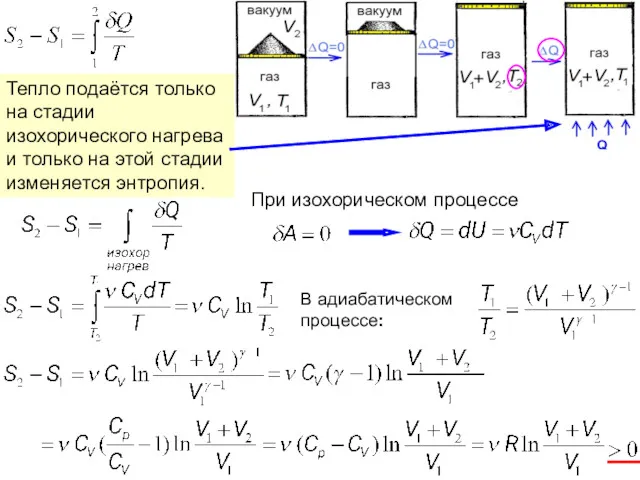
- 17. Тепло подаётся только на стадии изохорического нагрева и только на этой стадии изменяется энтропия. При изохорическом
- 18. Расширение газа в замкнутой системе приводит к росту энтропии. Самопроизвольно он может протекать лишь в одну
- 19. Статистический смысл энтропии С другой стороны, макросистема представляет собой ансамбль огромного числа частиц, поведение которых подчиняется
- 20. Термодинамическая вероятность (статистический вес). Макросостояние характеризуется термодинамическими параметрами p, V, T. Но, макросистема состоит из громадного
- 21. Термодинамическая вероятность (статистический вес). Число способов, которым можно разместить одну молекулу в объёме V пропорционально V.
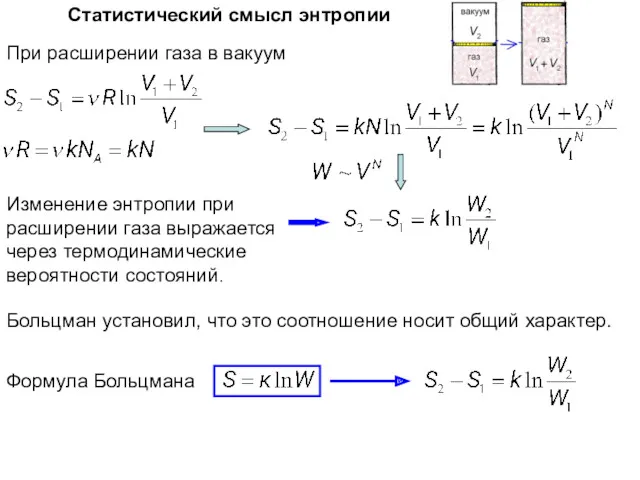
- 22. Статистический смысл энтропии При расширении газа в вакуум Формула Больцмана Больцман установил, что это соотношение носит
- 23. Статистический смысл энтропии В замкнутой системе самопроизвольные процессы совершаются в направлении более вероятных состояний. Более вероятные
- 24. Третье начало термодинамики При Т = 0 К При абсолютном нуле энтропия тела обращается в нуль.
- 25. Основное уравнение термодинамики для обратимых (квазистатических) процессов (объединяет 1 и 2 начала). Для обратимых процессов Энтропия
- 26. Энтропия идеального газа Энтропия возрастает при увеличении V и T (больше беспорядка). При Т2=Т1 Адиабатическое расширение
- 27. Согласно второму началу нельзя отнять от нагретого тела количество тепла ΔQ1 и полностью превратить его в
- 28. Для получения работы необходимо «рабочее тело», которое должно вернуться в исходное состояние, т. е. совершить замкнутый
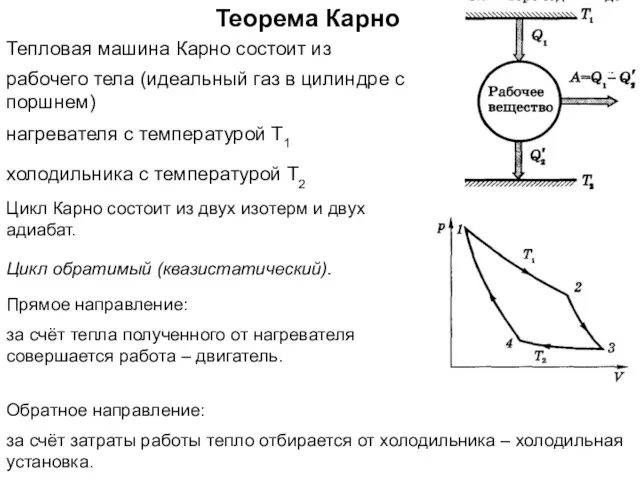
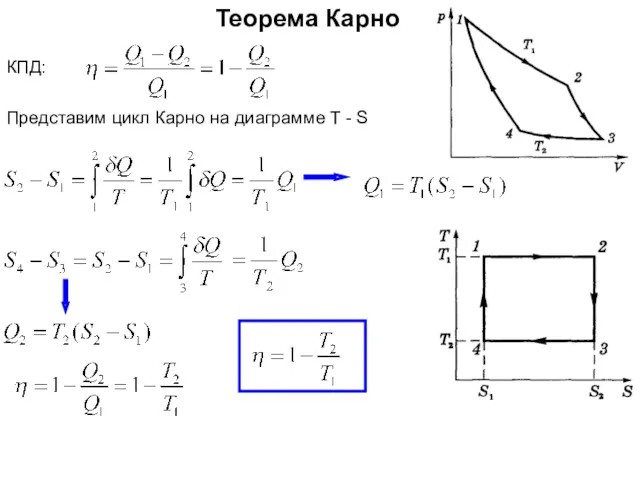
- 29. Теорема Карно Тепловая машина Карно состоит из нагревателя с температурой Т1 рабочего тела (идеальный газ в
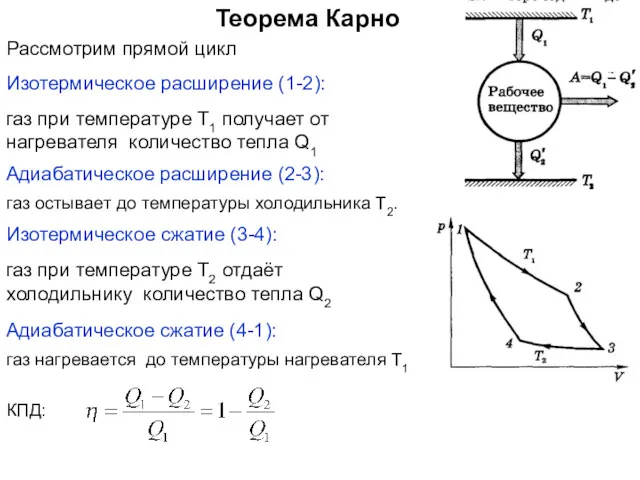
- 30. Теорема Карно Изотермическое сжатие (3-4): Адиабатическое расширение (2-3): Изотермическое расширение (1-2): газ при температуре Т1 получает
- 31. Теорема Карно КПД: Представим цикл Карно на диаграмме T - S
- 33. Скачать презентацию





















 Задачи по гидростатике
Задачи по гидростатике работа и мощность эл.тока
работа и мощность эл.тока Потенциал. Решение задач
Потенциал. Решение задач Методика проведения фронтального опроса по физике Диск
Методика проведения фронтального опроса по физике Диск Lektsia_14_Lazery
Lektsia_14_Lazery Гидромеханические процессы
Гидромеханические процессы Архитектурностроительная акустика
Архитектурностроительная акустика Аеродинаміка та динаміка польоту літака. Характеристики профілю крила. Поздовжні аеродинамічні сили та момент. (Лекція 3.2.1)
Аеродинаміка та динаміка польоту літака. Характеристики профілю крила. Поздовжні аеродинамічні сили та момент. (Лекція 3.2.1) Колориметрические методы анализа
Колориметрические методы анализа Ядерные реакции. Энергия связи атомного ядра
Ядерные реакции. Энергия связи атомного ядра Задачи на движение
Задачи на движение Геометрическая оптика
Геометрическая оптика Развёрнутый план - конспект урока по физике в 8 классе Кипение
Развёрнутый план - конспект урока по физике в 8 классе Кипение Выяснение условия равновесия рычага
Выяснение условия равновесия рычага Оптические явления в природе
Оптические явления в природе Компрессоры поршневые. История развития
Компрессоры поршневые. История развития Задачи по статике. (10 класс)
Задачи по статике. (10 класс) Инфракрасное излучение
Инфракрасное излучение Конспект открытого урока по теме: Строение газообразных, жидких и твёрдых тел.
Конспект открытого урока по теме: Строение газообразных, жидких и твёрдых тел. Колебательное движение.
Колебательное движение. Скорость движения жидкости как сплошной среды
Скорость движения жидкости как сплошной среды Зміна сили струму в колі. Реостат
Зміна сили струму в колі. Реостат Закон Архимеда. Архимед (287 - 212 до н.э.)
Закон Архимеда. Архимед (287 - 212 до н.э.) Расчёт статически неопределимой рамы методом перемещений. Пример 2
Расчёт статически неопределимой рамы методом перемещений. Пример 2 Своя игра по физике
Своя игра по физике Характеристики тел и веществ презентация к уроку естествознания 5 класс ФГОС
Характеристики тел и веществ презентация к уроку естествознания 5 класс ФГОС Шарнирные, статически определимые балки
Шарнирные, статически определимые балки Классификация методов спектрального анализа и схемы его проведения
Классификация методов спектрального анализа и схемы его проведения