Слайд 2

Классификация спектров
или методов спектрального анализа.
Слайд 3

1. Спектральный анализ по виду спектра
а) линейчатый (испускание или поглощение
атомами);
б) полосатый (испускание или поглощение молекулами);
в) сплошной (излучение раскалёнными твёрдыми телами или жидкостями).Все длины волн от красного до фиолетового.
Слайд 4
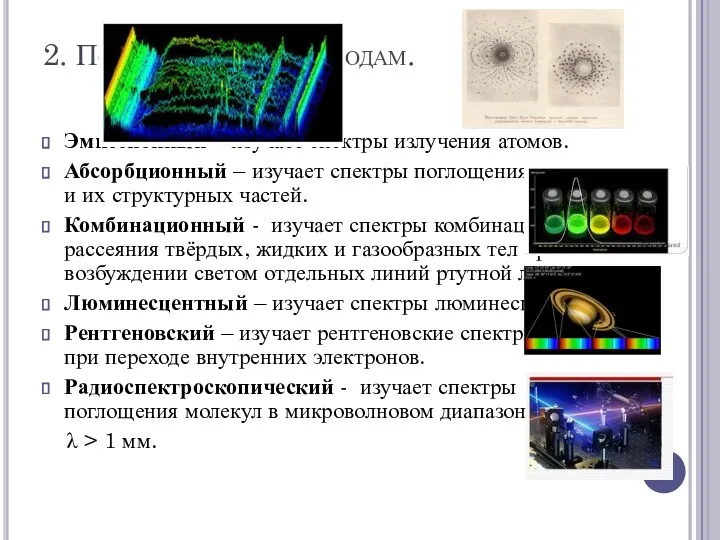
2. По применяемым методам.
Эмиссионный – изучает спектры излучения атомов.
Абсорбционный – изучает
спектры поглощения молекул и их структурных частей.
Комбинационный - изучает спектры комбинационного рассеяния твёрдых, жидких и газообразных тел при возбуждении светом отдельных линий ртутной лампы.
Люминесцентный – изучает спектры люминесценции.
Рентгеновский – изучает рентгеновские спектры атомов при переходе внутренних электронов.
Радиоспектроскопический - изучает спектры поглощения молекул в микроволновом диапазоне
λ > 1 мм.
Слайд 5

3. По характеру полученных результатов.
Качественный - определяет только состав без указания
на количественное соотношение компонентов.
Полуколичественный (или приблизительный) - результат получается в виде оценки содержания компонентов в некотором узком интервале концентрации.
Количественный - получают полное количественное содержание опредёлённых элементов или соединений в пробе.
Слайд 6
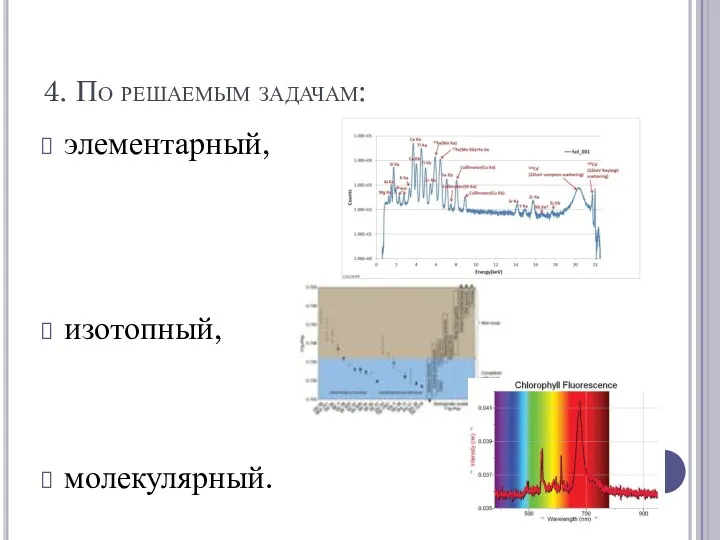
4. По решаемым задачам:
элементарный,
изотопный,
молекулярный.
Слайд 7
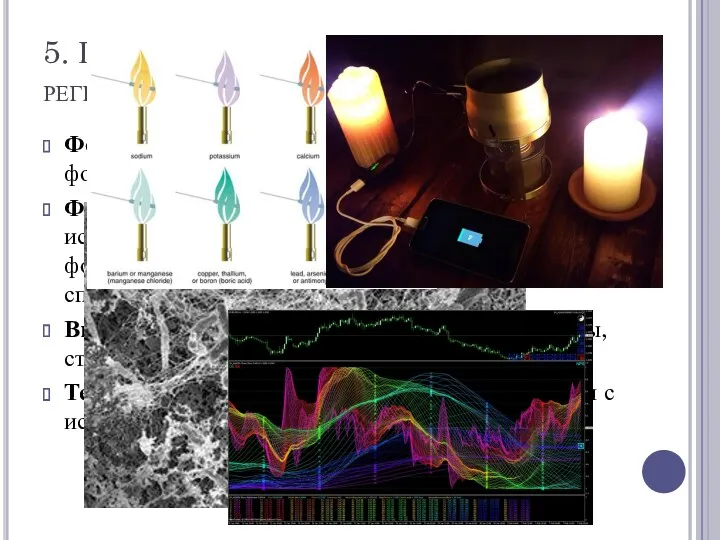
5. По методам регистрации (по регистрационному прибору)
Фотографический – фотоплёнка или фотопластинка,
спектрографы.
Фотоэлектрический для инфракрасной области с использованием фотоэлемента и фотоэлектроумножителей. Спектрофотометры, спектрометры.
Визуальный – для видимой области, спектроскопы, стелоскоп.
Термоэлектрический – для инфракрасной области с использованием термоэлементов.
Слайд 8

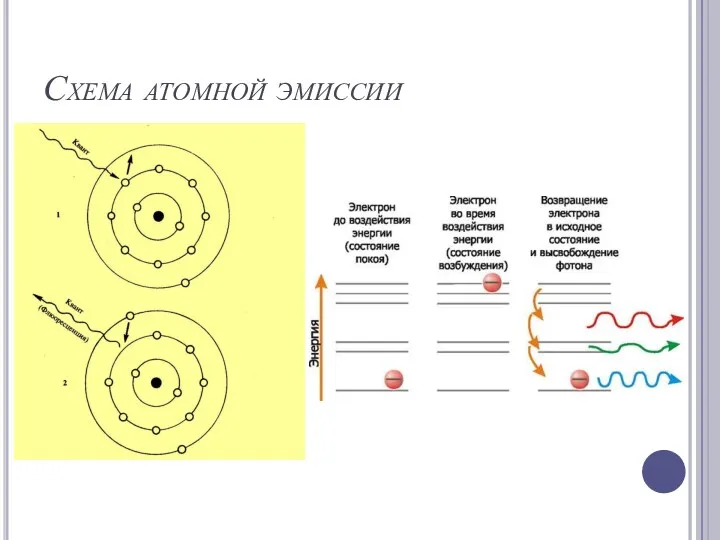
Происхождение атомных спектров
Слайд 9
Слайд 10
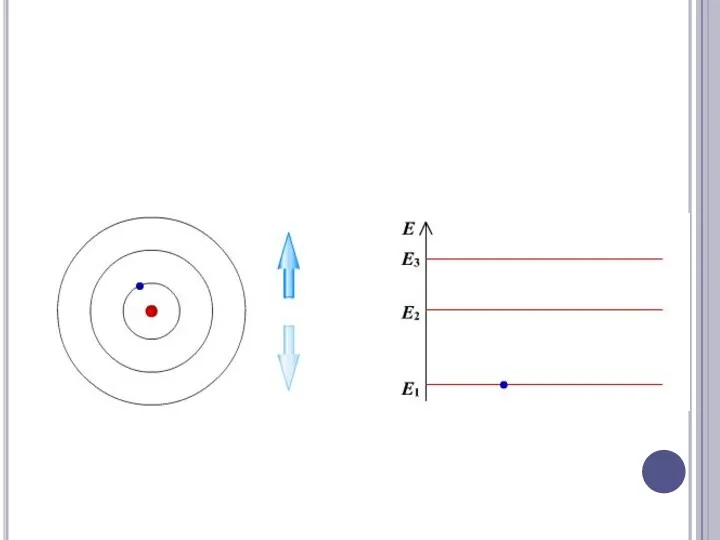
Слайд 11

Схема уравнений атомов
В обычном состоянии молекулы или атомы обладают минимальным запасом
внутренней энергии - нормальное или основное состояние (Е0).
Квантовая энергия – энергетическое состояние, которое описывается 4 квантовыми числами (n, l, m, ms)
Слайд 12

Квантовые числа
n – главное квантовое число показывает удаленность энергетического уровня от
ядра n связано с электростатическим взаимодействием ядра и электронов в атоме.
l (L) – орбитальное квантовое число описывает форму электронных орбиталей. α связана с электростатическим взаимодействием электронов между собой l =n-1.
Слайд 13

Квантовые числа
m (mL) – магнитное орбитальное число характеризует количество возможных электронных
орбит и принимает значение m= - l … 0+l.
ms – магнитное спиновое число, описывает направленность спина электрона ±1/2.
n, l, m, ms –связаны с магнитным взаимодействием между собой.
Слайд 14
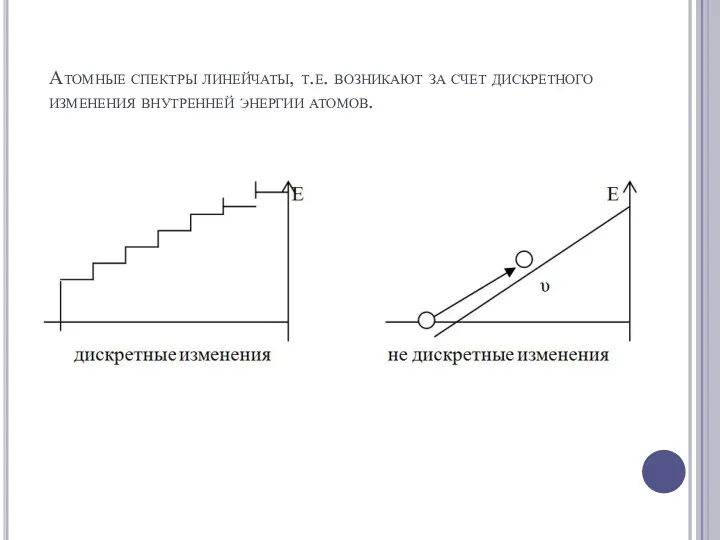
Атомные спектры линейчаты, т.е. возникают за счет дискретного изменения внутренней энергии
атомов.
Слайд 15

Оптические спектры атомов возникают за счет поглощения или испускания энергии оптическими
электронами внешних энергетических уровней (валентные). Каждый спектр атома индивидуальный.
Атомный спектр – совокупность длин волн (частоты), характеризующих поглощение или излучение данного атома. Самые интенсивные линии в спектре происходят за счёт наиболее вероятных переходов.
Энергия ионизации (потенциал ионизации) – значение энергии необходимой для отрыва данного электрона.
Потенциал возбуждения – значение энергии необходимой для перехода одного электрона на более высокий энергетический уровень.
Слайд 16

правило отбора
1. В каждом атоме возбуждается только один электрон.
2. Разрешены переходы
только между уровнями соседних конфигураций (природа электронных орбиталей), т.е. L или n меняется на единицу.
S → P → d → f
Пример
В атоме Na+11 1s22s22p63s4 разрешены следующие переходы:
3s → 3p, 3s → 4s, 3s → 4р
Слайд 17
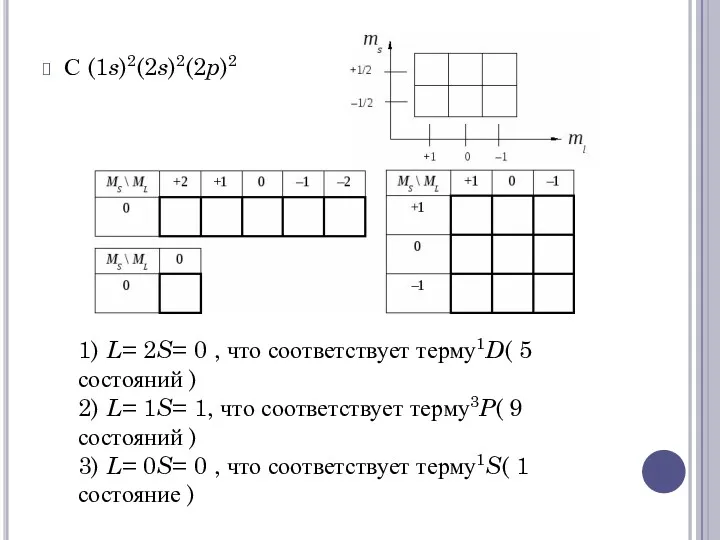
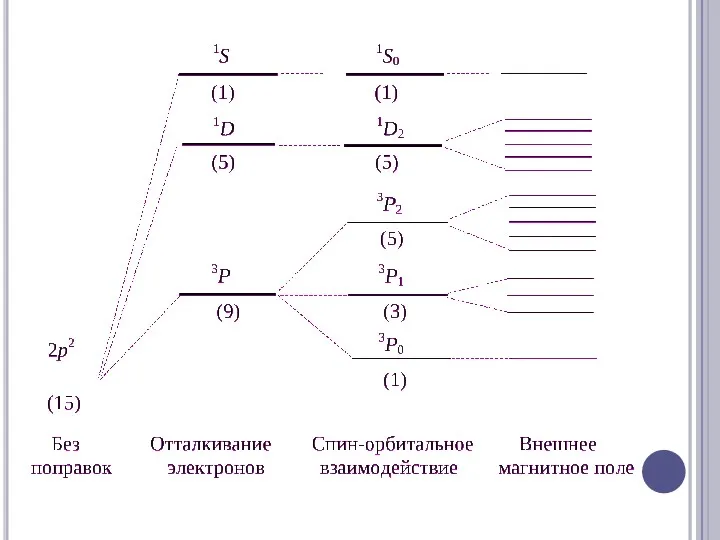
С (1s)2(2s)2(2p)2
1) L= 2S= 0 , что соответствует терму1D( 5 состояний )
2) L=
1S= 1, что соответствует терму3P( 9 состояний )
3) L= 0S= 0 , что соответствует терму1S( 1 состояние )
Слайд 18
Слайд 19


















 Зеркальные антенны
Зеркальные антенны Занимательные задачи по физике
Занимательные задачи по физике Броуновское движение. Диффузия. Взаимодействие молекул. Эксперименты
Броуновское движение. Диффузия. Взаимодействие молекул. Эксперименты Презентация к уроку на тему Кристаллические тела и их применение
Презентация к уроку на тему Кристаллические тела и их применение Введение в квантовую физику. (Лекция 13)
Введение в квантовую физику. (Лекция 13) Закон всемирного тяготения. Сила тяжести
Закон всемирного тяготения. Сила тяжести Diamond DA42 Twin Star — лёгкий многоцелевой самолёт
Diamond DA42 Twin Star — лёгкий многоцелевой самолёт Презентация по Физики 7 класс На тему Механическая работа и мощность.
Презентация по Физики 7 класс На тему Механическая работа и мощность. Масс-спектрометрия
Масс-спектрометрия Проектирование и производство изделий интегральной электроники. Нанесение тонких плёнок
Проектирование и производство изделий интегральной электроники. Нанесение тонких плёнок Инженерные конструкции
Инженерные конструкции Atmospheric electricity
Atmospheric electricity Электромагнитное излучение
Электромагнитное излучение Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости Температурный режим воздуха и почвы
Температурный режим воздуха и почвы Тема 3. Динамика материальной точки
Тема 3. Динамика материальной точки Спектроскопические методы анализа
Спектроскопические методы анализа Другий закон Ньютона
Другий закон Ньютона Барометр-анероид. Атмосферное давление на различных высотах
Барометр-анероид. Атмосферное давление на различных высотах Аэрогазодинамика. Сверхзвуковые течения со скачками уплотнения (лекции 12, 13)
Аэрогазодинамика. Сверхзвуковые течения со скачками уплотнения (лекции 12, 13) lecture_1-arphey9yxwi
lecture_1-arphey9yxwi Снегоходы
Снегоходы Физика ОГЭ -2020
Физика ОГЭ -2020 ГИА по физике. Экспериментальные задания
ГИА по физике. Экспериментальные задания Высота, тембр и громкость звука
Высота, тембр и громкость звука Состояния вещества и объяснение их на основе молекулярного строения
Состояния вещества и объяснение их на основе молекулярного строения Відносність руху
Відносність руху Брунауэр, Эммет және Теллер адсорбциясының полимолекулярлық теориясы. Адсорбцияның потенциалдық теориясы. Дәріс 12-13
Брунауэр, Эммет және Теллер адсорбциясының полимолекулярлық теориясы. Адсорбцияның потенциалдық теориясы. Дәріс 12-13