Содержание
- 2. Энергия и формы ее передачи. Закон сохранения энергии. Энергетические проблемы человечества. Энергия химических связей. Термохимические циклы.
- 3. Энергия Энергия – общая количественная мера движения и взаимодействия всех видов материи
- 4. Закон сохранения энергии Полная энергия изолированной системы постоянна. Энергия не создается из ничего и не исчезает
- 5. Единицы энергии В системе СИ единица энергии – джоуль (Дж). Много это или мало? а) 1
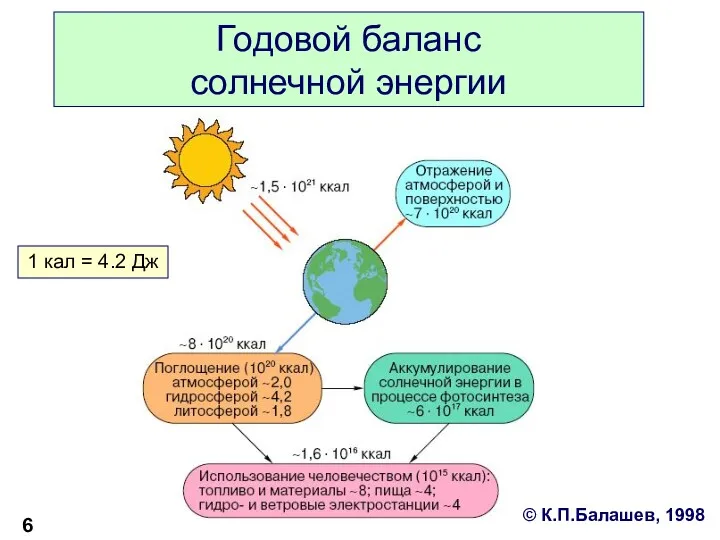
- 6. Годовой баланс солнечной энергии 1 кал = 4.2 Дж © К.П.Балашев, 1998
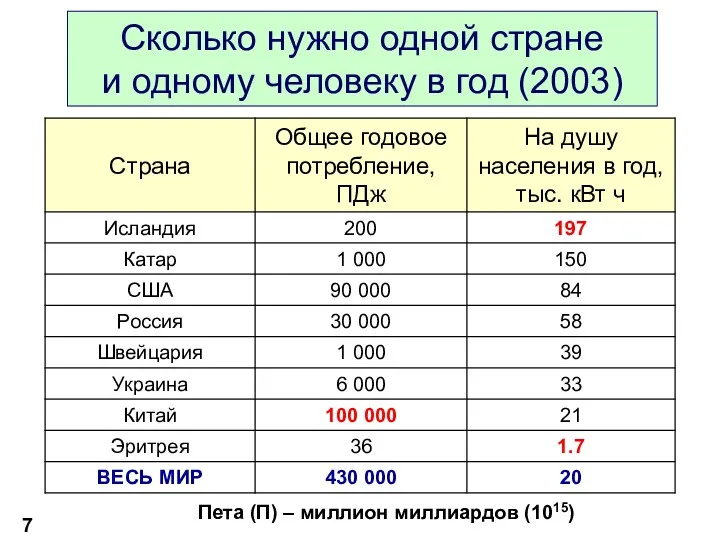
- 7. Сколько нужно одной стране и одному человеку в год (2003) Пета (П) – миллион миллиардов (1015)
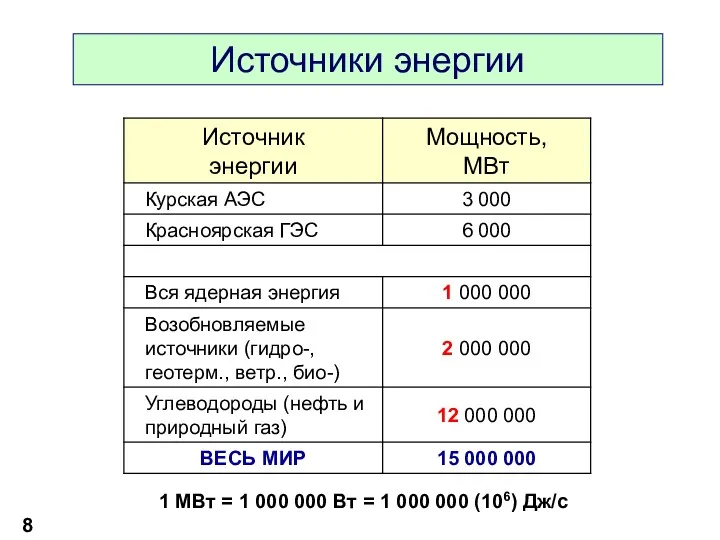
- 8. Источники энергии 1 МВт = 1 000 000 Вт = 1 000 000 (106) Дж/c
- 9. Формы передачи энергии Теплота Q (неупорядоченная форма) – изменяется только температура Работа W (упорядоченная форма) –
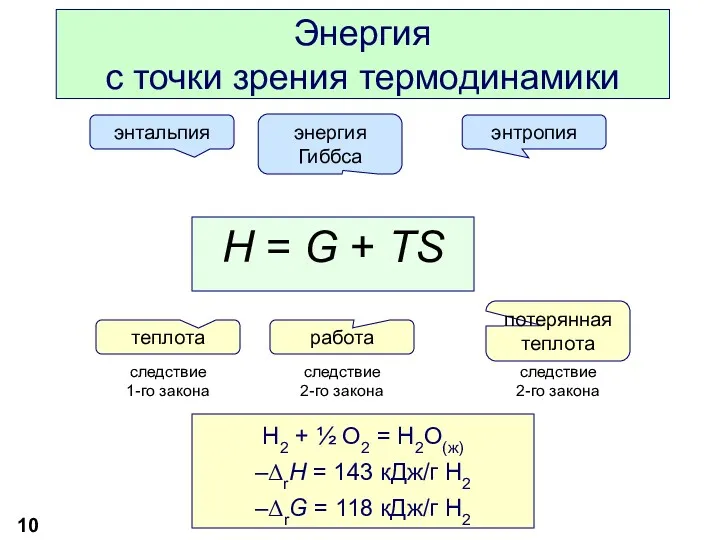
- 10. Энергия с точки зрения термодинамики H2 + ½ O2 = H2O(ж) –ΔrH = 143 кДж/г H2
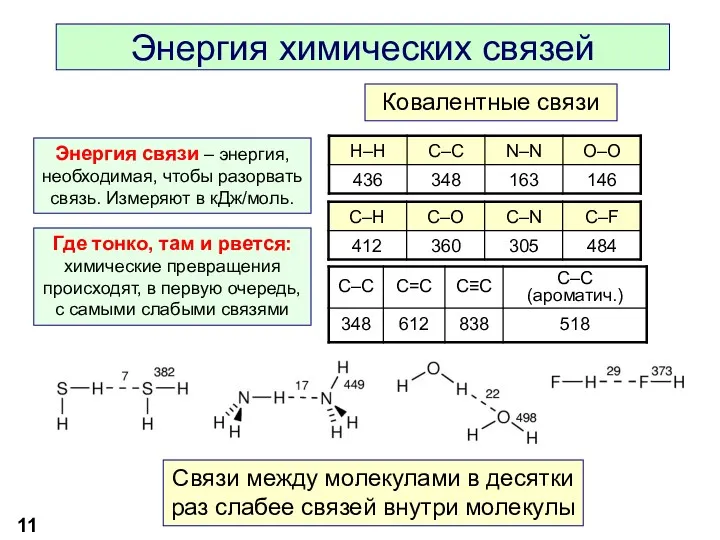
- 11. Энергия химических связей Энергия связи – энергия, необходимая, чтобы разорвать связь. Измеряют в кДж/моль. Где тонко,
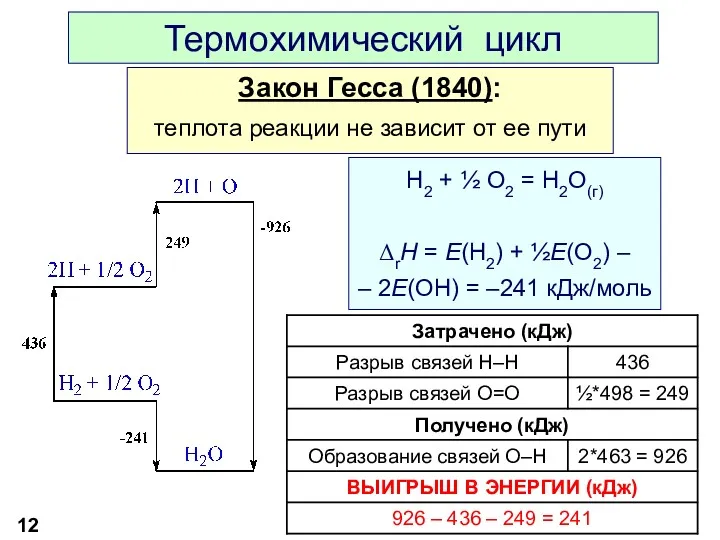
- 12. Термохимический цикл Закон Гесса (1840): теплота реакции не зависит от ее пути H2 + ½ O2
- 13. Хочу ездить на воздухе! Проект 1994 года полный бред!
- 14. Общие свойства российских лже-проектов Самые популярные темы – изменение структуры воды или активация того или иного
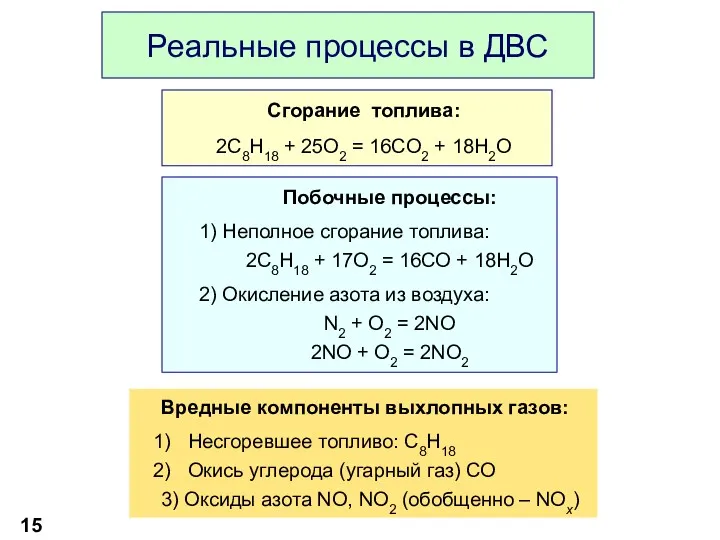
- 15. Реальные процессы в ДВС Сгорание топлива: 2C8H18 + 25O2 = 16CO2 + 18H2O Побочные процессы: 1)
- 16. Химические источники тока Гальванические элементы – источники тока одноразового действия; после расходования реагентов становятся неработоспособными. гальванические
- 17. Свинцовый аккумулятор Электролит – 30 %-ный водный раствор H2SO4. При разряде аккумулятора реакция протекает слева направо,
- 18. Топливные элементы (ТЭ) (FC – fuel cells) Окислитель – кислород или воздух, Восстановитель (топливо) – водород,
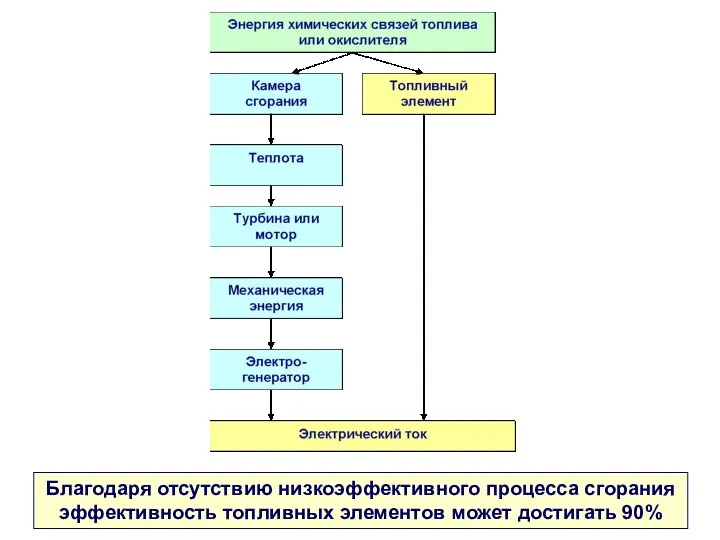
- 19. Благодаря отсутствию низкоэффективного процесса сгорания эффективность топливных элементов может достигать 90%
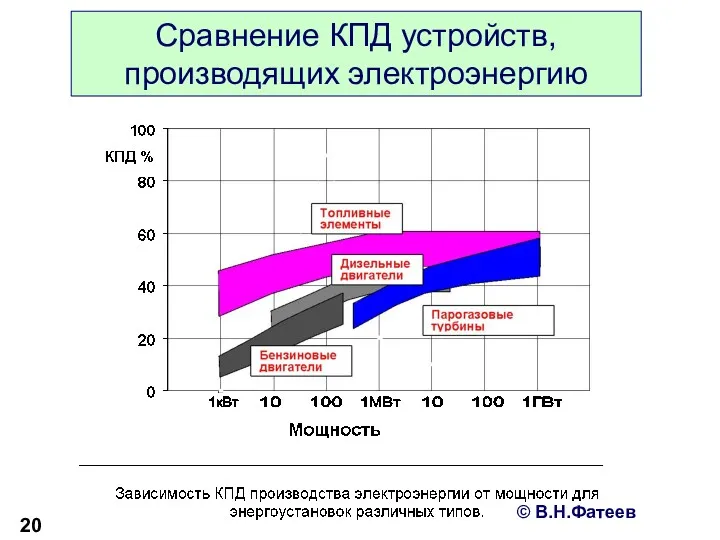
- 20. Сравнение КПД устройств, производящих электроэнергию © В.Н.Фатеев
- 21. Преимущества водородного топлива Количество водорода на Земле практически не ограничено (15 ат.% в земной коре, в
- 22. Недостатки водородного топлива Трудности хранения: большой объем резервуаров. Реагирует с металлами, делая их хрупкими. Взрывоопасен. Высокая
- 23. Основные задачи водородной энергетики производство водорода хранение, транспортировка и распределение водорода окисление водорода и производство энергии
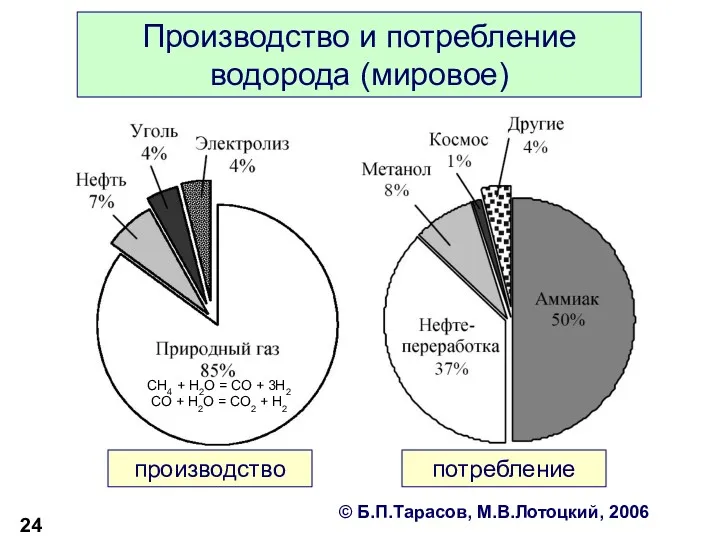
- 24. Производство и потребление водорода (мировое) производство потребление © Б.П.Тарасов, М.В.Лотоцкий, 2006 CH4 + H2O = CO
- 25. Способы хранения водорода Физические – в сжатом или сжиженном состоянии Физико-химические, в первую очередь – адсорбция.
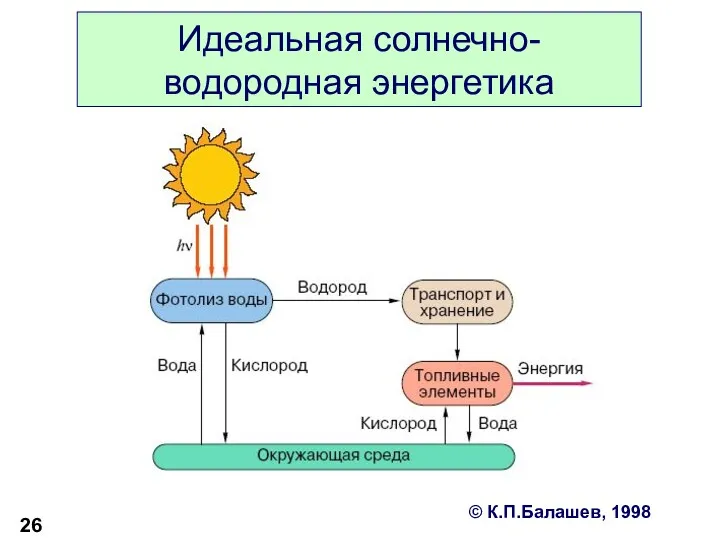
- 26. Идеальная солнечно-водородная энергетика © К.П.Балашев, 1998
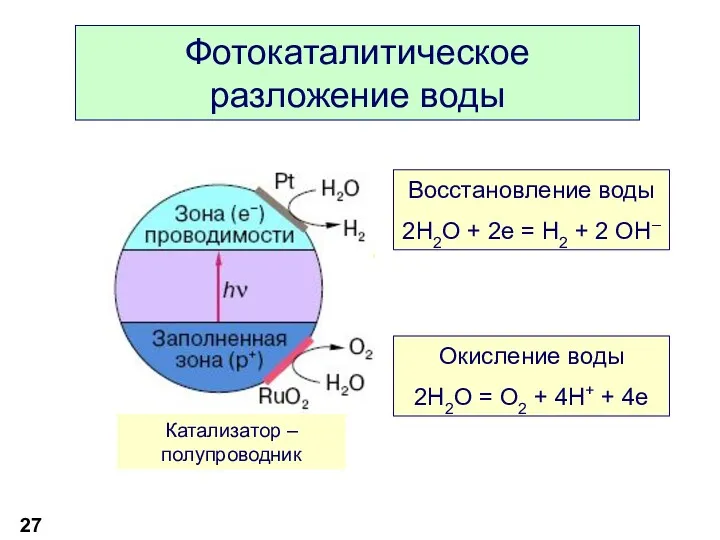
- 27. Фотокаталитическое разложение воды Восстановление воды 2H2O + 2e = H2 + 2 OH– Окисление воды 2H2O
- 28. Типы водородных ТЭ Кислотные Твердополимерный, с протонпроводящей мембраной (80 оС) Фосфорнокислый (200 оС) Щелочные (80 оС)
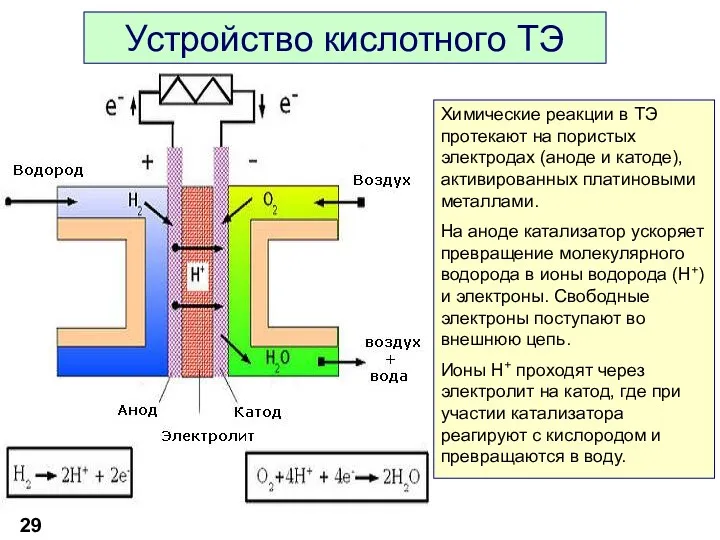
- 29. Устройство кислотного ТЭ Химические реакции в ТЭ протекают на пористых электродах (аноде и катоде), активированных платиновыми
- 30. Полуреакции окисления и восстановления в водородных ТЭ Кислотный ТЭ Анод (окисление): H2 – 2e → 2H+
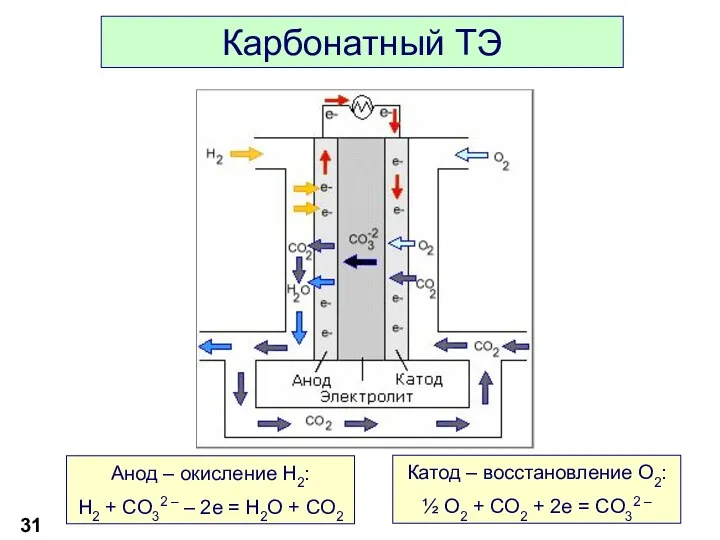
- 31. Карбонатный ТЭ Анод – окисление H2: H2 + CO32 – – 2e = H2O + CO2
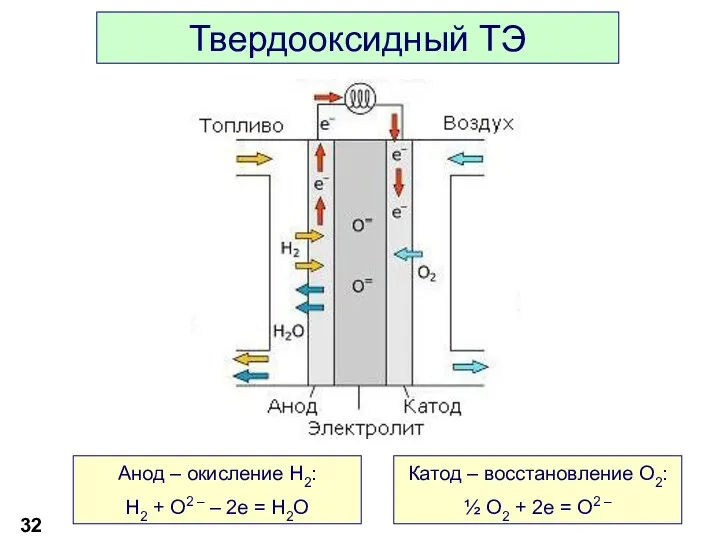
- 32. Твердооксидный ТЭ Анод – окисление H2: H2 + O2 – – 2e = H2O Катод –
- 33. Типы водородных ТЭ (более подробно)
- 34. Проект создания управляемого термоядерного реактора (бредовый) Вот одно из открытий, полученных благодаря знаниям о наномире. Основная
- 36. Скачать презентацию


















 Урок физики в 11 классе Определение ускорения свободного падения лабораторная работа
Урок физики в 11 классе Определение ускорения свободного падения лабораторная работа Основные понятия теории механизмов и машин
Основные понятия теории механизмов и машин Движение электрона в атоме
Движение электрона в атоме Механическая работа, мощность. 7 класс
Механическая работа, мощность. 7 класс Refrigeration And Air Conditioning
Refrigeration And Air Conditioning Техническая механика
Техническая механика Гравитационные волны
Гравитационные волны Домашнее задание. Провести численный расчет установившегося течения в канале
Домашнее задание. Провести численный расчет установившегося течения в канале 1. Электростатика
1. Электростатика Механические колебания. (11 класс)
Механические колебания. (11 класс) Организация и управление производством технического обслуживания и ремонта автомобилей
Организация и управление производством технического обслуживания и ремонта автомобилей Излучение. Тепловое излучение
Излучение. Тепловое излучение Струм у вакуумі та його застосування
Струм у вакуумі та його застосування Виды реактивных двигателей
Виды реактивных двигателей М.В. Ломоносов в области физики и астрономии
М.В. Ломоносов в области физики и астрономии Методическая разработка урока физики в 7 классе по теме Сила
Методическая разработка урока физики в 7 классе по теме Сила Плоские фермы. Определения. Модель плоской фермы
Плоские фермы. Определения. Модель плоской фермы Плавание судов
Плавание судов Тема №5. Энергетические системы самолета. Занятие №2. Гидравлическая система самолета МИГ-29. Общая гидросистема
Тема №5. Энергетические системы самолета. Занятие №2. Гидравлическая система самолета МИГ-29. Общая гидросистема Введение в радиосвязь
Введение в радиосвязь Квантовые свойства света. Фотоэффект. Лазеры. Лекция 22
Квантовые свойства света. Фотоэффект. Лазеры. Лекция 22 Электрооборудование источников энергии, электрических сетей и промышленных предприятий
Электрооборудование источников энергии, электрических сетей и промышленных предприятий Презентация по физике 8 класс Зависимость силы тока от напряжения. Электрическое сопротивление
Презентация по физике 8 класс Зависимость силы тока от напряжения. Электрическое сопротивление Урок физики в 7 классе Вес воздуха. Атмосферное давление
Урок физики в 7 классе Вес воздуха. Атмосферное давление Швидкість руху тіла
Швидкість руху тіла Ремонт редуктора электропоезда
Ремонт редуктора электропоезда Графіки залежності кінематичних величин від часу для рівномірного прямолінійного руху
Графіки залежності кінематичних величин від часу для рівномірного прямолінійного руху Динамика идеальной жидкости
Динамика идеальной жидкости