Содержание
- 2. Химическая кинетика - то раздел химии, изучающий скорость и механизм химических реакций.
- 3. Кинетический метод исследования, наряду с термодинамическим и квантово-механическим, широко применяется в современном естествознании.
- 4. 9.1 Понятие о скорости и механизме химических реакций. 9.2 Влияние концентрации реагирующих веществ на скорость химических
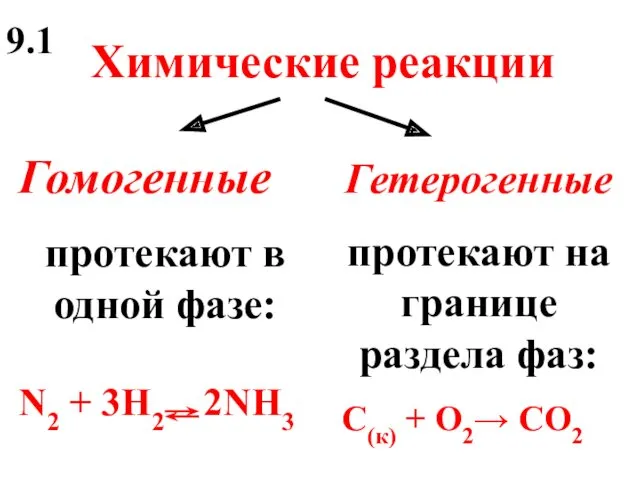
- 5. Химические реакции Гомогенные протекают в одной фазе: N2 + 3H2 2NH3 Гетерогенные протекают на границе раздела
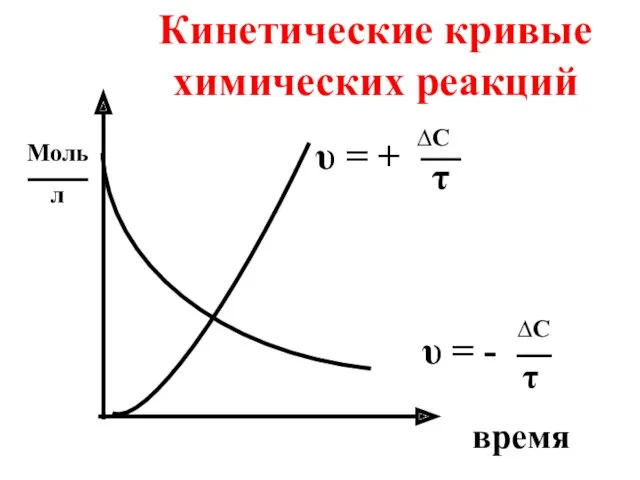
- 6. Средняя скорость гомогенной реакции (υ) равна изменению концентрации вещества в единицу времени: υ = [A] -
- 7. [A]0_ и [A] – исходная и конечная концентрация вещества, моль/л τ - время реакции, с., мин.,
- 8. Кинетические кривые химических реакций время Моль л τ υ = + ∆С υ = - τ
- 9. Скорость гетерогенной реакции равна изменению количества вещества в единицу времени на единице площади поверхности раздела фаз:
- 10. где ν0 и ν – количество вещества в начальный и конечный момент времени, моль S –
- 11. Большинство биохимических реакций являются гомо- генными. Они протекают с различной скоростью. Например, химические реакции, лежащие в
- 12. Полное обновление костной ткани осуществляется за 4-7 лет. Время обновления белков на половину составляет около 70
- 13. На скорость химических реакций влияет: а) природа реагирующих веществ, б) их агрегатное состояние,
- 14. в) природа растворителя (если реакция протекает в растворе), г) площадь поверхности реагирующих веществ (для гетерогенных реакций),
- 15. д) концентрация реагирующих веществ, е) давление (для газофазных реакций), ж) температура, з) катализатор.
- 16. Чтобы произошла химическая реакция, необходимо взаимодействие между молекулами реагирующих веществ. Это взаимодействие происходит в форме столкновения
- 18. Во всем многообразии столкновений выделяют элементарные стадии процесса.
- 20. Элементарная стадия – это столкновение молекул реагирующих веществ, приводящее к образованию молекул продуктов.
- 21. Механизм химической реакции – это число и последовательность элементарных стадий процесса.
- 22. Характеристикой механизма является молекулярность элементарных стадий. Молекулярность – это число частиц, участвующих в элементарном превращении.
- 23. Различают: а) мономолекулярные превра-щения: I2 → 2I б) бимолекулярные превраще-ния: Н2 + I2 → 2HI в)
- 24. Молекулярность не может быть больше трех, т.к. вероятность столкновения четырех и более частиц ничтожно мала.
- 25. Химическая реакция является простой, если представляет собой многократное чередование одной элементарной стадии: H2 + I2 →
- 26. Если химическая реакция протекает в несколько стадий, то она является сложной. К наиболее сложным относятся радикальные
- 27. Радикал – это атом или группа атомов, имеющие неспаренный электрон. Радикалы образуются в результате термолиза, фотолиза,
- 28. H2 + Br2 → 2HBr Механизм: стадия инициирования (мономолекулярная) Br : Br → 2Br ·
- 29. 2) рост цепи (бимолекулярная стадия): Br + H : H → HBr + H H +
- 30. 3) обрыв цепи (бимолекулярные стадии) 2Br → Br2 2H → H2 H + Br → HBr
- 31. Радикальные реакции протекают in vivo под действием радикалов ОН●, НОО●, ROO●, О2 ● и др.
- 32. Ученые считают, что накопление радикалов во внутриклеточных жидкостях – одна из причин старения.
- 33. Реакция пероксидного окисления липидов, скорость которой резко возрастает даже под воздействием малых доз радиации, приводит к
- 34. Для снижения скорости пероксидного окисления используется антиоксиданты: витамины А, Е, С, соединения селена.
- 35. 9.2 Уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций, называются кинетическими уравнениями.
- 36. Кинетические уравнения составляют на основе закона действующих масс (Гульдберг и Вааге,1867): скорость химических реакций прямо пропорциональна
- 37. Математическое выражение ЗДМ для реакции: аА + bВ + cС → Р υ = k [A]x
- 38. k зависит от температуры и природы веществ и не зависти от их концентрации; [A], [B], [C]
- 39. Порядок реакции определяется только экспериментально. Он является величиной формальной и может принимать любые значения: положительные, отрицательные,
- 40. Для радикальной реакции H2 + Br2 → 2HBr кинетическое уравнение υ = k[H2][Br2]1/2
- 41. Только для простых реакций порядок и молекулярность совпадают: H2 + I2 → 2HI υ = k
- 42. Кинетическое описание простых реакций. Реакции нулевого порядка (n=0) Примеры: фотохимические, каталитические и ферментативные реакции (при высокой
- 43. Условное уравнение: Константа скорости [A]0 - [A] k = τ А → Р Кинетическое уравнение: υ
- 44. [A] Кинетическая кривая реакций нулевого порядка υ
- 45. Время полуреакции (τ ½) –это время, необходимое для уменьшения концентрации исходного вещества в два раза. [A]0
- 46. Реакции первого порядка (n=1) Примеры: каталитические и ферментативные реакции (при низкой концентрации субстрата), радиоактивный распад, выведение
- 47. Условное уравнение: Константа скорости k = 1 τ [A]0 [A] ℓn А → Р Кинетическое уравнение:
- 48. Кинетическая кривая реакции первого порядка [A] υ
- 49. Время полуреакции: τ ½ = ℓn 2 k
- 50. Период полураспада некоторых радионуклидов I131 = 8 дней Sr90 = 27 лет Cs137 = 26,6 года
- 51. Реакции второго порядка (n=2) Примеры: гидролиз белков, жиров, углеводов и других биологически активных соединений.
- 52. Условные уравнения: 2 А → Р А + В → Р Кинетические уравнения: υ = k
- 53. Константа скорости: k = 1 τ [A]0 - [A] × [A] [A]0 τ ½= τ ½=
- 54. Кинетика сложных реакций 1) обратимые реакции A B k1 k2 Кинетическое уравнение: υ = k1[A] –
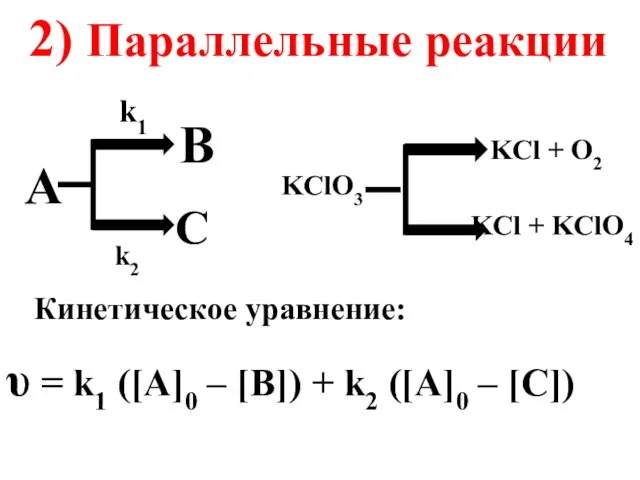
- 55. A B C k1 k2 KClO3 2) Параллельные реакции KCl + O2 KCl + KClO4 Кинетическое
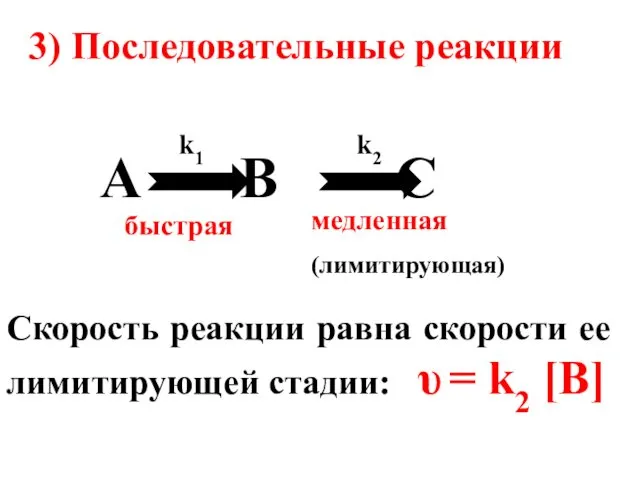
- 56. Скорость реакции равна скорости ее лимитирующей стадии: υ = k2 [B] 3) Последовательные реакции A B
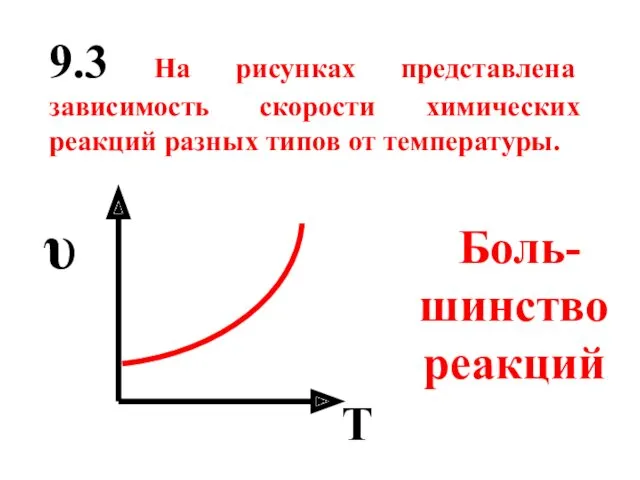
- 57. 9.3 На рисунках представлена зависимость скорости химических реакций разных типов от температуры. Боль-шинство реакций T υ
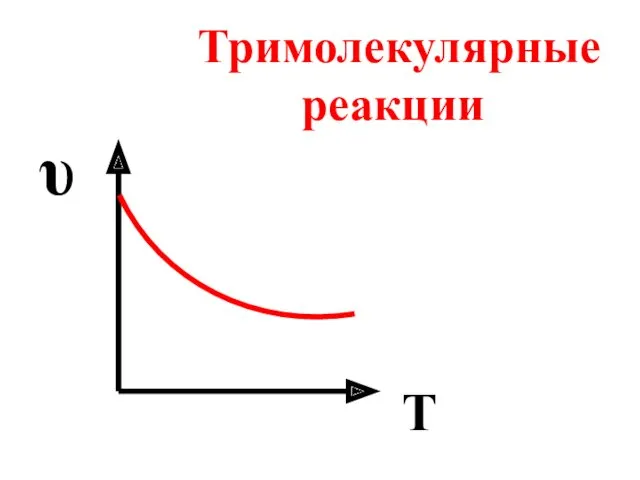
- 58. υ T Тримолекулярные реакции
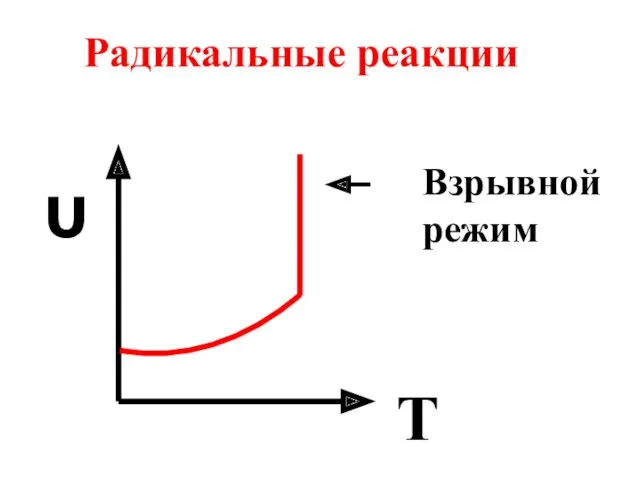
- 59. υ T Взрывной режим Радикальные реакции
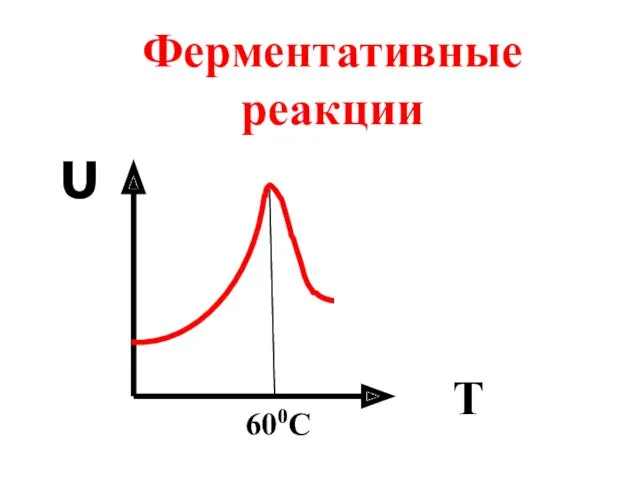
- 60. Ферментативные реакции υ T 600C
- 61. Для большинства химических реакций выполняется правило Вант-Гоффа: при повышении температуры на каждые 100 скорость реакции возрастает
- 62. υT 2 = υT 1 γ T2 – T1 10 где Т1 и Т2 - начальная
- 63. Для биохимических реакций 1,5 поэтому при повышении температуры больного до 39,50С скорость биохимических реакций возрастает в
- 64. Значительно точнее зависимость скорости и температуры описывается уравнением Аррениуса: -Еак/RT υ = υ 0e k =
- 65. где υ0 и k0 - коэффициенты пропорциональности, называемые предэкспоненциальными множителями, Еак - энергия активации, кДж/моль.
- 66. С точки зрения теории активного комплекса, энергия активации - это энергия образования активного комплекса из реагирующих
- 67. Энергия активации иначе называется энергетическим барьером химической реакции.
- 68. Активный комплекс - промежуточная частица, в которой старые связи еще не полностью разорвались, а новые -
- 69. Схема химической реакции : А + В А...В Р А...В - активный комплекс
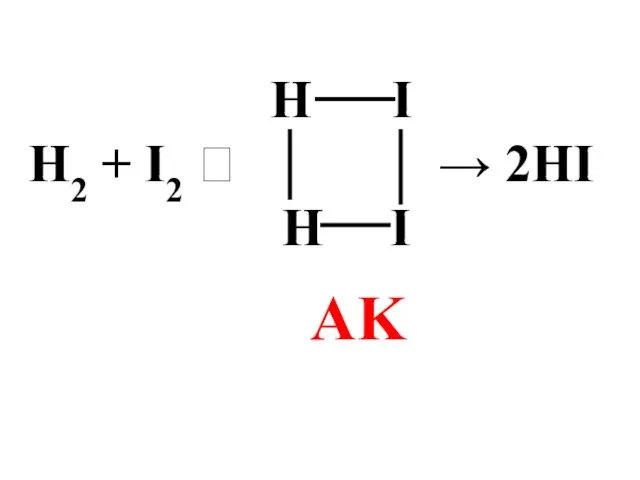
- 70. Н I Н2 + I2 ⮀ → 2HI Н I AK
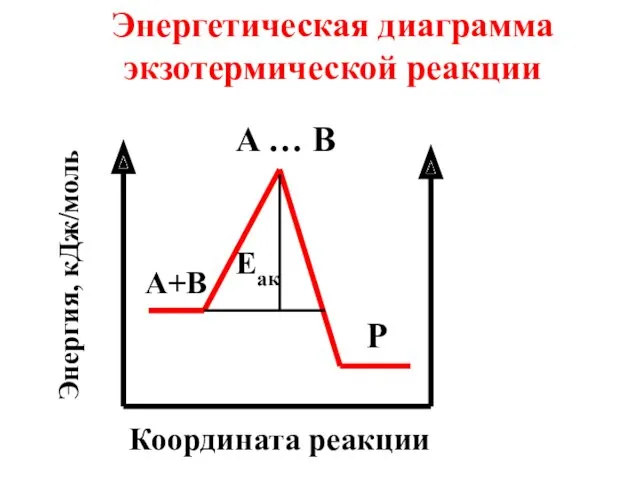
- 71. Энергетическая диаграмма экзотермической реакции A … B P A+B Eaк Координата реакции Энергия, кДж/моль
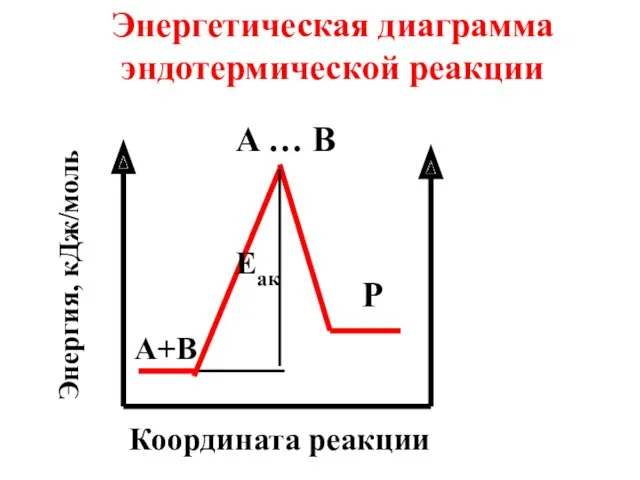
- 72. Энергетическая диаграмма эндотермической реакции A … B P A+B Eaк Координата реакции Энергия, кДж/моль
- 73. Энергия активации (Еак) зависит от природы реагирующих веществ и не зависит от температуры.
- 74. С повышением температуры в реакционной смеси возрастает доля активных молекул, способных преодолеть энергетический барьер химической реакции,
- 75. Кроме термических, существуют нетермические способы активации молекул: фотохимические, электрические и радиационные.
- 77. Скачать презентацию




![[A]0_ и [A] – исходная и конечная концентрация вещества, моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-6.jpg)





























![Для радикальной реакции H2 + Br2 → 2HBr кинетическое уравнение υ = k[H2][Br2]1/2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-39.jpg)


![Условное уравнение: Константа скорости [A]0 - [A] k = τ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-42.jpg)
![[A] Кинетическая кривая реакций нулевого порядка υ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-43.jpg)


![Условное уравнение: Константа скорости k = 1 τ [A]0 [A]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-46.jpg)
![Кинетическая кривая реакции первого порядка [A] υ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-47.jpg)




![Константа скорости: k = 1 τ [A]0 - [A] ×](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/106559/slide-52.jpg)













 Ап-конверсионная люминесценция в наностеклокерамике
Ап-конверсионная люминесценция в наностеклокерамике Классическая механика. Тема 1
Классическая механика. Тема 1 Fast and Simple Physics using Sequential Impulses
Fast and Simple Physics using Sequential Impulses Внутренняя энергия. Работа. 1 начало термодинамики
Внутренняя энергия. Работа. 1 начало термодинамики Accumulation of electricity. Leadacid batteries
Accumulation of electricity. Leadacid batteries Сила тока. Амперметр
Сила тока. Амперметр Симметричный вибратор. Антенно-фидерные устройства и распространение радиоволн
Симметричный вибратор. Антенно-фидерные устройства и распространение радиоволн Детектирование нейтронов
Детектирование нейтронов Понятие о плазме
Понятие о плазме Реактивний рух в природі
Реактивний рух в природі Возбуждение и распространение детонации конденсированных взрывчатых веществ
Возбуждение и распространение детонации конденсированных взрывчатых веществ Көтеріп-түсіру кешенін пайдалану барысында ілме блоктың құрылымын жетілдіру
Көтеріп-түсіру кешенін пайдалану барысында ілме блоктың құрылымын жетілдіру Презентация к уроку: Подвижная карта звездного неба, 9 класс
Презентация к уроку: Подвижная карта звездного неба, 9 класс Естественное и искусственное освещение
Естественное и искусственное освещение Основные элементы подвески
Основные элементы подвески лабораторная работа №1 10 класс
лабораторная работа №1 10 класс Знаем ли мы физику? (конкурс знатоков)
Знаем ли мы физику? (конкурс знатоков) Твердотільний стрижневий лазер з ламповим накачуванням
Твердотільний стрижневий лазер з ламповим накачуванням Квазикристаллы, аморфное состояние, жидкие кристаллы, жидкость
Квазикристаллы, аморфное состояние, жидкие кристаллы, жидкость Плоские статически определимые фермы
Плоские статически определимые фермы История создания барометра
История создания барометра Виды соединения проводников
Виды соединения проводников Резание тонколистового металла и проволоки. 5 класс
Резание тонколистового металла и проволоки. 5 класс Ультразвук и его применение. Скорость звука в различных средах
Ультразвук и его применение. Скорость звука в различных средах Ходовая часть
Ходовая часть Лекція 5. Плівки Ленгмюра – Блоджетт. Нанокластери
Лекція 5. Плівки Ленгмюра – Блоджетт. Нанокластери Вимірювальні механізми аналогових електровимірювальних приладів
Вимірювальні механізми аналогових електровимірювальних приладів Моторы и пропеллеры
Моторы и пропеллеры