Содержание
- 2. Амперометрическое титрование Амперометрическое титрование – титриметрический метод с амперометрической индикацией конечной точки титрования, т. е. по
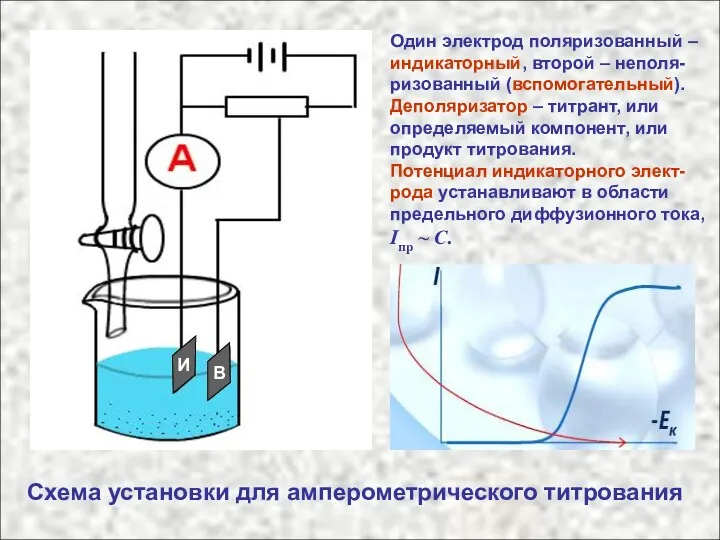
- 3. Схема установки для амперометрического титрования Один электрод поляризованный – индикаторный, второй – неполя-ризованный (вспомогательный). Деполяризатор –
- 4. Типичная установка амперометрического титрования
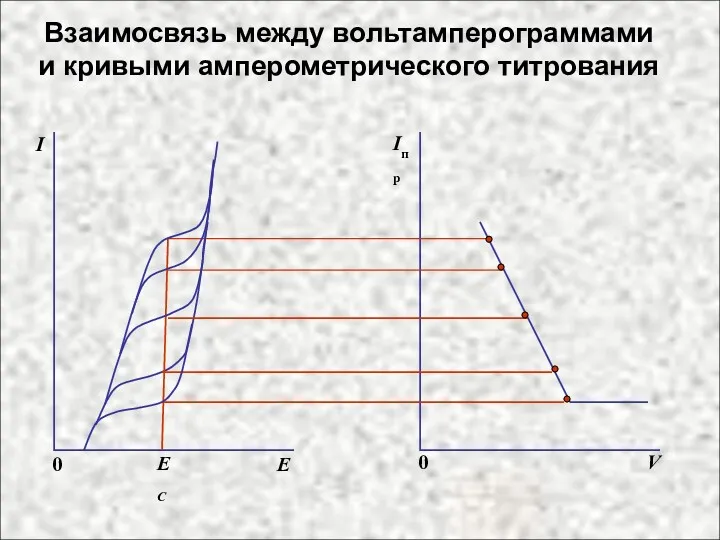
- 5. Взаимосвязь между вольтамперограммами и кривыми амперометрического титрования Iпр V I E EC 0 0
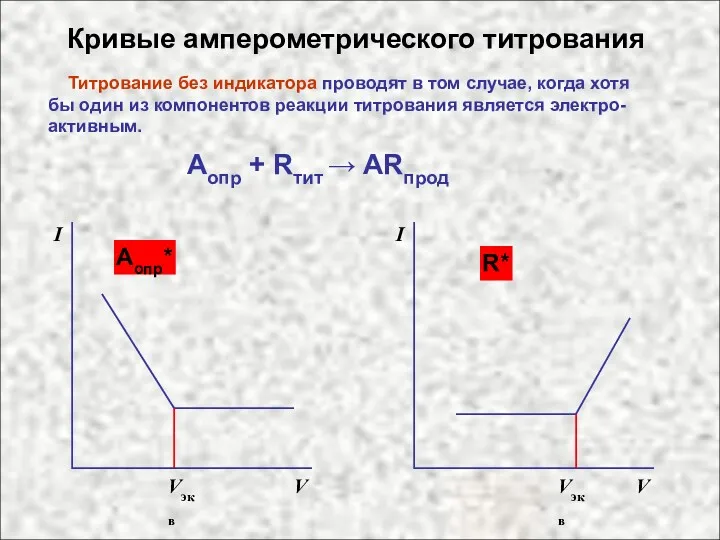
- 6. Кривые амперометрического титрования Титрование без индикатора проводят в том случае, когда хотя бы один из компонентов
- 7. Кривые амперометрического титрования Аопр + Rтит → ARпрод АR* I V Vэкв I V A*, R*
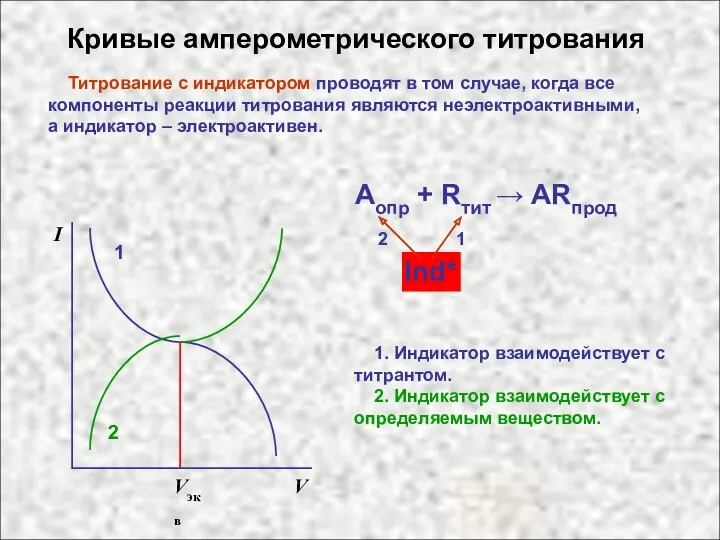
- 8. Кривые амперометрического титрования Титрование с индикатором проводят в том случае, когда все компоненты реакции титрования являются
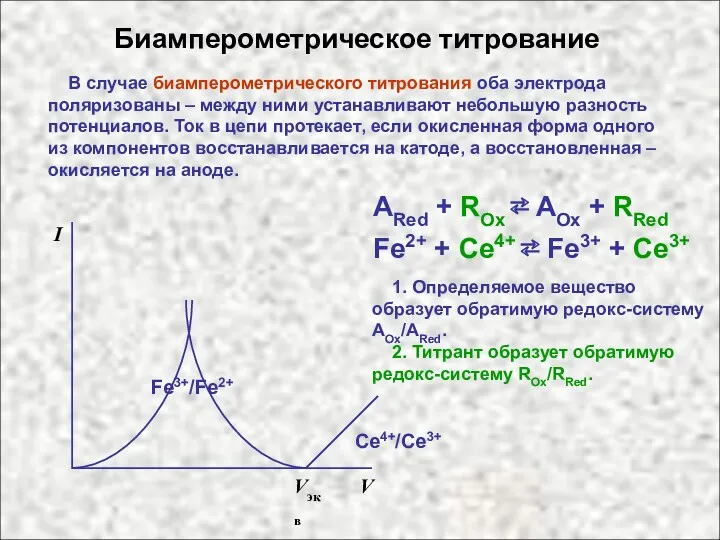
- 9. Биамперометрическое титрование В случае биамперометрического титрования оба электрода поляризованы – между ними устанавливают небольшую разность потенциалов.
- 10. Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е
- 11. Инструментальные методы анализа: кулонометрия Майстренко В.Н. Башкирский государственный университет Кафедра аналитической химии V_maystrenko@mail.ru Тел: 229-97-12
- 12. Кулонометрия
- 13. КУЛОНОМEТРИЯ - метод анализа, основанный на измерении коли-чества электричества (Q), которое расходуется в ходе электрохими-ческой реакции
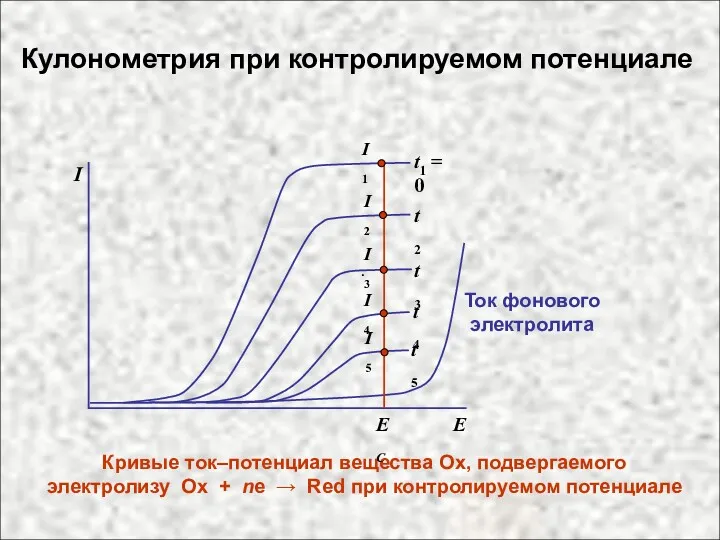
- 14. . Кривые ток–потенциал вещества Ох, подвергаемого электролизу Ox + ne → Red при контролируемом потенциале Ток
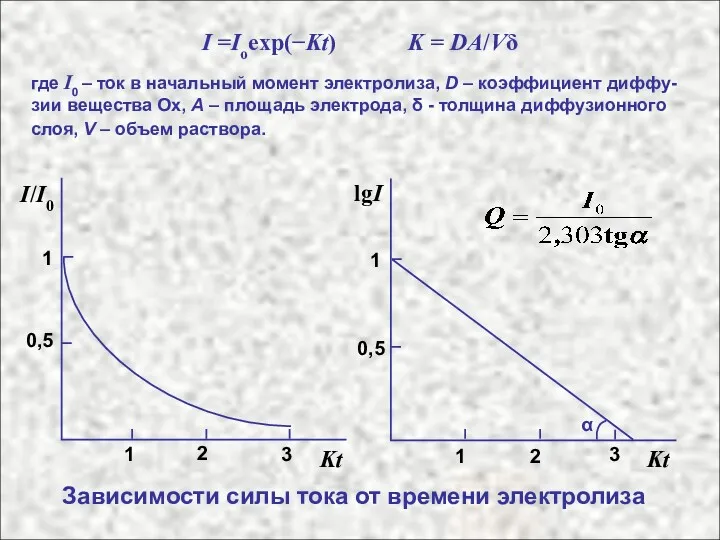
- 15. I =Ioexp(−Kt) K = DA/Vδ где I0 – ток в начальный момент электролиза, D – коэффициент
- 16. Для всех методов кулонометрии обязательным является усло-вие, при котором превращение вещества на электроде должно протекать со
- 17. Преимущества и недостатки потенциостатической кулонометрии Преимущества метод беэталонный (не нужны стандартные растворы); предел обнаружения до 10-9
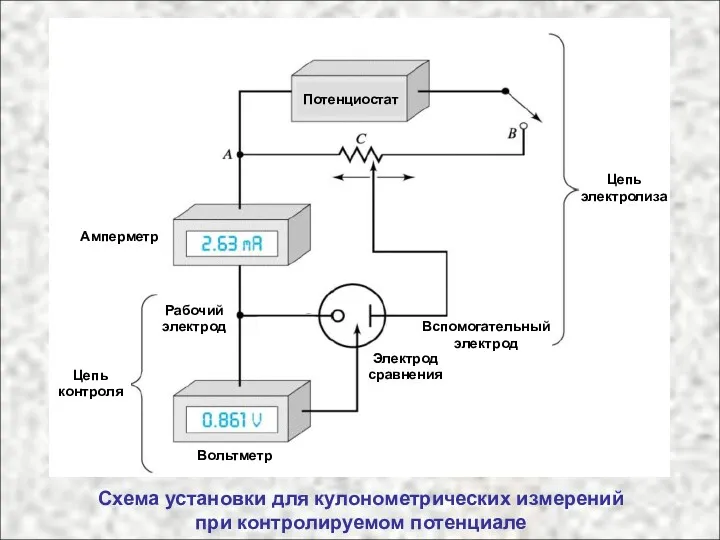
- 18. Схема установки для кулонометрических измерений при контролируемом потенциале Амперметр Вольтметр Электрод сравнения Вспомогательный электрод Рабочий электрод
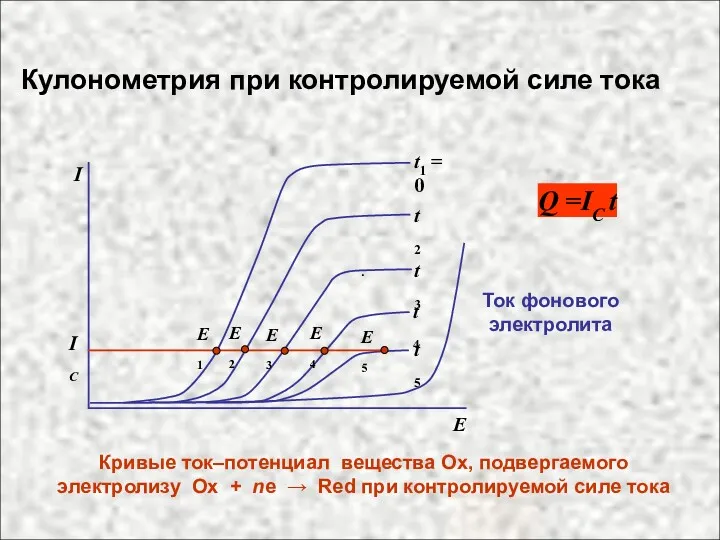
- 19. . Кривые ток–потенциал вещества Ох, подвергаемого электролизу Ox + ne → Red при контролируемой силе тока
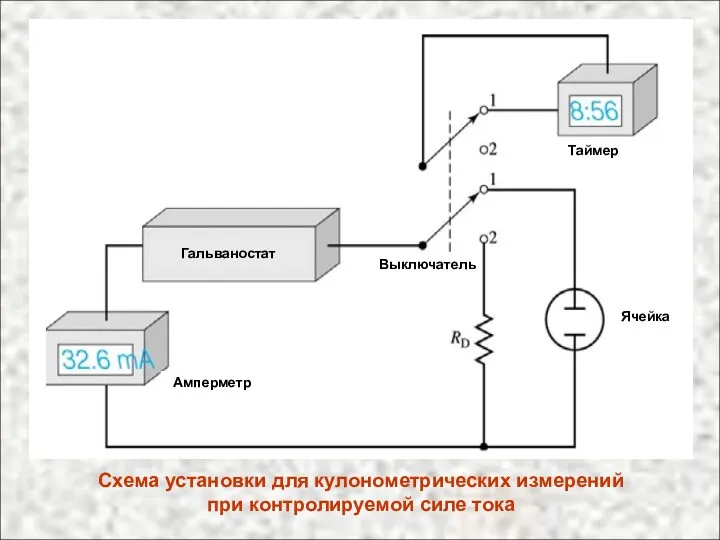
- 20. Схема установки для кулонометрических измерений при контролируемой силе тока Гальваностат Амперметр Таймер Ячейка Выключатель
- 21. Кулонометрическое титрование В методе кулонометрического титрования определяемое вещество не принимает участие в электрохимической реакции, протекающей непосредственно
- 22. Требования к условиям проведения кулонометрического титрования для обеспечения 100 % выхода по току вводят большой избыток
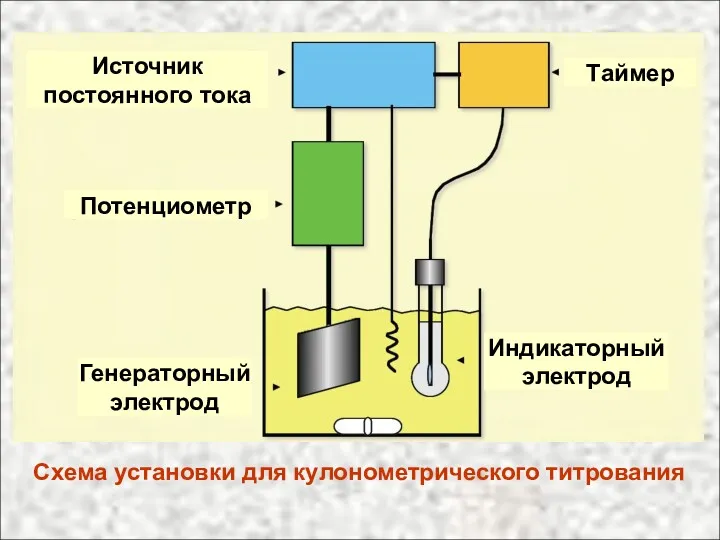
- 23. Схема установки для кулонометрического титрования Источник постоянного тока Потенциометр Генераторный электрод Индикаторный электрод Таймер
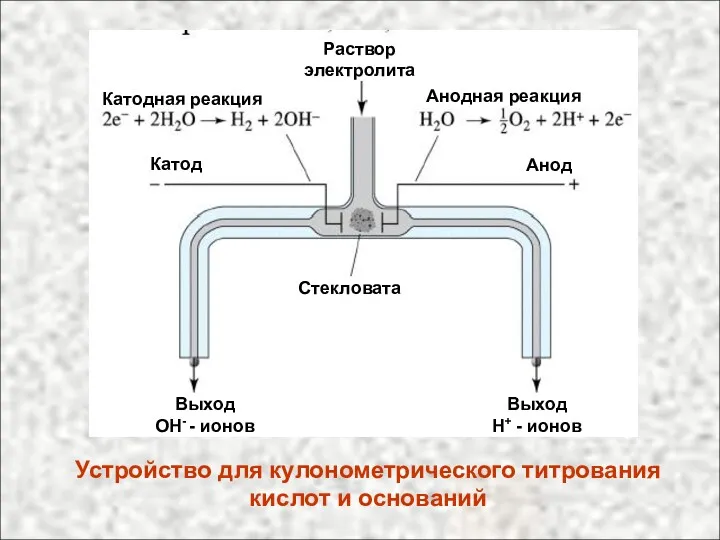
- 24. Устройство для кулонометрического титрования кислот и оснований Раствор электролита Катодная реакция Анодная реакция Катод Анод Стекловата
- 25. Кулонометрический титратор фирмы Metrohm для определения следовых количеств влаги по Карлу Фишеру в диапазоне 100 –
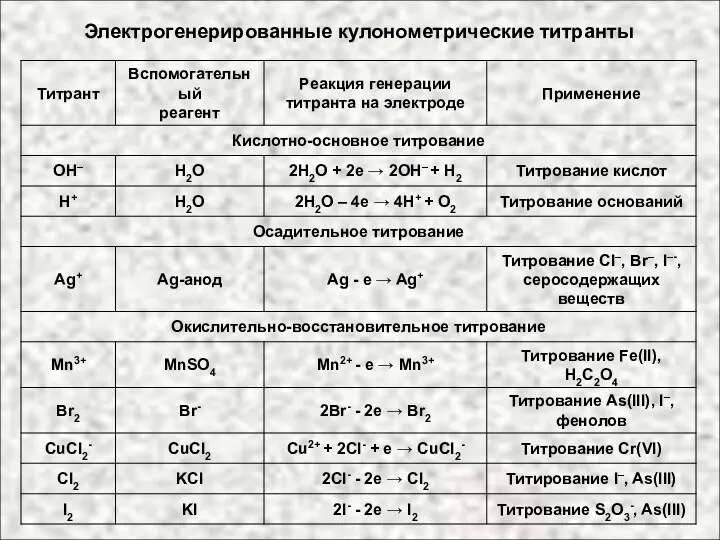
- 26. Электрогенерированные кулонометрические титранты
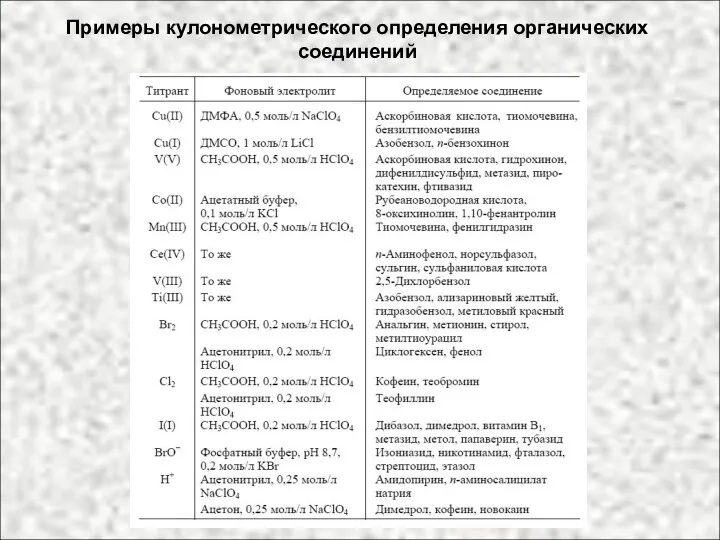
- 27. Примеры кулонометрического определения органических соединений
- 28. Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е
- 29. Инструментальные методы анализа: электрогравиметрия Майстренко В.Н. Башкирский государственный университет Кафедра аналитической химии V_maystrenko@mail.ru Тел: 229-97-12
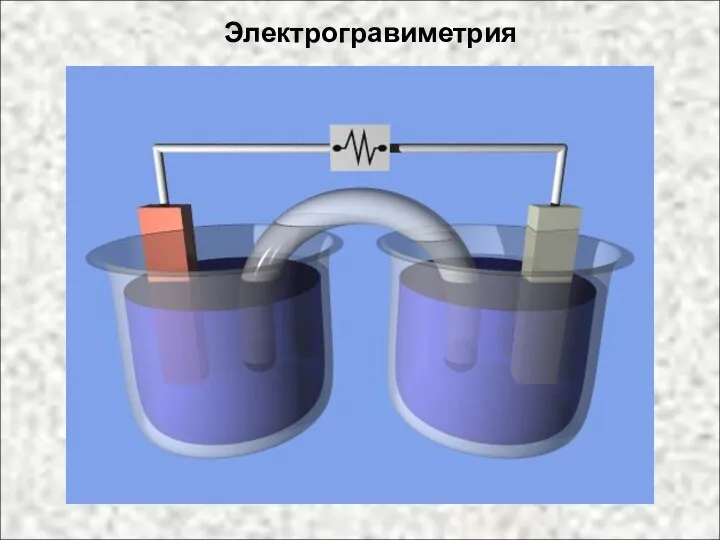
- 30. Электрогравиметрия
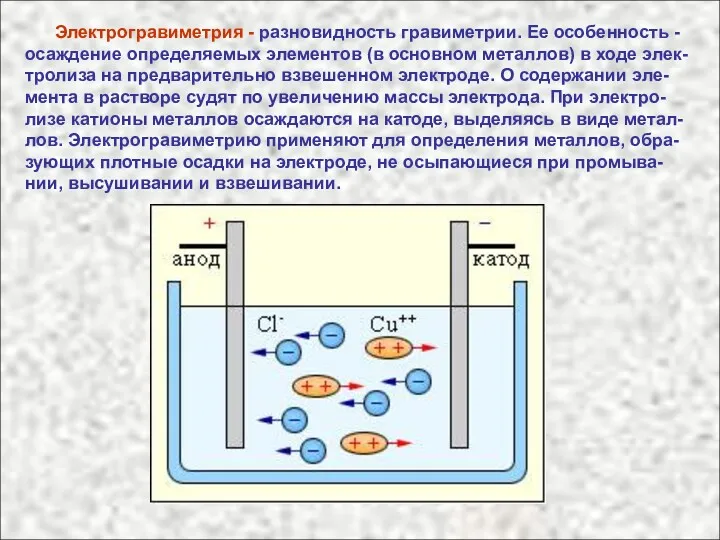
- 31. Электрогравиметрия - разновидность гравиметрии. Ее особенность - осаждение определяемых элементов (в основном металлов) в ходе элек-
- 32. На аноде осаждаются немногие металлы. К ним относятся Mn и Pb, окисляющиеся в процессе электролиза до
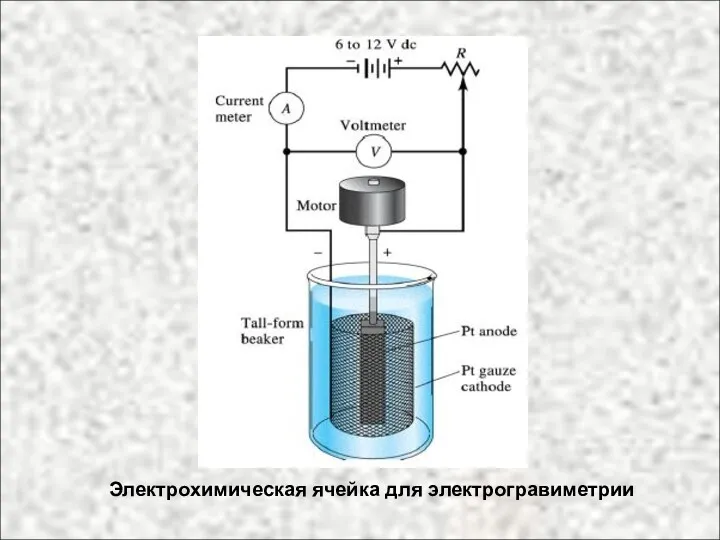
- 33. Электрохимическая ячейка для электрогравиметрии
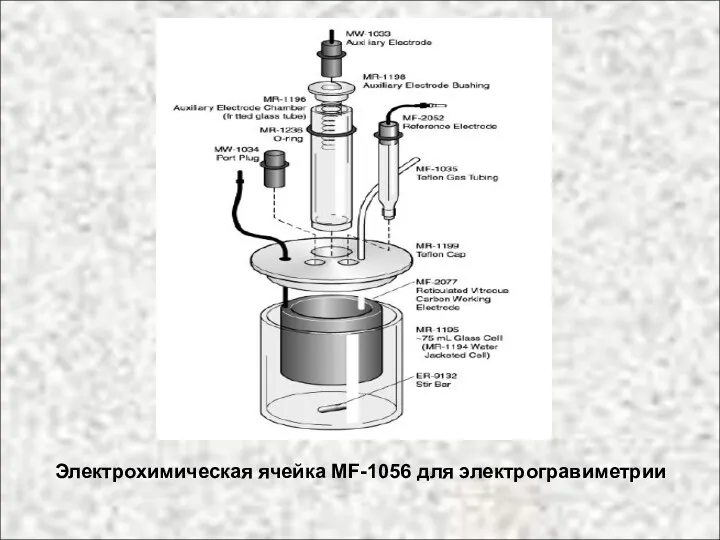
- 34. Электрохимическая ячейка MF-1056 для электрогравиметрии
- 35. Установка для электрогравиметрического определения металлов (меди, свинца, кобальта и др.) в сплавах и чистых металлах «ЭЛАМ
- 36. Особенности электрогравиметрии Свойства образующихся осадков существенно зависят от температуры и скорости перемешивания раствора. Повышение температуры приводит
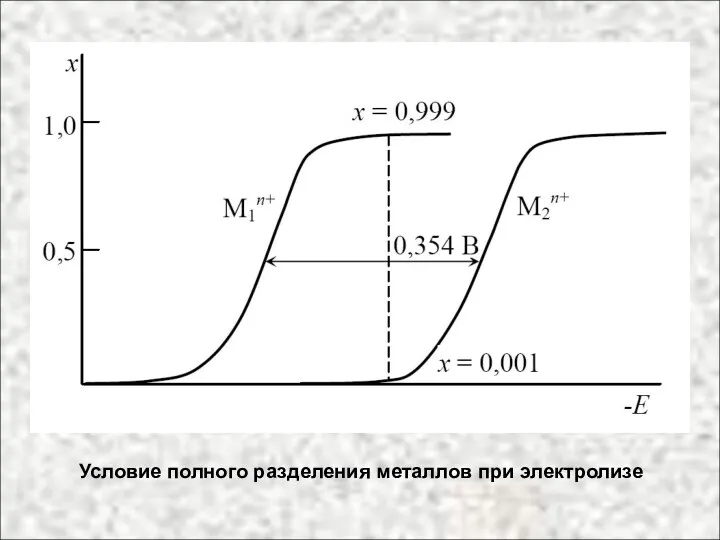
- 37. Условие полного разделения металлов при электролизе
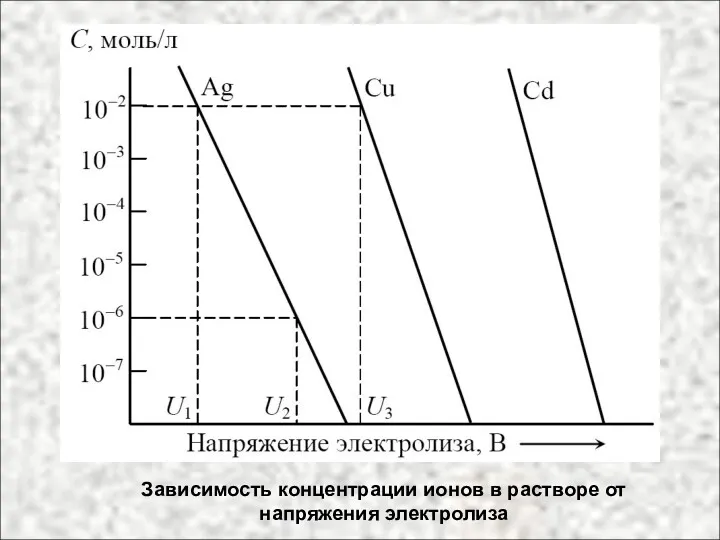
- 38. Зависимость концентрации ионов в растворе от напряжения электролиза
- 39. Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е
- 40. Инструментальные методы анализа: кондуктометрия Майстренко В.Н. Башкирский государственный университет Кафедра аналитической химии V_maystrenko@mail.ru Тел: 229-97-12
- 41. Кондуктометрия
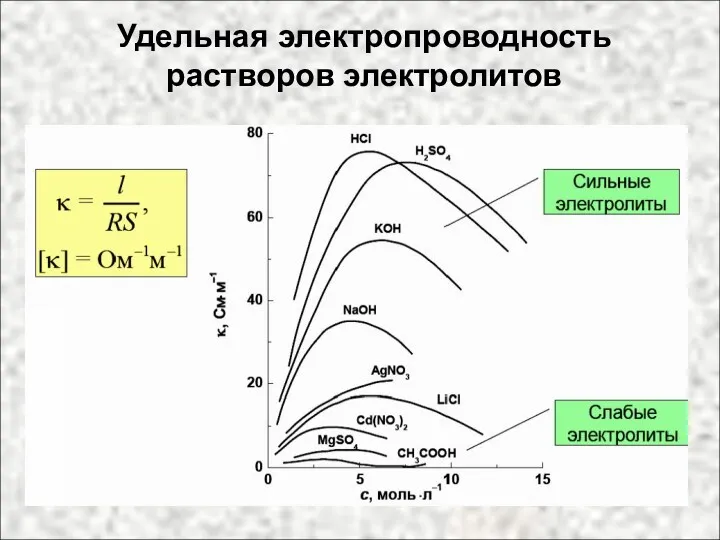
- 42. Непосредственное измерение электропроводности растворов электролитов можно использовать для определения их концент-рации. Этот метод положен в основу
- 43. Если в растворе присутствуют несколько ионов, то его электро-проводность пропорциональна сумме произведений концентра-ций отдельных ионов на
- 44. Удельная электропроводность растворов электролитов
- 45. Существуют два варианта кондуктометрического анализа прямая кондуктометрия – метод, позволяющий непосредст-венно определять концентрацию электролита путем измерения
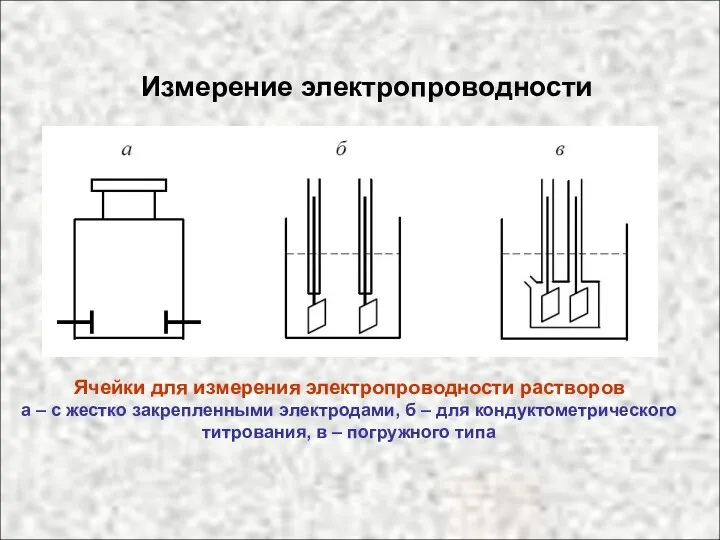
- 46. Измерение электропроводности Ячейки для измерения электропроводности растворов а – с жестко закрепленными электродами, б – для
- 47. Кондуктометрическое титрование Определение конечной точки титрования по изменению электропроводности раствора при известной концентрации раствора титранта.
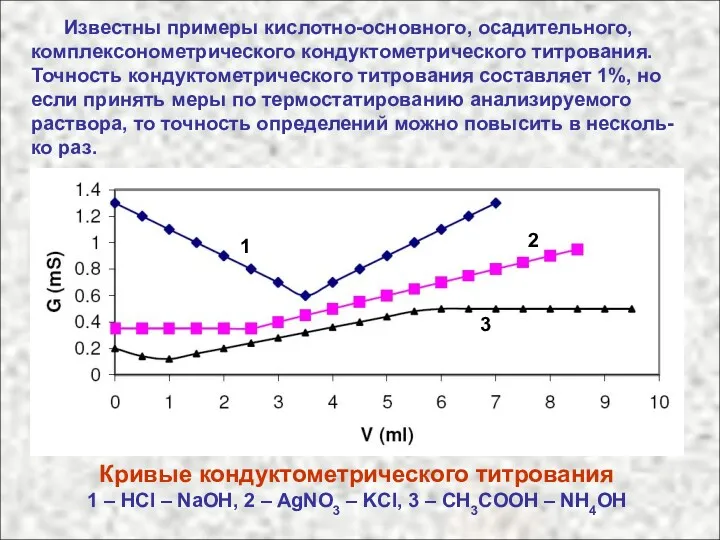
- 48. Известны примеры кислотно-основного, осадительного, комплексонометрического кондуктометрического титрования. Точность кондуктометрического титрования составляет 1%, но если принять меры
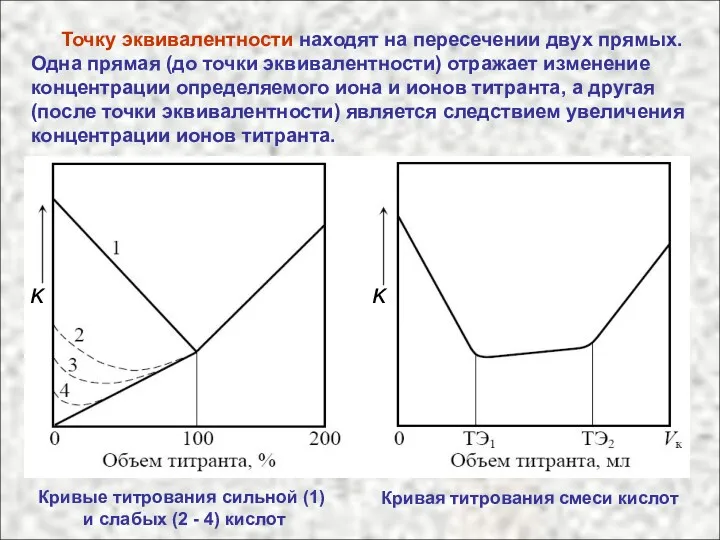
- 49. Точку эквивалентности находят на пересечении двух прямых. Одна прямая (до точки эквивалентности) отражает изменение концентрации определяемого
- 50. Достоинства кондуктометрического титрования 1. Возможность проводить определения не только в прозрач-ных, но в окрашенных и мутных
- 51. Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е
- 52. Инструментальные методы анализа: кинетические методы Майстренко В.Н. Башкирский государственный университет Кафедра аналитической химии V_maystrenko@mail.ru Тел: 229-97-12
- 53. Кинетические методы анализа — методы химического анали-за, использующие зависимость между скоростью реакции и концентрацией реагирующих веществ.
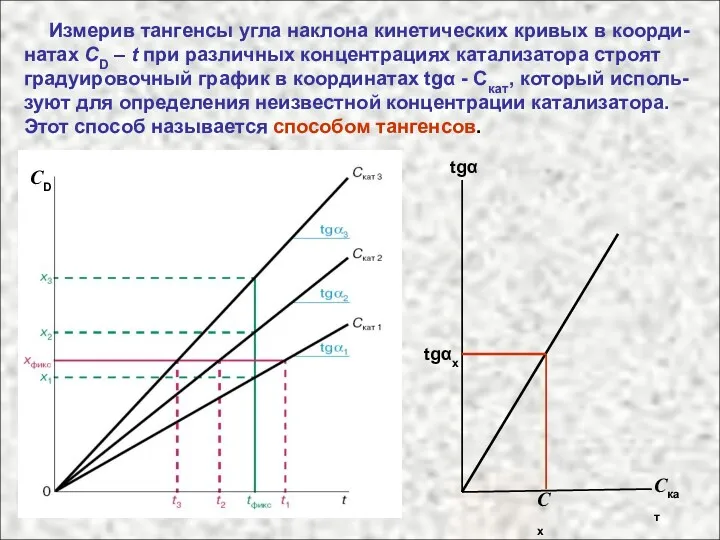
- 54. Измерив тангенсы угла наклона кинетических кривых в коорди-натах CD – t при различных концентрациях катализатора строят
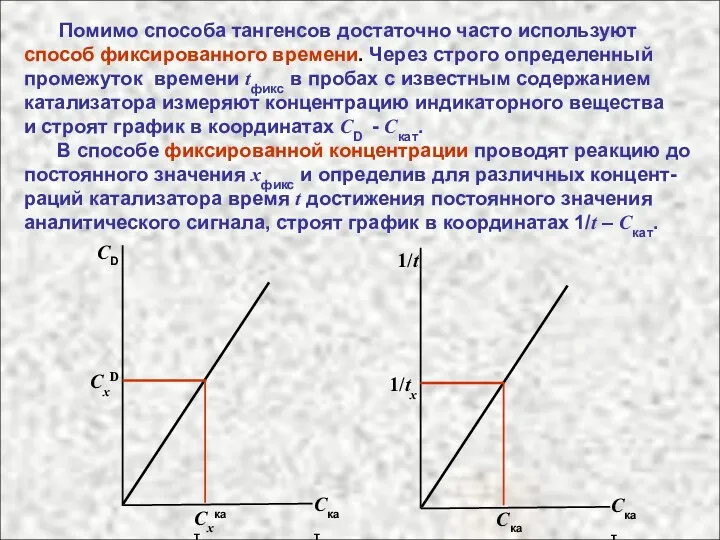
- 55. Помимо способа тангенсов достаточно часто используют способ фиксированного времени. Через строго определенный промежуток времени tфикс в
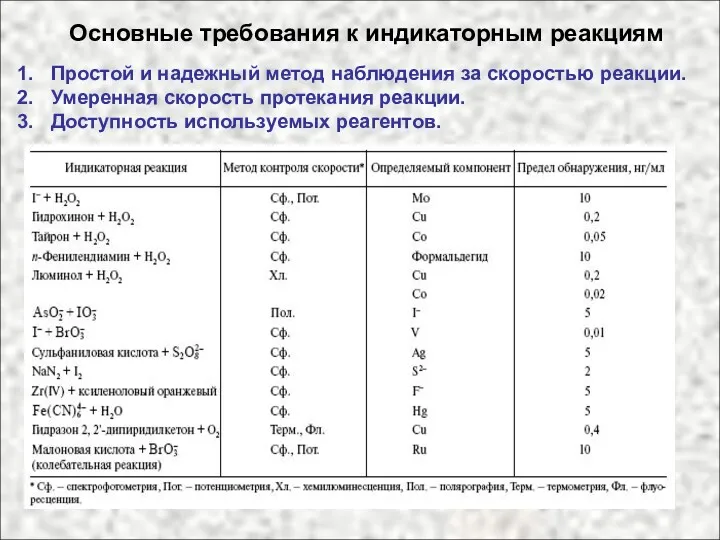
- 56. Основные требования к индикаторным реакциям Простой и надежный метод наблюдения за скоростью реакции. Умеренная скорость протекания
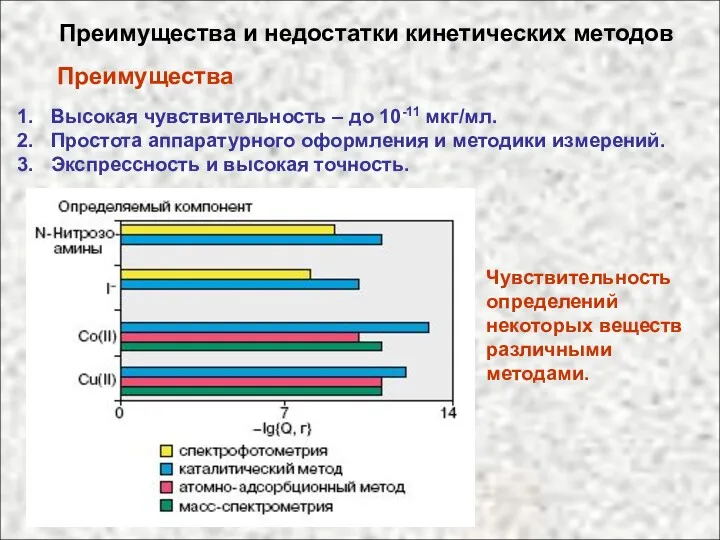
- 57. Преимущества и недостатки кинетических методов Преимущества Высокая чувствительность – до 10-11 мкг/мл. Простота аппаратурного оформления и
- 58. Недостатки 1. Низкая селективность. 2. Влияние мешающих веществ и состава раствора. Способы повышения селективности кинетических методов
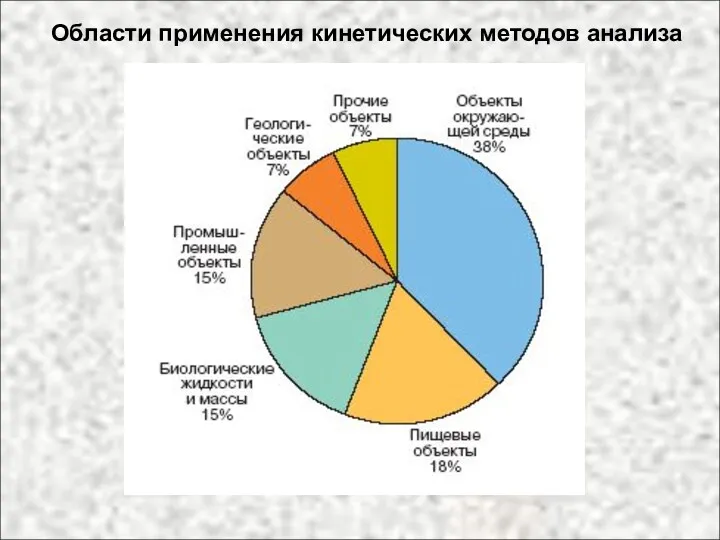
- 59. Области применения кинетических методов анализа
- 60. Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е
- 62. Скачать презентацию





























 Выбор оборудования для участка подготовки, кузовного ремонта и покраски легковых автомобилей
Выбор оборудования для участка подготовки, кузовного ремонта и покраски легковых автомобилей Жылу алмасу үдерістері
Жылу алмасу үдерістері Элементы атомной физики. (Лекция 14)
Элементы атомной физики. (Лекция 14) Что изучает физика? Слово физика
Что изучает физика? Слово физика Хроматографічні методи
Хроматографічні методи Техническое обслуживание и ремонт автомобильных кранов
Техническое обслуживание и ремонт автомобильных кранов Проводники и диэлектрики в электростатическом поле 10 класс
Проводники и диэлектрики в электростатическом поле 10 класс Теоретические и правовые основы метрологического обеспечения
Теоретические и правовые основы метрологического обеспечения Зонная теория твёрдых тел
Зонная теория твёрдых тел Электрический ток в металлах
Электрический ток в металлах Катушки индуктивности
Катушки индуктивности Конусні дробарки
Конусні дробарки Электростатика
Электростатика Метод проектов на уроках физики
Метод проектов на уроках физики Неоднородное одномерное уравнение теплопроводности
Неоднородное одномерное уравнение теплопроводности Ақаулар. Кристалл торларының ақаулары
Ақаулар. Кристалл торларының ақаулары Презентация к уроку Термоядерные реакции
Презентация к уроку Термоядерные реакции Исследовательская работа Электричество в повседневной жизни
Исследовательская работа Электричество в повседневной жизни Презентация к уроку в 10 классе по теме Сила упругости и сила трения
Презентация к уроку в 10 классе по теме Сила упругости и сила трения Создание вакуума в выпарных аппаратах. Принцип работы барометрического конденсатора
Создание вакуума в выпарных аппаратах. Принцип работы барометрического конденсатора Действия электрического тока
Действия электрического тока Сполучені посудини. Манометри
Сполучені посудини. Манометри Юнг тәжірибесі
Юнг тәжірибесі Міцність при змінних навантаженнях. (Лекція 2)
Міцність при змінних навантаженнях. (Лекція 2) Урок физики в 8 классе Электризация тел
Урок физики в 8 классе Электризация тел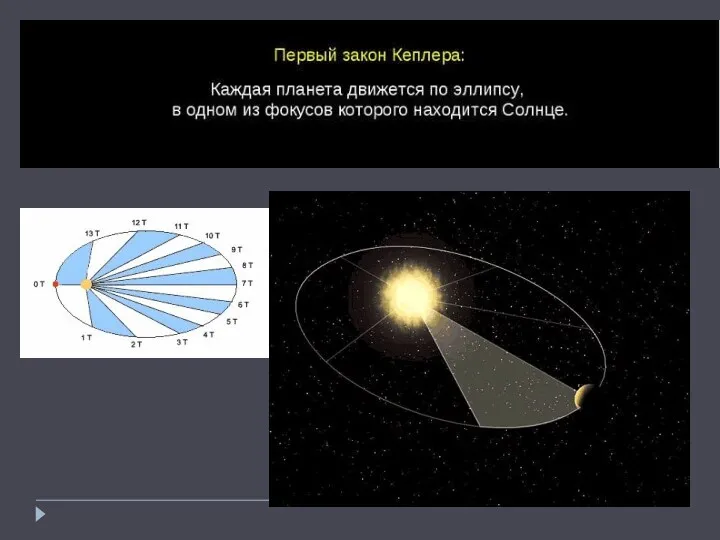 Первый закон Кеплера
Первый закон Кеплера Физическая викторина 7-8 классы.
Физическая викторина 7-8 классы. Контроль качества сварных соединений
Контроль качества сварных соединений