Содержание
- 2. Структура работы: Теоретическая часть. Экспериментальная часть. Электролиз
- 3. Электролиз –физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся
- 4. Из истории электролиза Изучение и применение электролиза началось в конце 18 — начале 19 вв. в
- 5. Преимущества электролиза Преимущества электролиза перед химическим методами получения чистых веществ заключаются в возможности сравнительно просто (регулируя
- 6. Скорость протекания реакций при электролизе зависит: Скорость реакции определяется скоростью переноса электрических зарядов через единицу поверхности
- 7. Использование электролиза Получение кислорода (и других газов). Для очистки воды в промышленности используют электролиз. Электрометаллургия. Некоторые
- 8. Использование электролиза Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена
- 9. Использование электролиза Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины),
- 10. 1.Получение меди на электроде при электролизе Цель работы: наблюдать появление меди на электроде, выявить зависимость массы
- 11. Приборы и материалы: источник тока, ключ, амперметр, провода, реостат, стеклянный сосуд с электродами, медный купорос, часы,
- 12. Выполнение эксперимента
- 13. Выполнение опытов 1.Замыкаем электрическую цепь, наблюдаем выделение меди на электроде и образование газа на поверхности электролита.
- 14. Выполняем 3 серии экспериментов 1.Проводим 3 опыта по 60 минут, изменяя при этом силу тока через
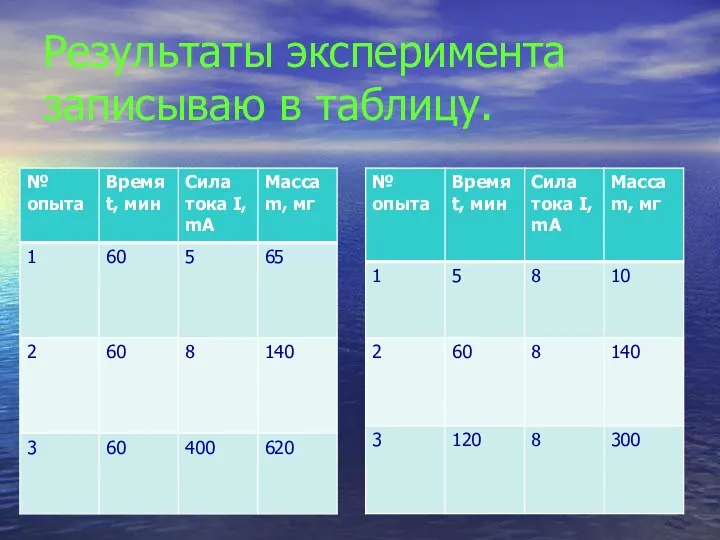
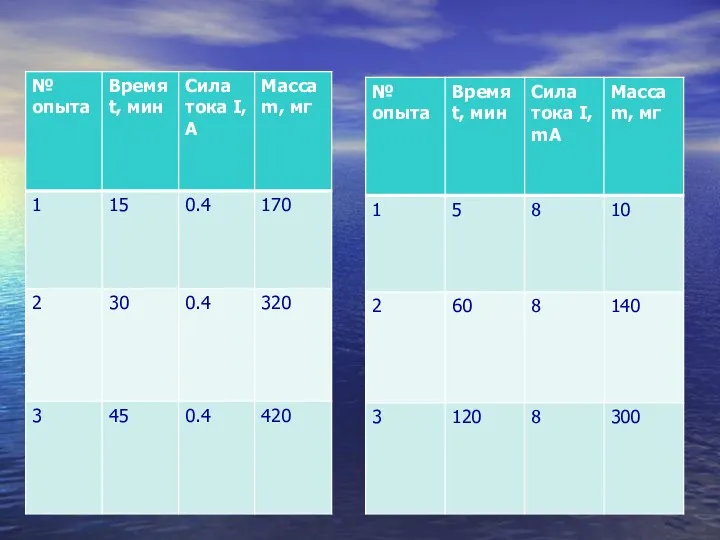
- 15. Результаты эксперимента записываю в таблицу.
- 17. Вывод 1. Чем больше сила тока, протекающего через электролит, тем больше масса вещества, выделяющегося на электроде.
- 19. Скачать презентацию














 Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Техническое обслуживание и ремонт автосцепки локомотива
Техническое обслуживание и ремонт автосцепки локомотива Анализ технико-экономической эффективности КПГУ на базе паротурбинной установки ПТ-135/165-130/15
Анализ технико-экономической эффективности КПГУ на базе паротурбинной установки ПТ-135/165-130/15 Люди нашего края
Люди нашего края optika
optika Источники звука.Звуковые колебания.
Источники звука.Звуковые колебания. Затухающие и вынужденные колебания
Затухающие и вынужденные колебания Судовые устройства
Судовые устройства Операциялық жүйелер және қолданбалы бағдарламалар пакеті
Операциялық жүйелер және қолданбалы бағдарламалар пакеті The photon and thefor vacuum cleaner
The photon and thefor vacuum cleaner Ядролық Магниттік Резонанс (ЯМР)
Ядролық Магниттік Резонанс (ЯМР) Презентация Электрическая цепь и ее составные части
Презентация Электрическая цепь и ее составные части Проводники в электростатическом поле. Конденсаторы. Энергия электрического поля. (Лекция 3)
Проводники в электростатическом поле. Конденсаторы. Энергия электрического поля. (Лекция 3) Проектирование фрагментов уроков физики с применением ЦОР
Проектирование фрагментов уроков физики с применением ЦОР Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4)
Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4) Презентация-отчет по учебной практике
Презентация-отчет по учебной практике Технологические карты и аннотированные каталоги. Сообщение на заседании кафедры ЕМД
Технологические карты и аннотированные каталоги. Сообщение на заседании кафедры ЕМД Повітряний транспорт
Повітряний транспорт экологическое воспитание на уроках физики
экологическое воспитание на уроках физики Густина речовини. Роз'язування задач
Густина речовини. Роз'язування задач Плотность вещества. 7 класс
Плотность вещества. 7 класс Открытие нейтрона и протона
Открытие нейтрона и протона Поршневой жидкостный насос. Гидравлический пресс
Поршневой жидкостный насос. Гидравлический пресс Повторение по теме Электромагнитная индукция
Повторение по теме Электромагнитная индукция Дифракция света. Принцип Гюйгенса-Френеля
Дифракция света. Принцип Гюйгенса-Френеля Механические передачи. Планетарные и волновые передачи. (Лекция 8)
Механические передачи. Планетарные и волновые передачи. (Лекция 8) Тепловое излучение
Тепловое излучение Концентраторные солнечные электростанции с системами слежения за солнцем
Концентраторные солнечные электростанции с системами слежения за солнцем