Содержание
- 2. СОДЕРЖАНИЕ Атом водорода Постулаты Бора Квантовая теория строения атома водорода( по Бору) Правило квантования Энергия электрона
- 3. АТОМ ВОДОРОДА Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания
- 4. ПЕРВЫЙ ПОСТУЛАТ БОРА (ПОСТУЛАТ СТАЦИОНАРНЫХ СОСТОЯНИЙ) Существуют стационарные состояния атома, находясь в которых он не излучает
- 5. ВТОРОЙ ПОСТУЛАТ БОРА (ПОСТУЛАТ КВАНТОВАНИЯ ОРБИТ) Излучение испускается или поглощается в виде квантов энергии при переходе
- 6. КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА ВОДОРОДА( ПО БОРУ) Постулаты Бора определили направление развития новой науки – квантовой
- 7. ПРАВИЛО КВАНТОВАНИЯ где e – элементарный заряд, ε0 – электрическая постоянная. Скорость электрона υ и радиус
- 8. ЭНЕРГИЯ ЭЛЕКТРОНА ДЛЯ ЛЮБОЙ СТАЦИОНАРНОЙ ОРБИТЫ Следует отметить, что Ep Радиусы последующих орбит возрастают пропорционально n2.
- 9. Согласно второму постулату Бора, при переходе электрона с одной стационарной орбиты с энергией En на другую
- 10. ЛИНЕЙЧАТЫЕ АТОМНЫЕ СПЕКТРЫ Идея о квантовании энергии позволила объяснить происхождение линейчатых атомных спектров, состоящих из набора
- 11. СПЕКТРАЛЬНЫЕ СЕРИИ АТОМА ВОДОРОДА Спектральные серии атома водорода - набор спектральных серий, составляющих спектр атома водорода.
- 12. В спектре водорода имеется еще несколько серий, в частности серия, открытая в 1906 г. английским физиком
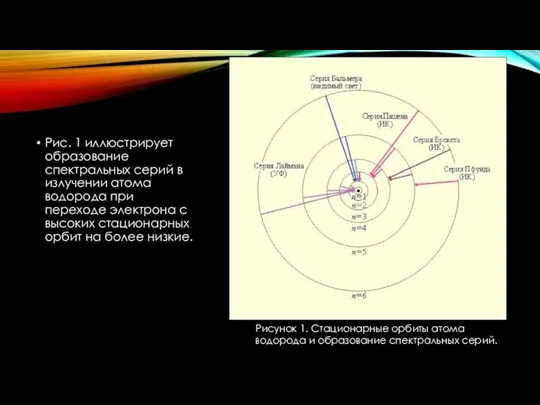
- 13. Рисунок 1. Стационарные орбиты атома водорода и образование спектральных серий. Рис. 1 иллюстрирует образование спектральных серий
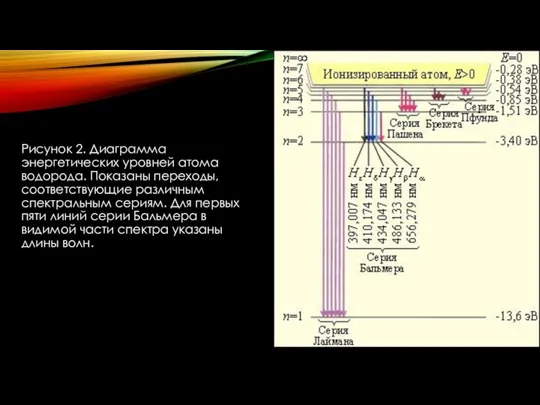
- 14. Рисунок 2. Диаграмма энергетических уровней атома водорода. Показаны переходы, соответствующие различным спектральным сериям. Для первых пяти
- 15. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ http://www.myshared.ru/slide/301351/# http://www.bourabai.kz/physics/spectra.html https://ru.wikipedia.org/wiki/%D1%EF%E5%EA%F2%F0%E0%E.. http://fn.bmstu.ru/data-physics/library/physbook/tom5/ch5/texthtml/ch5_2.htm http://www.its-physics.org/atom-vodoroda-lineychatye-spektry http://www.youtube.com/watch?v=qly4Qb5xgfk Р. И. Грабовский «Курс Физики», 2007 г.
- 17. Скачать презентацию












 Поршневые двигатели внутреннего сгорания
Поршневые двигатели внутреннего сгорания Резание металла слесарной ножовкой
Резание металла слесарной ножовкой Дисперсия света
Дисперсия света Электродинамика бөлімі бойынша оқу материалын қайталау, қорытындылау және жүйелеу
Электродинамика бөлімі бойынша оқу материалын қайталау, қорытындылау және жүйелеу Балочные системы. (Тема 1.4)
Балочные системы. (Тема 1.4) Исследование ошибок, допущенных на ЕГЭ в разделе Элементы СТО (с мультимедийной презентацией)
Исследование ошибок, допущенных на ЕГЭ в разделе Элементы СТО (с мультимедийной презентацией) Открытый урок по физике Звуковые волны
Открытый урок по физике Звуковые волны Оборудование для заземления нейтрали в сетях 6-35 кВ
Оборудование для заземления нейтрали в сетях 6-35 кВ Механическая коробка передач
Механическая коробка передач Ракетные двигатели
Ракетные двигатели Лекция 10. Тема: поляризация
Лекция 10. Тема: поляризация Презентация по теме Внутренняя энергия и способы ее изменения8кл
Презентация по теме Внутренняя энергия и способы ее изменения8кл Второй закон термодинамики
Второй закон термодинамики Техническое обслуживание и ремонт ходовой части автомобилей
Техническое обслуживание и ремонт ходовой части автомобилей Швартовные операции. Швартовка к причалу
Швартовные операции. Швартовка к причалу Электротехника и электроника
Электротехника и электроника Воздушно-правовая подготовка
Воздушно-правовая подготовка Приборы для измерения скорости и ускорения
Приборы для измерения скорости и ускорения Вступ. Елементи кінематики
Вступ. Елементи кінематики Техническое обслуживание и текущий ремонт ходовой части автомобиля
Техническое обслуживание и текущий ремонт ходовой части автомобиля Зрительное восприятие трехмерного пространства человеком. Системы формирования объемного изображения
Зрительное восприятие трехмерного пространства человеком. Системы формирования объемного изображения Электронно-лучевой осциллограф
Электронно-лучевой осциллограф Инжекторная система впрыска топлива
Инжекторная система впрыска топлива Итоговый урок по теме Взаимодействие тел
Итоговый урок по теме Взаимодействие тел Plasmonics
Plasmonics Строение вещества.
Строение вещества. Агрегатные состояния вещества
Агрегатные состояния вещества Повторение формул по физике, 7 класс
Повторение формул по физике, 7 класс