Содержание
- 2. Бор Нильс Хенрик Давид (7.10.1885—18.11.1962) Датский физик, один из создателей современной физики. Основатель (1920) и руководитель
- 3. Строение атома Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества.
- 4. Экспериментальная проверка модели атома Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом (рис. 2)
- 5. Резерфорд предложил ядерную ( планетарную) модель строения атома (рис.4) Атом имеет ядро, размеры которого малы по
- 6. Модель Резерфорда 1. В целом атом нейтрален, из чего следует, что число внутриатомных электронов, как и
- 7. обнаружила и свои недостатки: неспособна объяснить не смогла объяснить все свойства атомов, факт длительного существования атома,
- 8. По классическим законам атом должен излучать электромагнитные волны, т.к. электроны движутся с ускорением. НО атомы обычно
- 9. Бор предположил, что электрон в атоме не подчиняется законам классической физики. ПОСТУЛАТЫ БОРА
- 10. В 1913 году Бор показал, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических
- 11. Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная
- 12. II постулат 2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией в
- 13. Если атом водорода переходит из более высоких энергетических состояний - в третье: излучение света происходит в
- 14. Если атом водорода переходит из более высоких энергетических состояний - во второе -излучение света происходит в
- 15. СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ Если атом водорода переходит из более высоких энергетических состояний - в первое
- 16. Если атом переходит в одно из возбужденных состояний, долго оставаться там он не может: атом самопроизвольно
- 17. Свои постулаты Бор применил для объяснения излучения и поглощения света атомом водорода.
- 18. На основании теории Бора оказалось возможным построить количественную теорию спектра водорода. АТОМ ВОДОРОДА
- 19. УЛЬТРАФИОЛЕТ ВИДИМЫЙ СВЕТ АТОМ ВОДОРОДА ИНФРАКРАСНОЕ
- 20. спектры излучения Спектр нагретого вещества в газообразном состоянии состоит из узких линий разного цвета. Такой спектр
- 21. СПЕКТРЫ ИСПУСКАНИЯ Расчеты Бора привели к согласию с экспериментально определенными частотами. Частоты излучений можно определить по
- 22. СПЕКТРЫ ПОГЛОЩЕНИЯ Поглощение света- процесс, обратный излучению: атом переходит из низших энергетических состояний в высшие. При
- 23. СПЕКТРЫ ИСПУСКАНИЯ СПЕКТРЫ ПОГЛОЩЕНИЯ 1-сплошной 2-натрия 3-водорода 4-гелия 5-солнечный 6-натрия 7-водорода 8-гелия
- 24. ТРУДНОСТИ ТЕОРИИ Построить количественную теорию уже для атома гелия на основе боровских представлений оказалось затруднительным
- 26. Скачать презентацию























 Основы теории размерных цепей
Основы теории размерных цепей Основные положения сопротивления материалов
Основные положения сопротивления материалов Дифракция.
Дифракция.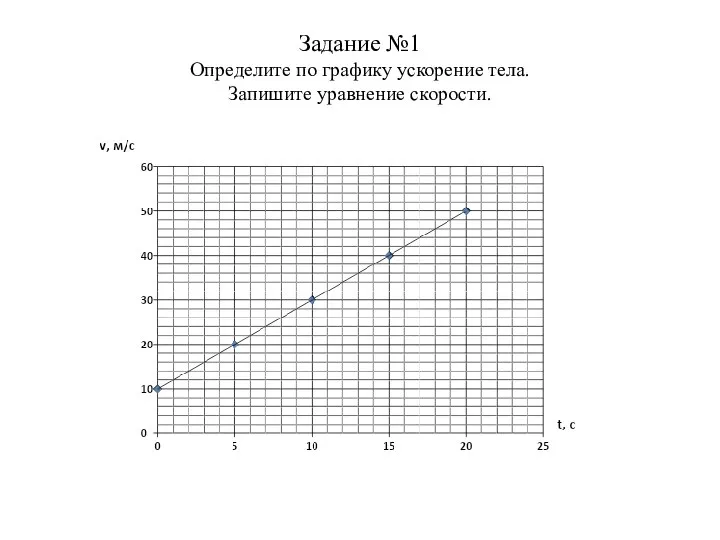 Зачет по теме График и уравнение скорости равноускоренного движения
Зачет по теме График и уравнение скорости равноускоренного движения Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости Плазма. Что такое плазма?
Плазма. Что такое плазма? Интерактивный учебный курс по изучению темы Оптика
Интерактивный учебный курс по изучению темы Оптика Природа света. Законы освещенности
Природа света. Законы освещенности Режимы работы промышленных электрических сетей
Режимы работы промышленных электрических сетей Неньютоновская жидкость
Неньютоновская жидкость Математические модели процессов тепломассообмена. Термодинамические процессы
Математические модели процессов тепломассообмена. Термодинамические процессы ‘06MY ELANTRA (HD) - Technical Highlights
‘06MY ELANTRA (HD) - Technical Highlights Результаты ЕГЭ по физике в Самарской области 2022 год
Результаты ЕГЭ по физике в Самарской области 2022 год Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1
Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1 Люминесцентная спектроскопия
Люминесцентная спектроскопия Свойства топлив. Теплота сгорания топлив. Урок № 4
Свойства топлив. Теплота сгорания топлив. Урок № 4 История лампы накаливания
История лампы накаливания Лекция 3. Кристаллизация
Лекция 3. Кристаллизация Плазмалық технологиялардың физикалық негіздері
Плазмалық технологиялардың физикалық негіздері Домашняя лабораторная работа. Плотность куска мыла
Домашняя лабораторная работа. Плотность куска мыла Полевая геофизика. Вводная лекция
Полевая геофизика. Вводная лекция Сила тяжести на других планетах. Физические характеристики планет (закон всемирного тяготения)
Сила тяжести на других планетах. Физические характеристики планет (закон всемирного тяготения) Силы в природе
Силы в природе Основы гидродинамического подобия
Основы гидродинамического подобия презентация урока Закон Ома для участка цепи
презентация урока Закон Ома для участка цепи Виштовхувальна сила. Закон Архімеда
Виштовхувальна сила. Закон Архімеда Сопротивление материалов. (Лекция 1)
Сопротивление материалов. (Лекция 1) Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини
Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини