Содержание
- 2. ХАРАКТЕРИСТИКИ ФЛУОРЕСЦЕНЦИИ
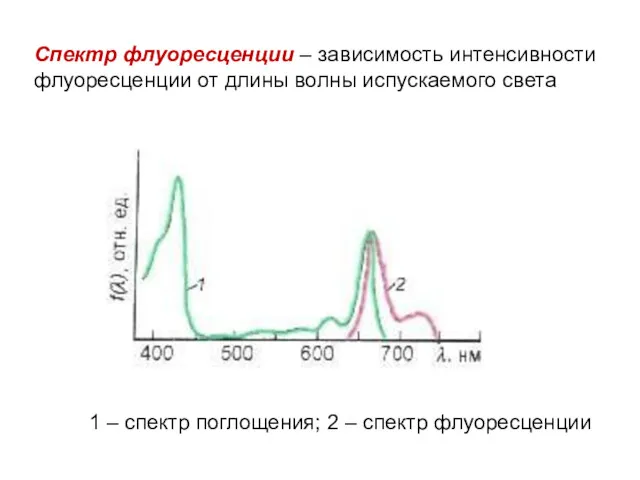
- 3. Спектр флуоресценции – зависимость интенсивности флуоресценции от длины волны испускаемого света 1 – спектр поглощения; 2
- 4. Спектр возбуждения флуоресценции – зависимость интенсивности флуоресценции от длины волны возбуждающего света. Квантовый выход флуоресценции –
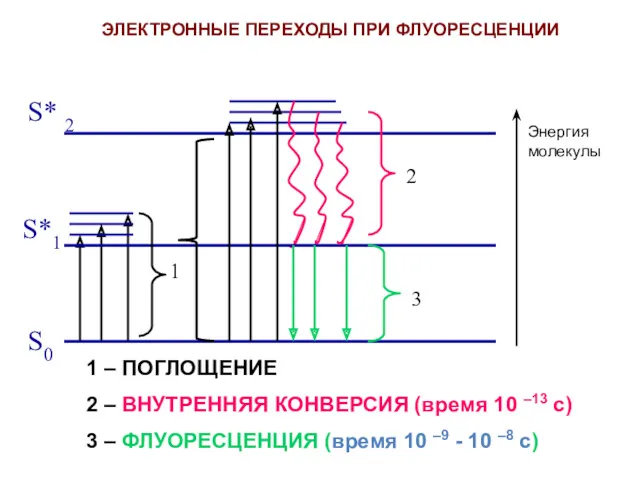
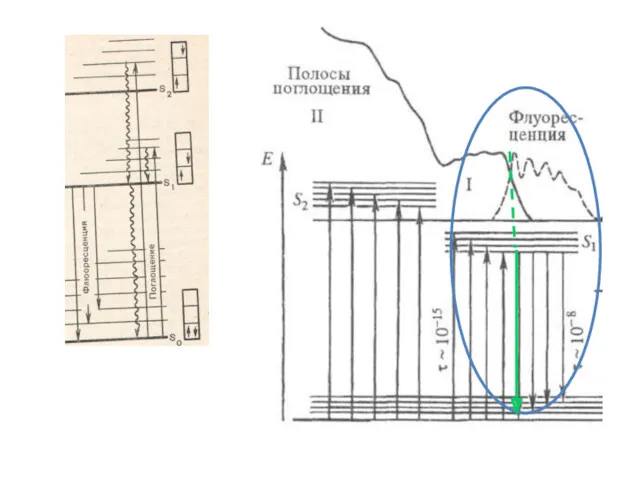
- 5. 1 – ПОГЛОЩЕНИЕ 2 – ВНУТРЕННЯЯ КОНВЕРСИЯ (время 10 –13 с) 3 – ФЛУОРЕСЦЕНЦИЯ (время 10
- 7. ЗАКОНЫ ФЛУОРЕСЦЕНЦИИ ЗАКОН СТОКСА ПРАВИЛО ЛЕВШИНА ПРАВИЛО КАША ЗАКОН ВАВИЛОВА
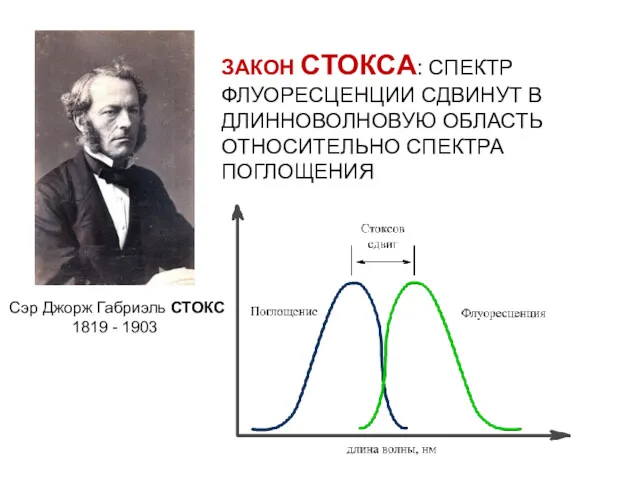
- 8. ЗАКОН СТОКСА: СПЕКТР ФЛУОРЕСЦЕНЦИИ СДВИНУТ В ДЛИННОВОЛНОВУЮ ОБЛАСТЬ ОТНОСИТЕЛЬНО СПЕКТРА ПОГЛОЩЕНИЯ Сэр Джорж Габриэль СТОКС 1819
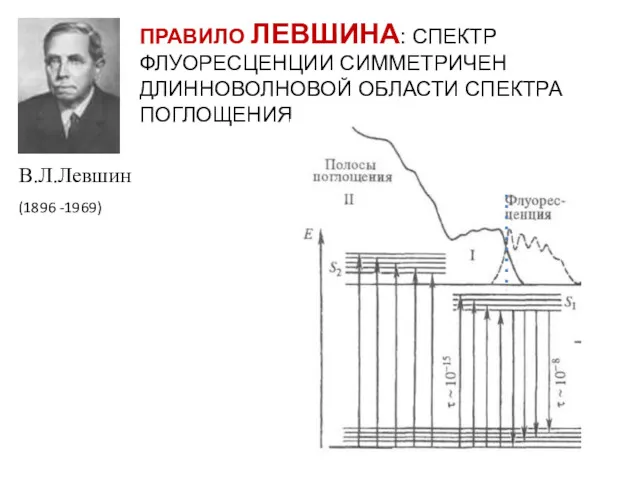
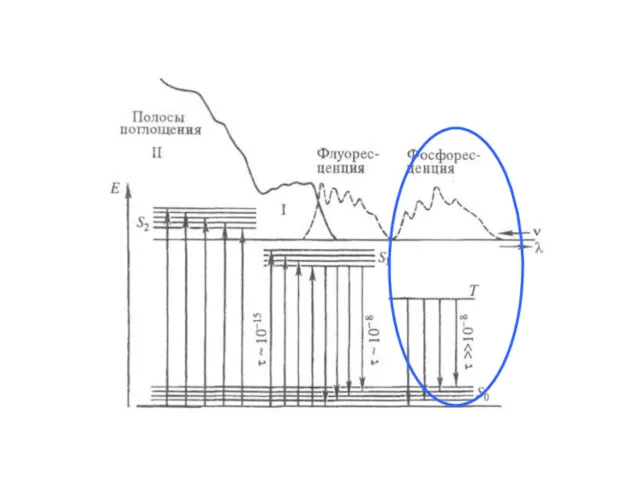
- 9. ПРАВИЛО ЛЕВШИНА: СПЕКТР ФЛУОРЕСЦЕНЦИИ СИММЕТРИЧЕН ДЛИННОВОЛНОВОЙ ОБЛАСТИ СПЕКТРА ПОГЛОЩЕНИЯ (1896 -1969) В.Л.Левшин
- 10. ПРАВИЛО КАША Майкл КАША р.1920 Предложено химиком Майклом Каша (Michael Kasha) в 1950. Правило Каша: при
- 11. ПРАВИЛО ВАВИЛОВА: НЕЗАВИСИМОСТЬ КВАНТОВОГО ВЫХОДА ϕ ФЛУОРЕСЦЕНЦИИ ОТ ДЛИНЫ ВОЛНЫ ВОЗБУЖДАЮЩЕГО СВЕТА С.И.Вавилов
- 12. ФОСФОРЕСЦЕНЦИЯ
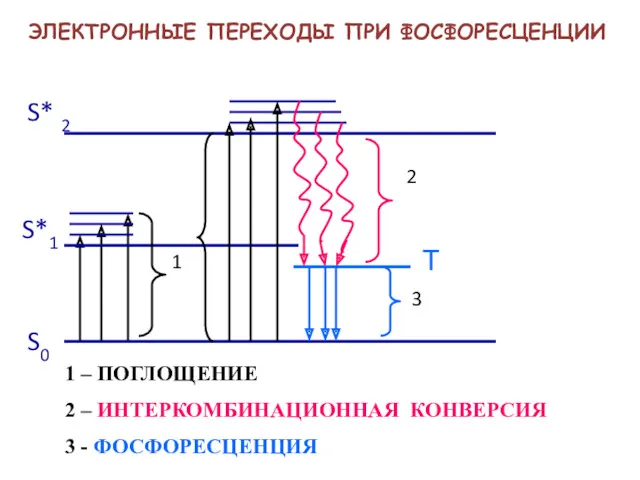
- 13. S0 S*1 S* 2 1 2 3 ЭЛЕКТРОННЫЕ ПЕРЕХОДЫ ПРИ ФОСФОРЕСЦЕНЦИИ Т 1 – ПОГЛОЩЕНИЕ 2
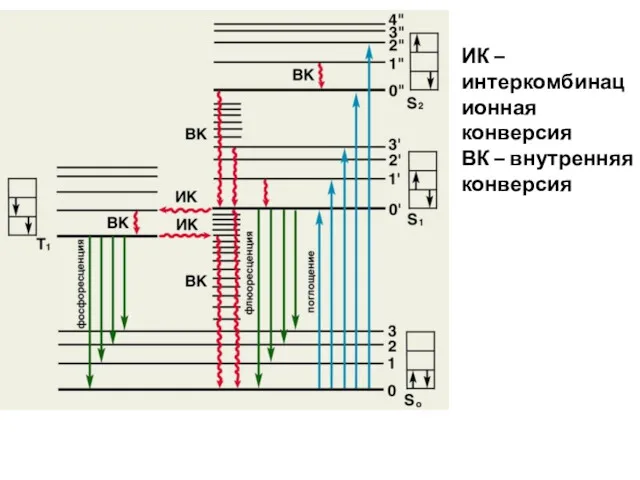
- 14. ИК – интеркомбинационная конверсия ВК – внутренняя конверсия
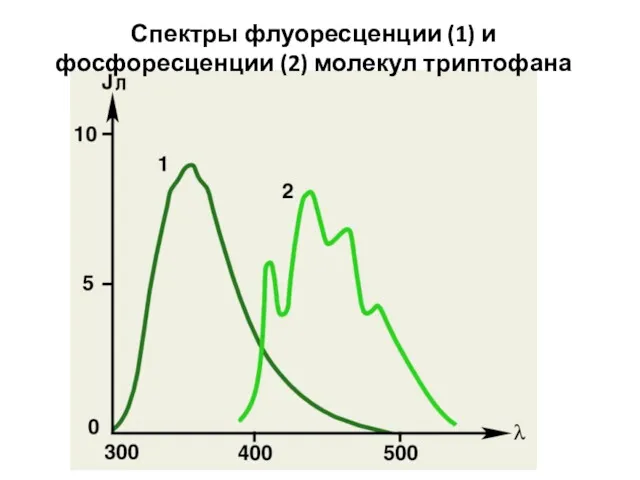
- 16. Спектры флуоресценции (1) и фосфоресценции (2) молекул триптофана
- 17. МЕТОДЫ ОБНАРУЖЕНИЯ ТРИПЛЕТНЫХ УРОВНЕЙ ЭПР ИМПУЛЬСНЫЙ ФОТОЛИЗ ТЕРМОЛЮМИНЕСЦЕНЦИЯ ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ
- 18. ЛЮМИНЕСЦЕНЦИЯ И ЕЕ ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
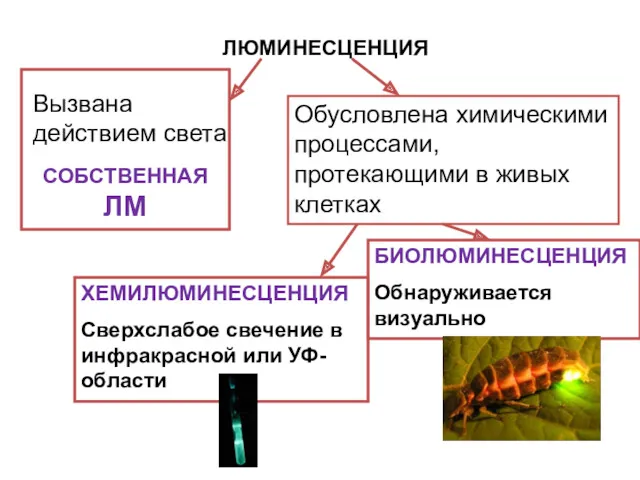
- 19. ЛЮМИНЕСЦЕНЦИЯ СОБСТВЕННАЯ ЛМ ХЕМИЛЮМИНЕСЦЕНЦИЯ Сверхслабое свечение в инфракрасной или УФ-области Вызвана действием света Обусловлена химическими процессами,
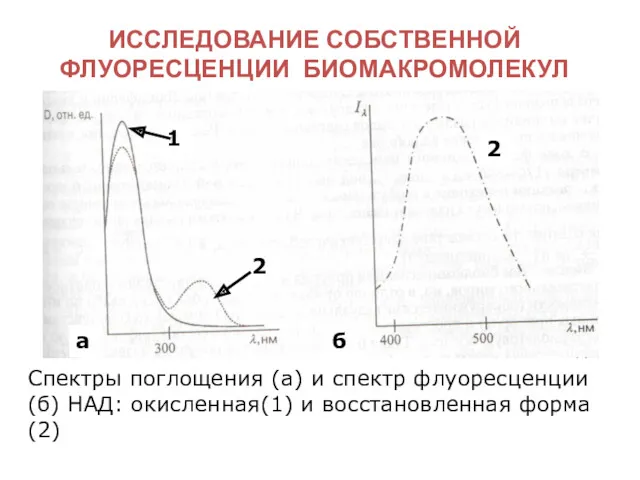
- 20. ИССЛЕДОВАНИЕ СОБСТВЕННОЙ ФЛУОРЕСЦЕНЦИИ БИОМАКРОМОЛЕКУЛ Спектры поглощения (а) и спектр флуоресценции (б) НАД: окисленная(1) и восстановленная форма(2)
- 21. МЕТОД ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ а, б – изменение [Са2+]in, обнаруженное с помощью арсеназо 1 – ПД 2
- 22. Озеро Гиппсленд в Австралии БИОЛЮМИНЕСЦЕНЦИЯ - видимое свечение некоторых живых организмов. Это явление широко распространено в
- 24. Условия биолюминесценции энергия, выделяющаяся в ходе реакции должна превышать ~41-71.5 ккал/моль разница энергий основного и возбуждённого
- 25. ОБЩИЙ МЕХАНИЗМ: ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ НИЗКОМОЛЕКУЛЯРНОГО СУБСТРАТА (ЛЮЦИФЕРИНА), КАТАЛИЗИРУЕМОЕ ФЕРМЕНТОМ ЛЮЦИФЕРАЗА
- 26. В процессе обмена веществ освобождённая энергия АТФ в присутствии кислорода при наличии Мg2+ и фермента люциферазы
- 27. БИОЛЮМИНЕСЦЕНЦИЯ СВЕТЛЯКОВ E + LH2 + ATP → E-LH2-AMP + ПФ E-LH2-AMP → E + P
- 28. Квантовые выходы биолюминесценции очень высоки и достигают значений 0.1-1. Длина волны света, излучаемого при биолюминесцентных процессах,
- 29. Максимум в спектре излучения в биолюминесцентных процессах может изменяться в зависимости от условий протекания реакции. Например,
- 30. 1 причина Оксилюциферин может существовать в нескольких формах с различной энергией основного состояния. Следовательно, различаются и
- 31. 2 причина Микроокружение молекулы оксилюциферина в основном и возбуждённом состояниях. Оксилюциферин взаимодействует с растворителем и образует
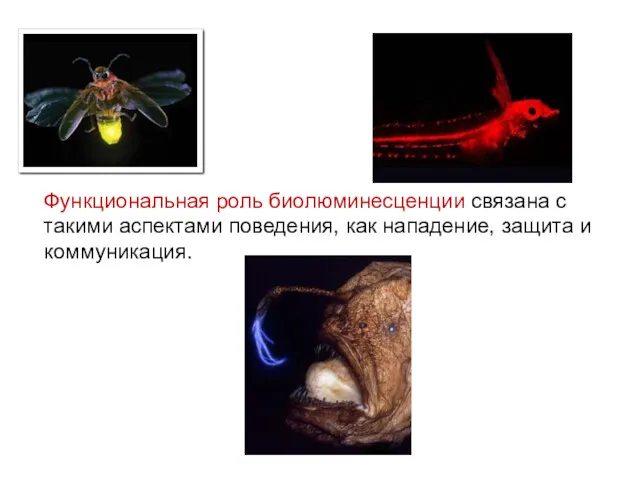
- 32. Функциональная роль биолюминесценции связана с такими аспектами поведения, как нападение, защита и коммуникация.
- 33. ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ БИОЛЮМИНЕСЦЕНЦИИ
- 34. 1.ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АТФ В РАЗЛИЧНЫХ ОБЪЕКТАХ ОСНОВАНО НА БИОЛЮМИНЕСЦЕНЦИИ СВЕТЛЯКОВ: ИСПОЛЬЗУЮТ СМЕСЬ ЛЮЦИФЕРИН-ЛЮЦИФЕРАЗА.
- 35. 2. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ФМН (флавинмононуклеотид, является простетической группой различных оксидоредуктаз) ФАД (флавинадениндинуклеотид — кофермент, принимающий участие
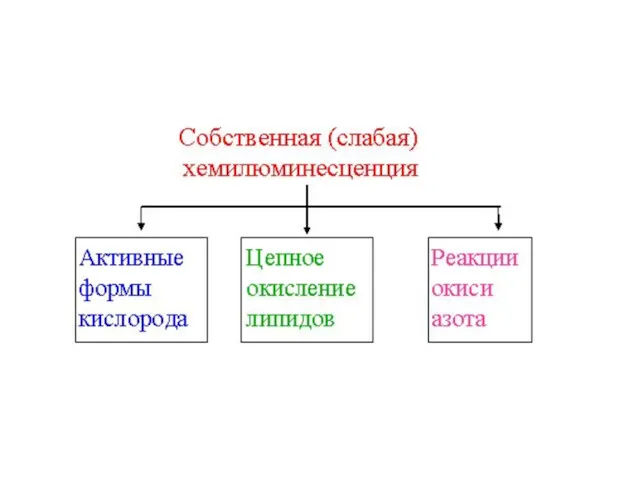
- 36. СВЕРХСЛАБОЕ СВЕЧЕНИЕ (СОБСТВЕННАЯ ХЕМИЛЮМИНЕСЦЕНЦИЯ)
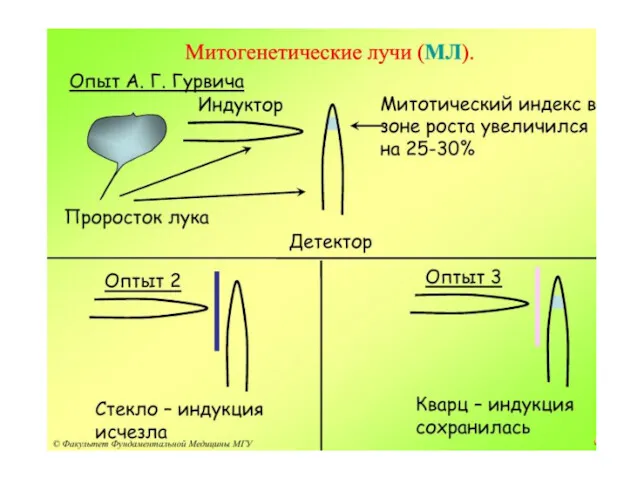
- 37. НАЧАЛО ИЗУЧЕНИЯ – РАБОТЫ А.Г.ГУРВИЧА. ОТКРЫТИЕ ИМ В 1923Г. «МИТОГЕНЕТИЧЕСКИХ ЛУЧЕЙ» Александр Гаврилович Гурвич (1874 -
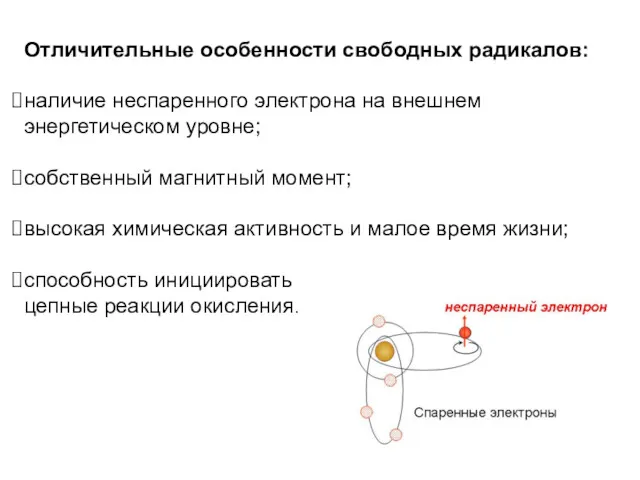
- 40. Отличительные особенности свободных радикалов: наличие неспаренного электрона на внешнем энергетическом уровне; собственный магнитный момент; высокая химическая
- 41. РЕАКЦИИ С УЧАСТИЕМ АКТИВНЫХ ФОРМ КИСЛОРОДА ПРИМЕРЫ АФК: ПЕРЕКИСЬ ВОДОРОДА (H2O2), ГИПОХЛОРИТ (ClO-), КИСЛОРОДНЫЕ РАДИКАЛЫ (СУПЕРОКСИД
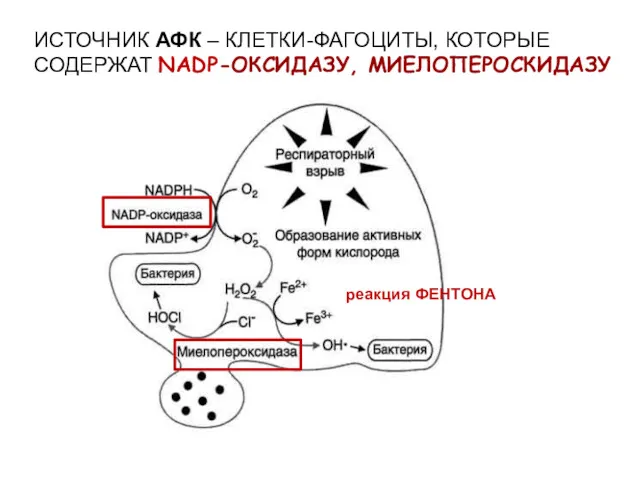
- 42. ИСТОЧНИК АФК – КЛЕТКИ-ФАГОЦИТЫ, КОТОРЫЕ СОДЕРЖАТ NADP-ОКСИДАЗУ, МИЕЛОПЕРОСКИДАЗУ
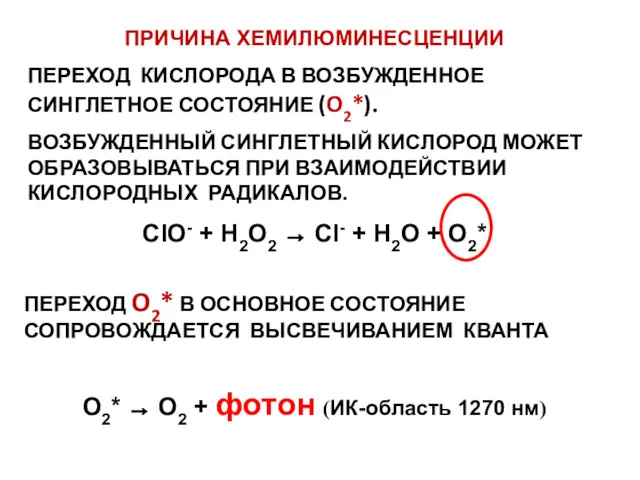
- 43. ПРИЧИНА ХЕМИЛЮМИНЕСЦЕНЦИИ ПЕРЕХОД КИСЛОРОДА В ВОЗБУЖДЕННОЕ СИНГЛЕТНОЕ СОСТОЯНИЕ (O2*). ВОЗБУЖДЕННЫЙ СИНГЛЕТНЫЙ КИСЛОРОД МОЖЕТ ОБРАЗОВЫВАТЬСЯ ПРИ ВЗАИМОДЕЙСТВИИ
- 44. O2* + O2* → [(O2)2]* (эксимер кислорода) [(O2)2]* → 2O2 + hν3 (480, 540, 640 нм)
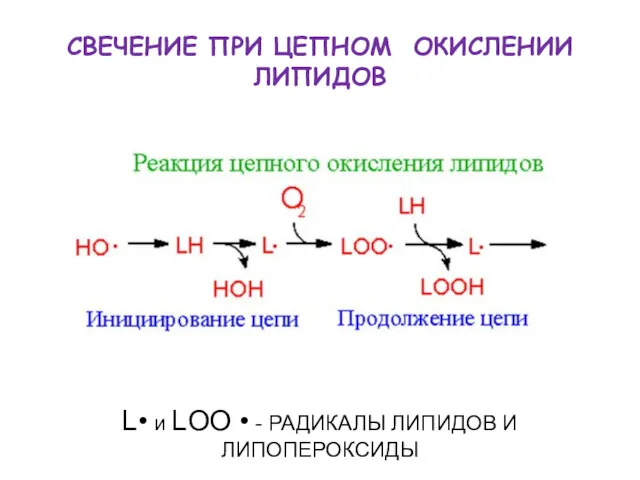
- 45. СВЕЧЕНИЕ ПРИ ЦЕПНОМ ОКИСЛЕНИИ ЛИПИДОВ L• и LOO • - РАДИКАЛЫ ЛИПИДОВ И ЛИПОПЕРОКСИДЫ
- 46. LOO· + LOO· → LOH + L=O* + O2* L=O* → L=O + hν1 (420 -
- 47. ХЕМИЛЮМИНЕСЦЕНЦИЯ В РЕАКЦИЯХ С УЧАСТИЕМ NO ОКСИД АЗОТА ВЫДЕЛЯЕТСЯ МНОГИМИ ТИПАМИ КЛЕТОК И ЯВЛЯЕТСЯ РЕГУЛЯТОРОМ ВНУТРИКЛЕТОЧНЫХ
- 48. ОБЩИЙ МЕХАНИЗМ ХЕМИЛЮМИНЕСЦЕНЦИИ ВОССТАНОВЛЕНИЕ ОДНОГО ИЗ УЧАСТНИКОВ РЕАКЦИИ (ПРИСОЕДИНЕНИЕ ЭЛЕКТРОНА) И ОКИСЛЕНИЕ ДРУГОГО. ЭТО ПРИВОДИТ К
- 49. НИЗКАЯ ИНТЕНСИВНОСТЬ ХЕМИЛЮМИНЕСЦЕНЦИИ ПРИЧИНЫ 1. низкая концентрация радикалов в биосистемах из-за их высокой активности. 2. в
- 50. Квантовый выход образования возбужденных молекул Квантовый выход люминесценции продукта реакции 10-4-10-5 10-4- 10 - 5 Общий
- 51. ЗДЕСЬ R – РАДИКАЛ, А – ХИМИЧЕСКИЙ АКТИВАТОР, Р – ОТВЕТСТВЕННЫЙ ЗА ХЕМИЛЮМИНЕСЦЕНЦИЮ ПРОДУКТ ПРЕВРАЩЕНИЯ МОЛЕКУЛЫ
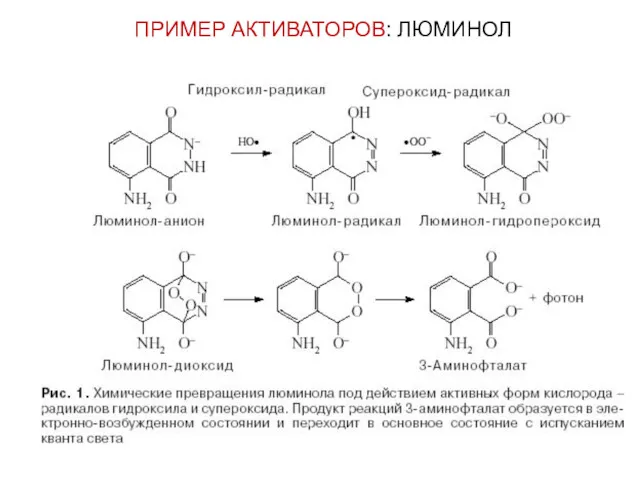
- 52. ПРИМЕР АКТИВАТОРОВ: ЛЮМИНОЛ
- 53. ФИЗИЧЕСКИЕ АКТИВАТОРЫ ХЕМИЛЮМИНЕСЦЕНЦИИ ФИЗИЧЕСКИЕ АКТИВАТОРЫ НЕ ВСТУПАЮТ В ХИМИЧЕСКИЕ РЕАКЦИИ, НО МНОГОКРАТНО УСИЛИВАЮТ ИНТЕНСИВНОСТЬ ХЕМИЛЮМИНЕСЦЕНЦИИ. МЕХАНИЗМ:
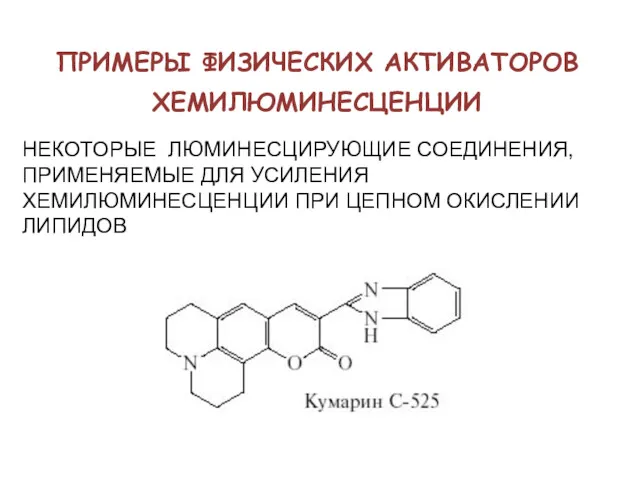
- 54. ПРИМЕРЫ ФИЗИЧЕСКИХ АКТИВАТОРОВ ХЕМИЛЮМИНЕСЦЕНЦИИ НЕКОТОРЫЕ ЛЮМИНЕСЦИРУЮЩИЕ СОЕДИНЕНИЯ, ПРИМЕНЯЕМЫЕ ДЛЯ УСИЛЕНИЯ ХЕМИЛЮМИНЕСЦЕНЦИИ ПРИ ЦЕПНОМ ОКИСЛЕНИИ ЛИПИДОВ
- 56. ОRMED-Lum – современный высокотехнологичный аппаратно-программный комплекс, предназначенный для регистрации сверхслабых световых потоков, сопровождающих биохимические реакции, физические
- 58. Скачать презентацию








![МЕТОД ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ а, б – изменение [Са2+]in, обнаруженное с](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/144926/slide-20.jpg)















![O2* + O2* → [(O2)2]* (эксимер кислорода) [(O2)2]* → 2O2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/144926/slide-43.jpg)









 Internal combustion engine
Internal combustion engine Воздействия на современные объекты ракетно-космической техники. Тепловые нагрузки
Воздействия на современные объекты ракетно-космической техники. Тепловые нагрузки Imitation of low voltage DC arc
Imitation of low voltage DC arc Трёхфазные цепи
Трёхфазные цепи Детекторы ионизирующих излучений. Введение
Детекторы ионизирующих излучений. Введение Презентация. Внутренняя энергия. 8 класс
Презентация. Внутренняя энергия. 8 класс Исследование характеристик ККЛ
Исследование характеристик ККЛ Методическое сообщение по теме Повышение познавательных интересов обучающихся на основе использования информационных технологий
Методическое сообщение по теме Повышение познавательных интересов обучающихся на основе использования информационных технологий Основные понятия и законы динамики
Основные понятия и законы динамики Презентация. Газовые законы
Презентация. Газовые законы Своя игра. Строения атома. (11 класс)
Своя игра. Строения атома. (11 класс) Магнитные свойства вещества
Магнитные свойства вещества Презентация к уроку по теме Теория Фотоэффекта
Презентация к уроку по теме Теория Фотоэффекта презентация Чудеса света
презентация Чудеса света Сучасна модель атома
Сучасна модель атома Контроль индивидуальных доз внешнего рентгеновского и гамма-излучения
Контроль индивидуальных доз внешнего рентгеновского и гамма-излучения Зубчатая передача
Зубчатая передача Физика в нашей жизни
Физика в нашей жизни Урок колебательный контур 11 класс.
Урок колебательный контур 11 класс. Получение компактных нанокристаллических материалов
Получение компактных нанокристаллических материалов Демонстрация возможности использования среды PowerPoint как интерактивной презентации
Демонстрация возможности использования среды PowerPoint как интерактивной презентации Особенности автомобилей AMT
Особенности автомобилей AMT Устройсво и техническое обслуживание двигателя легковых автомобилей
Устройсво и техническое обслуживание двигателя легковых автомобилей Виды спектров. Спектральный анализ
Виды спектров. Спектральный анализ Масса. Объем. Плотность
Масса. Объем. Плотность Смачивание и капиллярные явления. Урок 6. Физика. 8 класс
Смачивание и капиллярные явления. Урок 6. Физика. 8 класс викторина по физике
викторина по физике Оптика. Метод зон Френеля (лекция 3)
Оптика. Метод зон Френеля (лекция 3)