Содержание
- 3. Молекулярные эффекты и их спектральный диапазон
- 4. Физические основы молекулярнойспектроскопии Полная энергия Е молекулы может быть представлена как сумма отдельных её составляющих: Е
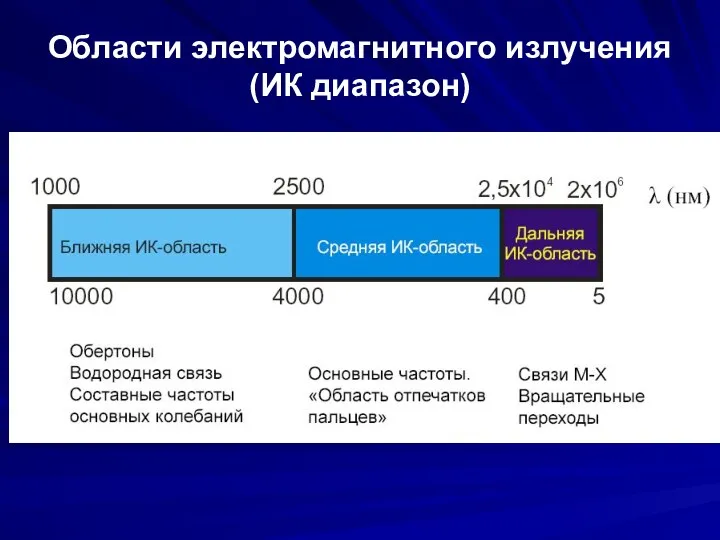
- 5. Области электромагнитного излучения (ИК диапазон)
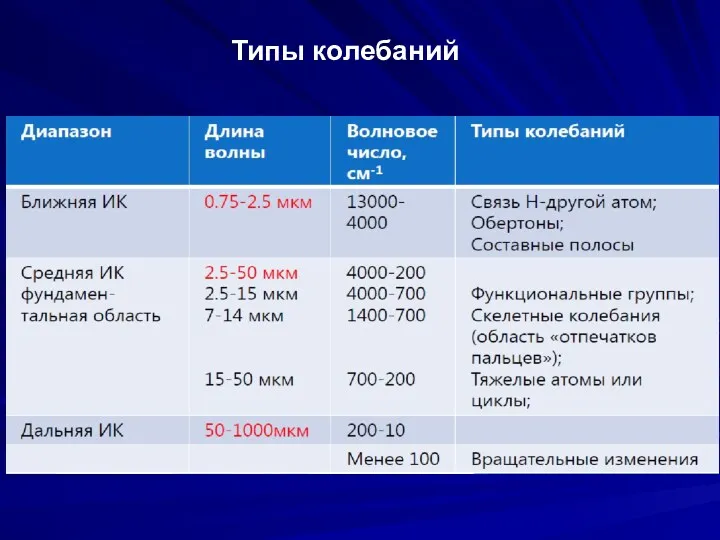
- 6. Типы колебаний
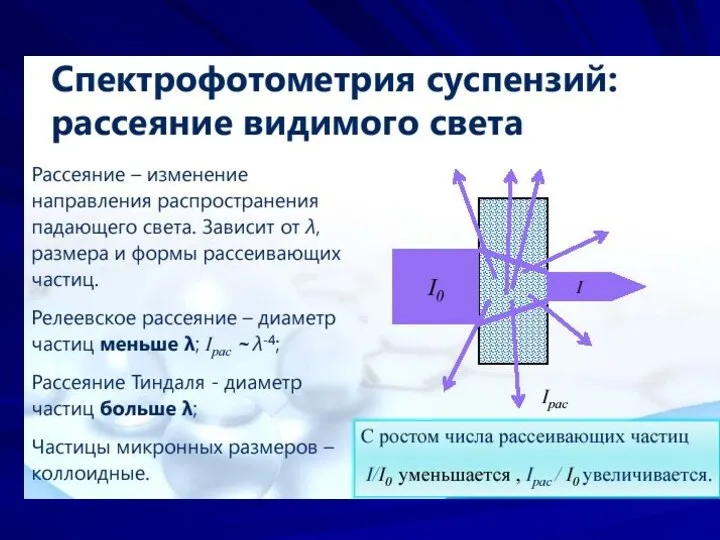
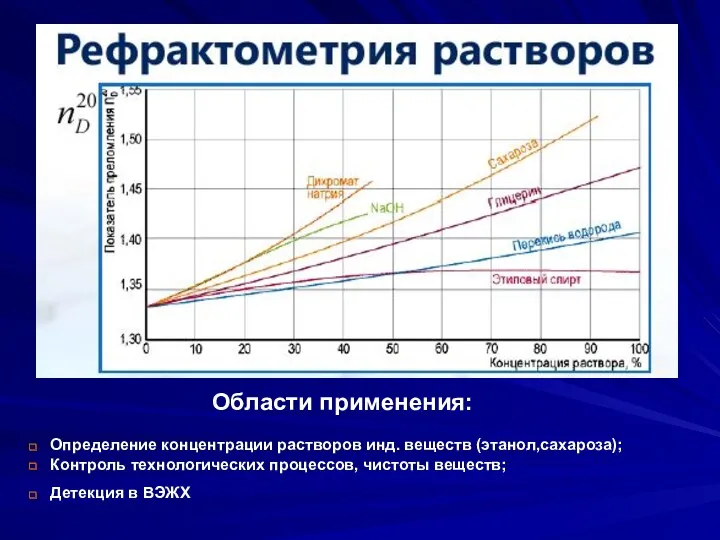
- 7. Оптические методы. Рефрактометрия. Спектрометрия диффузного отражения. Нефелометрия и турбидиметрия. Спектрофотометрия в ИК-области. Принцип метода. ИК-спектр. Особенности
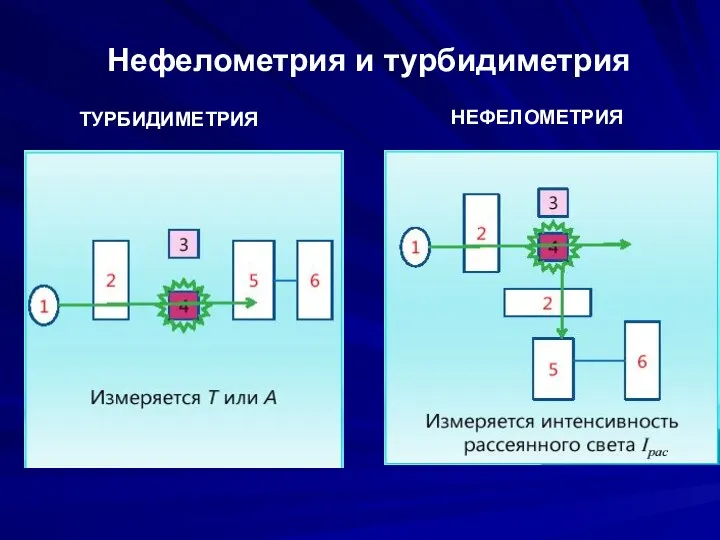
- 9. Нефелометрия и турбидиметрия НЕФЕЛОМЕТРИЯ ТУРБИДИМЕТРИЯ
- 13. Области применения: Определение концентрации растворов инд. веществ (этанол,сахароза); Контроль технологических процессов, чистоты веществ; Детекция в ВЭЖХ
- 14. Ручной рефрактометр для виноделия Диапазон определений Алкоголь: 0 — 25% Сахар ( Brix) : 0 —
- 17. 1800 г. – У. Гершель открыл инфракрасное излучение Инфракрасная (ИК) - спектроскопия
- 18. ИК-диапазон Ниже красного: видимая область Длины волн обычно 2500 -25000 нм Наиболее принятой единицей является волновое
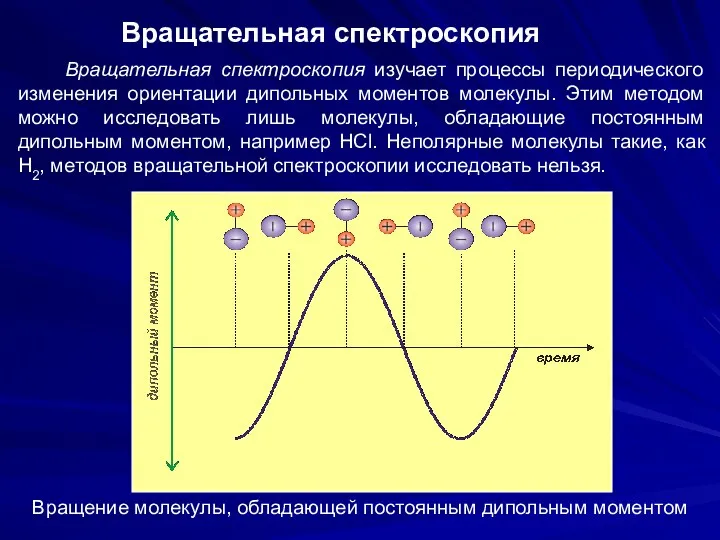
- 19. Вращательная спектроскопия Вращательная спектроскопия изучает процессы периодического изменения ориентации дипольных моментов молекулы. Этим методом можно исследовать
- 20. Кинетическая энергия вращательного движения : а) - где I момент инерции б) полная энергия Угловой момент
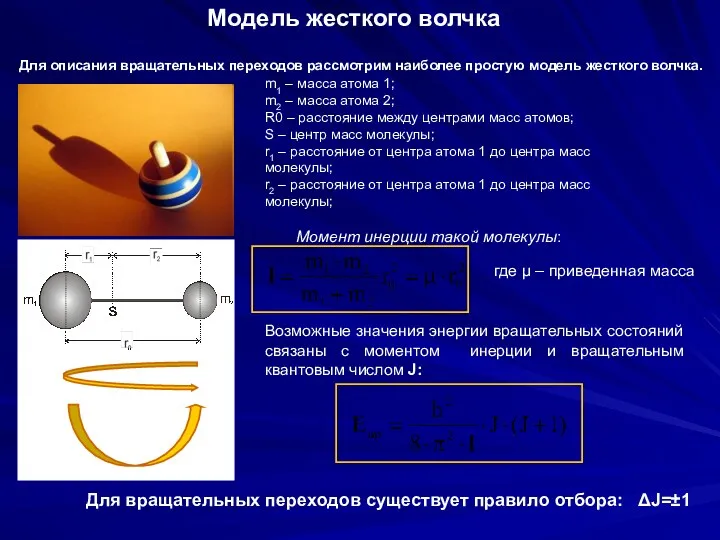
- 21. Модель жесткого волчка Для описания вращательных переходов рассмотрим наиболее простую модель жесткого волчка. m1 – масса
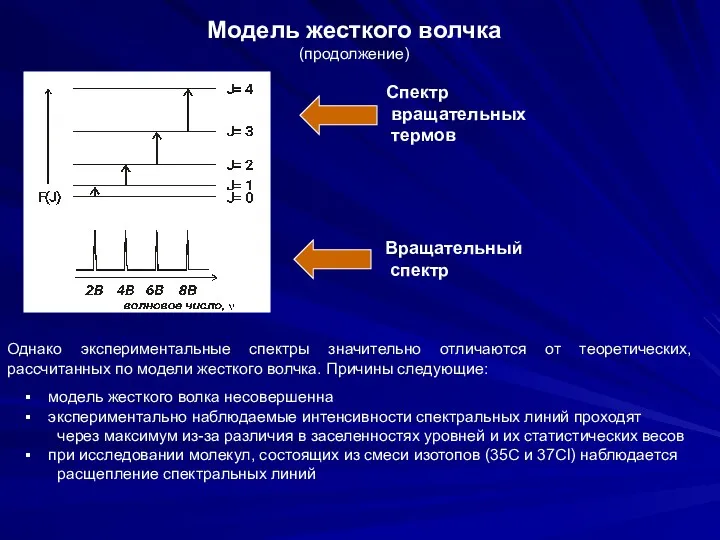
- 22. Модель жесткого волчка (продолжение) Вращательную энергию можно охарактеризовать при помощи вращательного терма F(J) – имеющего размерность
- 23. Модель жесткого волчка (продолжение) Спектр вращательных термов Вращательный спектр Однако экспериментальные спектры значительно отличаются от теоретических,
- 24. Колебательная спектроскопия Основная задача колебательной спектроскопии состоит в установлении связи между наблюдаемыми характеристическими спектрами молекулы, её
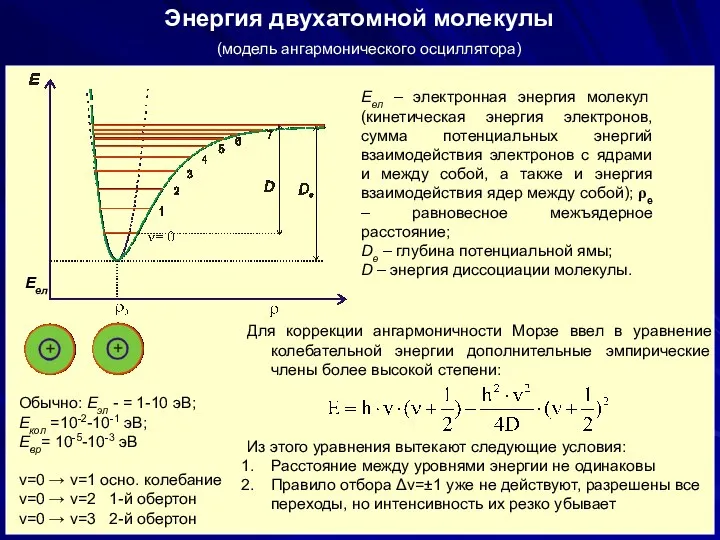
- 25. Eэл Энергия двухатомной молекулы (модель гармонического осциллятора) Согласно классической механике ЛГО совершает гармонические колебания с частотой:
- 26. Энергия двухатомной молекулы Еел – электронная энергия молекул (кинетическая энергия электронов, сумма потенциальных энергий взаимодействия электронов
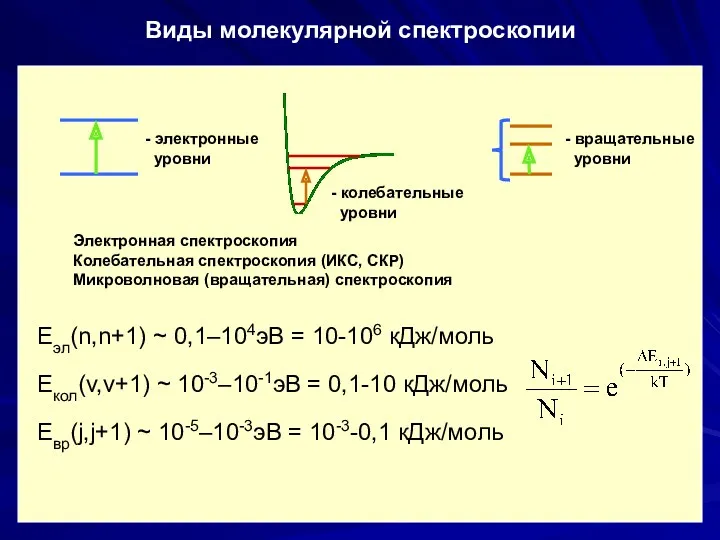
- 27. Виды молекулярной спектроскопии Электронная спектроскопия Колебательная спектроскопия (ИКС, СКР) Микроволновая (вращательная) спектроскопия Eэл(n,n+1) ~ 0,1–104эВ =
- 28. Виды колебаний в молекуле Колебательный спектр в многоатомной молекуле определяется независимыми колебаниями атомов в молекуле, называемых
- 29. Колебания многоатомных молекул С точки зрения формы колебаний различают : валентные колебания (обозначаемые как v ),
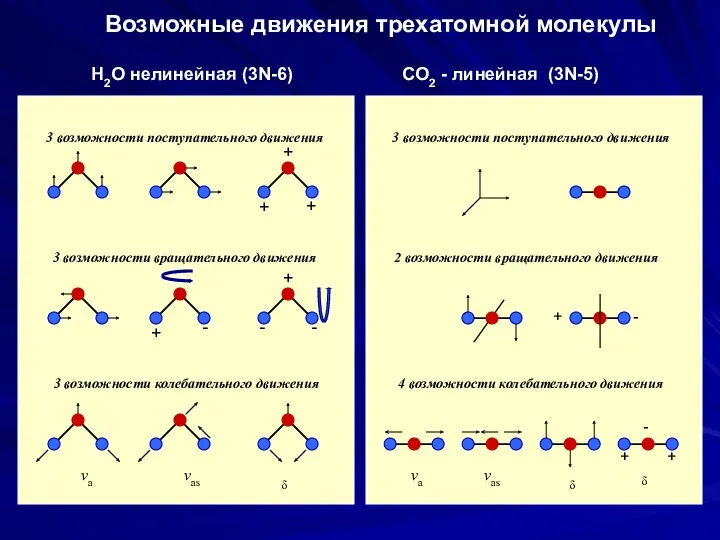
- 30. Возможные движения трехатомной молекулы Н2О нелинейная (3N-6) СО2 - линейная (3N-5) 3 возможности поступательного движения 3
- 32. Колебательно-вращательные спектры В соответствии с приближением Борна-Оппенгеймера энергетические термы колебательных и вращательных состояний суммируются, давая общий
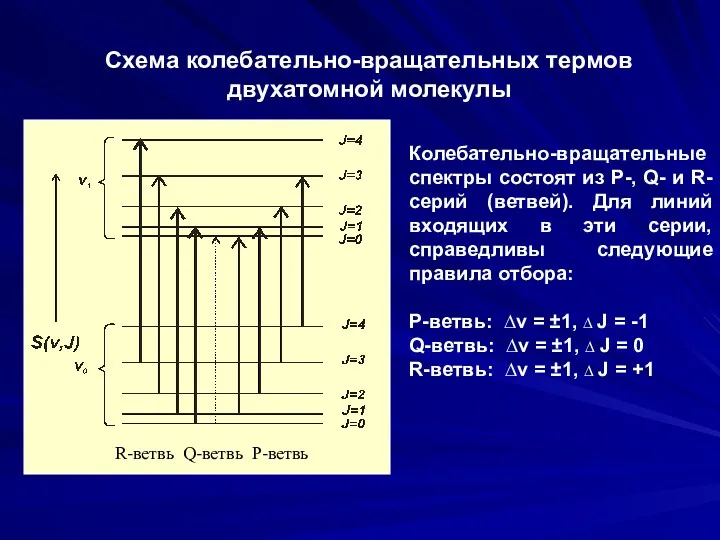
- 33. Схема колебательно-вращательных термов двухатомной молекулы Колебательно-вращательные спектры состоят из P-, Q- и R-серий (ветвей). Для линий
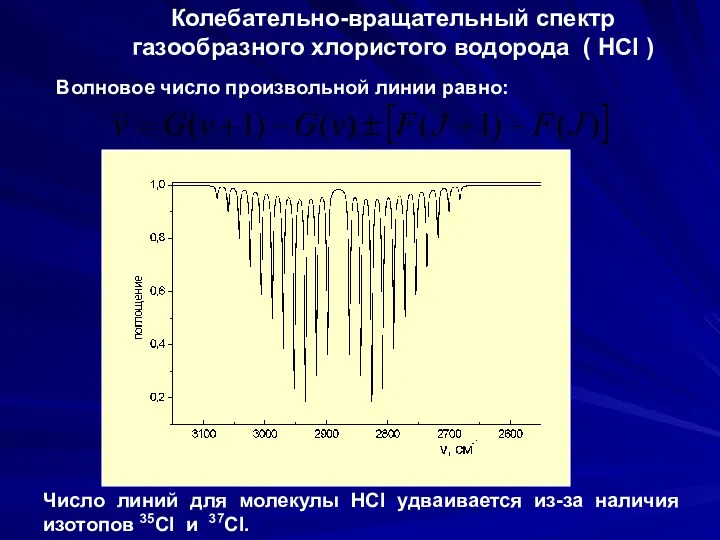
- 34. Колебательно-вращательный спектр газообразного хлористого водорода ( HCl ) Волновое число произвольной линии равно: Число линий для
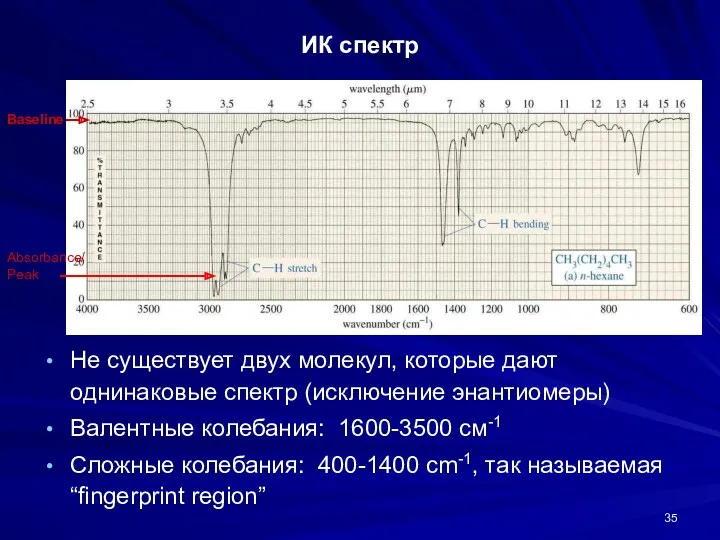
- 35. ИК спектр Не существует двух молекул, которые дают однинаковые спектр (исключение энантиомеры) Валентные колебания: 1600-3500 cм-1
- 36. Характеристические полосы колебаний некоторых групп
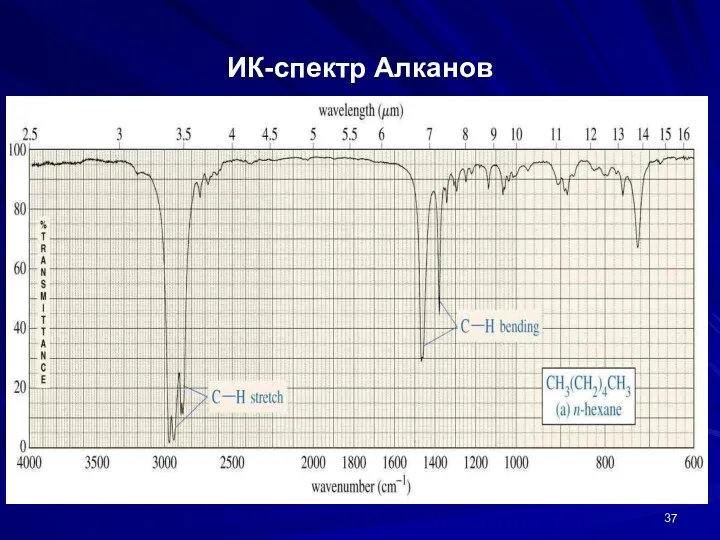
- 37. ИК-спектр Алканов
- 38. ИК-спектр Алкенов
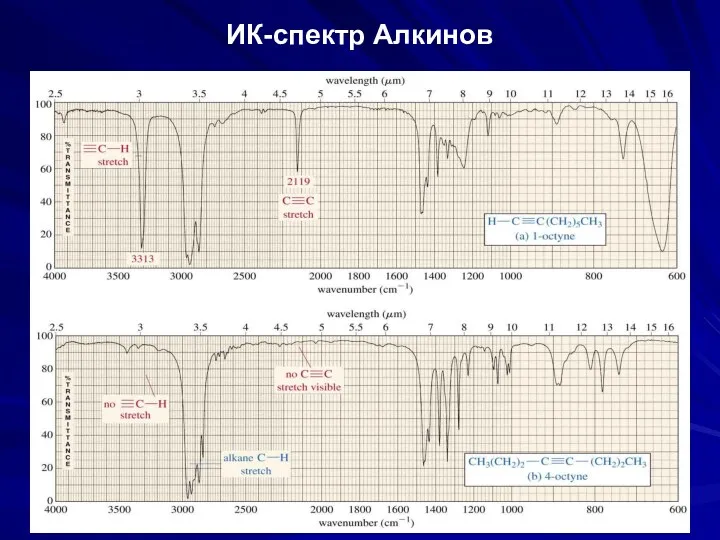
- 39. ИК-спектр Алкинов
- 40. ИК-спектр спиртов
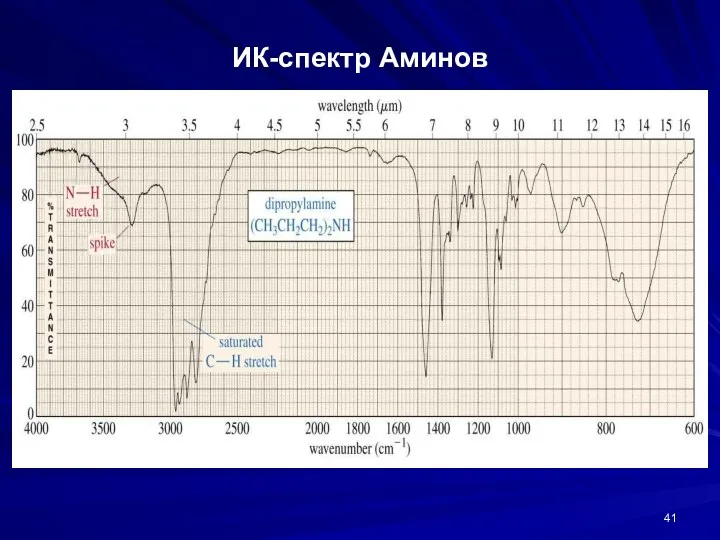
- 41. ИК-спектр Аминов
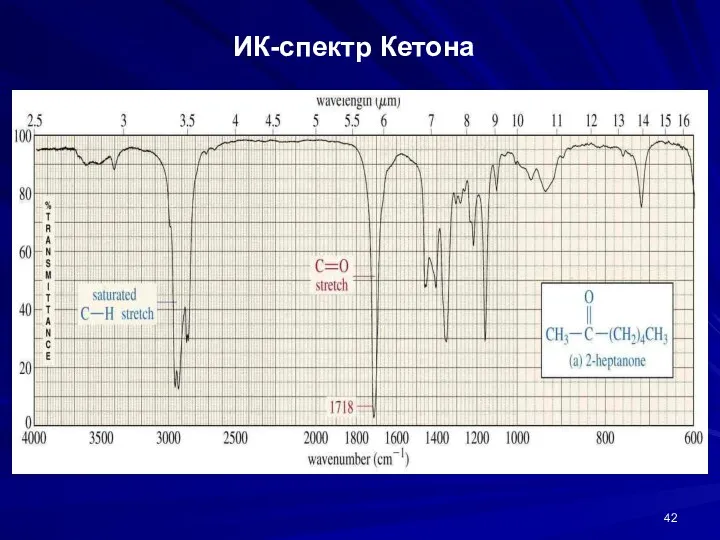
- 42. ИК-спектр Кетона
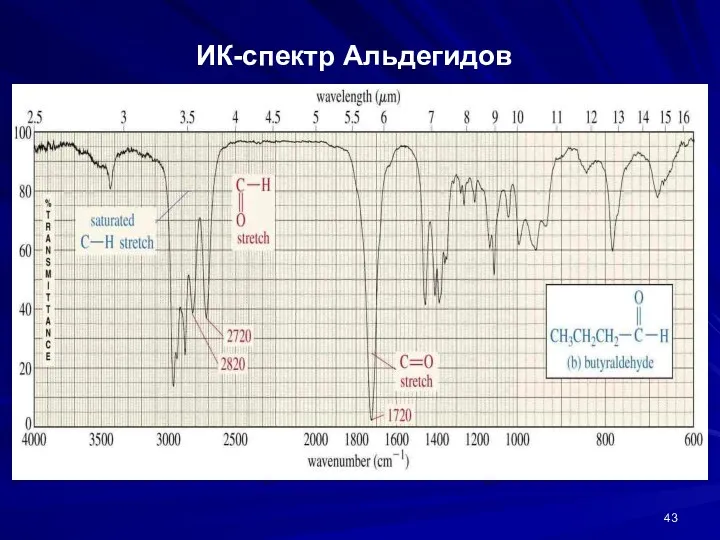
- 43. ИК-спектр Альдегидов
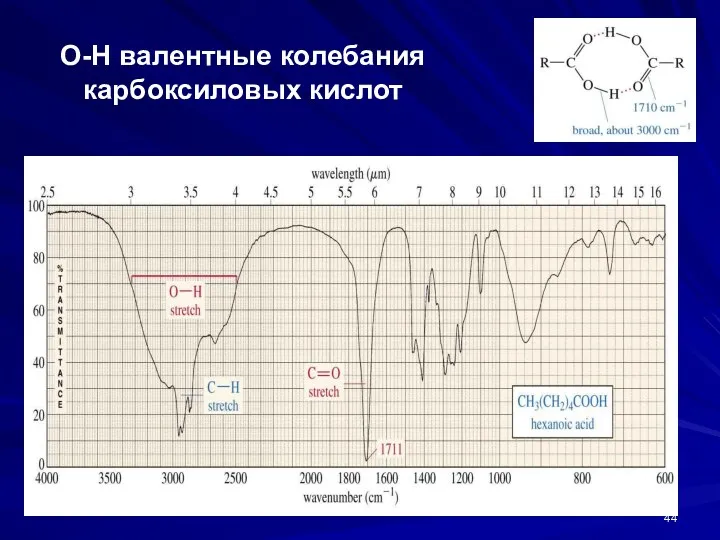
- 44. О-Н валентные колебания карбоксиловых кислот
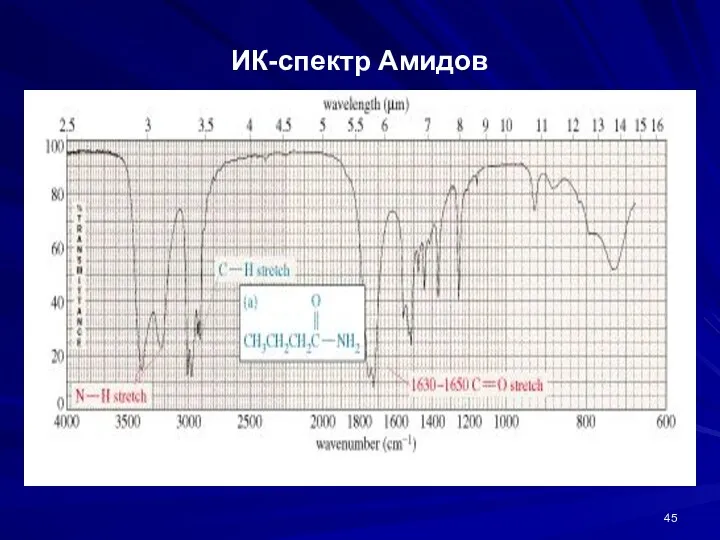
- 45. ИК-спектр Амидов
- 46. Углерод-азотные валентные колебания C - N поглощение в области 1200 cм-1 C = N поглощение в
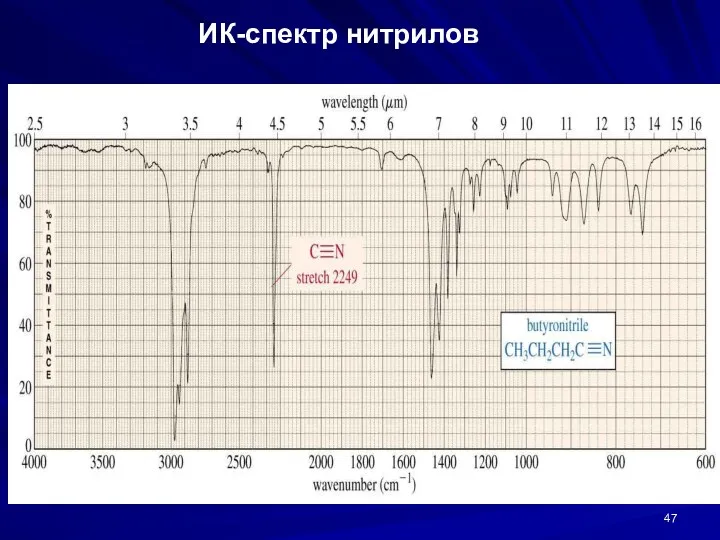
- 47. ИК-спектр нитрилов
- 49. Скачать презентацию
























 Тепловые явления. Дистанционный урок по физике в 10 классе
Тепловые явления. Дистанционный урок по физике в 10 классе Внеклассное мероприятие по физике Чернобыльская АЭС
Внеклассное мероприятие по физике Чернобыльская АЭС Фотоэффект. Уравнение Эйнштейна для фотоэффекта
Фотоэффект. Уравнение Эйнштейна для фотоэффекта Организация мониторинга показателей качества электрической энергии
Организация мониторинга показателей качества электрической энергии Электрический ток. 10 класс
Электрический ток. 10 класс Спектроскопические методы анализа. Атомная спектроскопия
Спектроскопические методы анализа. Атомная спектроскопия Техническая термодинамика и теплопередача
Техническая термодинамика и теплопередача Презентация к уроку физики по теме Электрические явления
Презентация к уроку физики по теме Электрические явления Сила трения
Сила трения Простейшие движения твердого тела
Простейшие движения твердого тела Обозначение физической величины
Обозначение физической величины Ядерный реактор
Ядерный реактор Работа по перемещению проводника с током в магнитном поле
Работа по перемещению проводника с током в магнитном поле Рентгенофазовый анализ
Рентгенофазовый анализ Ход лучей в линзах и сферических зеркалах
Ход лучей в линзах и сферических зеркалах Разработка цифрового устройства для измерения технологических переменных электролизной лабораторной установки
Разработка цифрового устройства для измерения технологических переменных электролизной лабораторной установки Понятия синергетических систем
Понятия синергетических систем Лекция 8. Магнитоэлектрические приборы
Лекция 8. Магнитоэлектрические приборы Техническое обслуживание и ремонт сцепления автомобиля ВАЗ 2107
Техническое обслуживание и ремонт сцепления автомобиля ВАЗ 2107 Общие вопросы неразрушающего контроля
Общие вопросы неразрушающего контроля Детали машин и основы конструирования. Общие сведения. (Раздел 1)
Детали машин и основы конструирования. Общие сведения. (Раздел 1) Механическая работа. Мощность
Механическая работа. Мощность Ультрафіолетові промені
Ультрафіолетові промені Презентация к уроку: Удивительный мир кристаллов
Презентация к уроку: Удивительный мир кристаллов конспект урока физики в 7 классе Давление. Способы уменьшения и увеличения давления
конспект урока физики в 7 классе Давление. Способы уменьшения и увеличения давления Расчёт ферм
Расчёт ферм Вес тела. Единицы силы. Связь между силой тяжести и массой тела. 7 класс
Вес тела. Единицы силы. Связь между силой тяжести и массой тела. 7 класс Introduction & overview
Introduction & overview