Содержание
- 2. История Первый прибор типа микроскопа был построен около 1590 г. Нидерландскими мастерами братьями Янсенами. С 1610
- 3. Что такое свет? Light is electromagnetic radiation. What we usually describe as light is only the
- 4. Видимая область спектра
- 6. Большинство клеток имеет диаметр от 1 до 100 мкм в диаметре, их можно наблюдать в световой
- 7. Imaging Techniques
- 8. Световая микроскопия светлопольная микроскопия, которую чаше всего называют просто микроскопия; темнопольная микроскопия; - фазово-контрастная микроскопия в
- 9. Светлопольная микроскопия При светлопольной микроскопии или микроскопии в светлом поле изображение формируется под воздействием прямого светового
- 10. Темнопольная микроскопия Микроскопия в темном поле зрения основана на следующем принципе - лучи освещают объект не
- 11. Фазово-контрастная микроскопия При прохождении пучка света через неокрашенный объект изменяется лишь фаза колебания световой волны, что
- 12. Фазово-контрастная микроскопия значительно повышает контрастность объекта и используется для изучения нативных препаратов.
- 13. Флуоресцентная микроскопия
- 14. Флуоресцентная микроскопия Люминесцентная микроскопия основана на способности некоторых веществ под влиянием падающего на них света испускать
- 15. Bandpass emission filter Longpass emission filter
- 17. Green Fluorescent Protein (GFP) Class of proteins that naturally fluoresce First isolated from the jellyfish 238
- 18. Электронная микроскопия Возможности оптических микроскопов ограничены слишком большой длиной волны видимого света (6000 А). Объекты, размеры
- 19. Intro to Electron Microscopy Similar to optical microscopy except with electrons rather than photons Used to
- 20. Некоторые модели электронного микроскопа
- 21. Пропускающая и сканирующая электронная микроскопия (TEM и SEM) Transmission Electron Microscope Phase contrast Image is formed
- 22. Negative Staining Biological samples are often imaged using negative staining The elements of biological molecules do
- 23. Размер бактериофага Т7 – примерно, 100 нм Размер кишечной палочки (Escherichia coli, E. сoli) – 0,4—0,8
- 24. Флуоресцентная и трансмиссионная электронная микроскопия гомоцистеинилированного κ-казеина Флуоресцентная (А) и электронная (Б-Е) микроскопия гомоцистеинилированного κ-казеина после
- 25. Immunochemical Applications It is very easy to image gold clusters with EM due to gold’s properties
- 26. Cryo-Microscopy Samples are often frozen in order to preserve the structure against radiation damage from the
- 27. Конфокальная микроскопия Конфокальная микроскопия – это один из методов оптической микроскопии, который обладает существенным контрастом по
- 28. Конфокальная микроскопия возможность получать трехмерное субмикронное расширение объектов, а также значительно расширилась возможность проведения неразрушающего анализа
- 29. Compatible Lasers, Wavelengths, and Dyes
- 30. Микрофотография мышиного эмбриона возрастом около десяти с половиной дней после оплодотворения. Эмбрион окрашен флуоресцентным маркером, выявляющим
- 31. Атомно-силовая микроскопия Оптическая система измеряет отклонения зонда, сканирующего поверхность Между атомами зонда и образца действуют силы
- 32. Потенциальная энергия взаимодействия атомов Отталкивание атомов Притяжение атомов Атомно – силовой микроскоп
- 33. Зонд атомно – силового микроскопа из углеродных нанотрубок
- 34. Дендример 4 поколения способен к самоорганизации в плоские нанопленки при нагревании с белками Прионный белок 65°С
- 35. Структура поверхности (по данным АСМ) Альфа-лактальбумин Каппа-казеин
- 36. Определение толщины пленки с помощью АСМ
- 37. Суперфлуоресцентная микроскопия сверхвысокого разрешения Нобелевская премия по химии присуждена за суперфлуоресцентную микроскопию сверхвысокого разрешения Нобелевская премия
- 38. Суперфлуоресцентная микроскопия сверхвысокого разрешения W. Moerner впервые в мире смог детектировать отдельную флуоресцирующую молекулу. Это было
- 39. PALM (~10–55 nm) Photoactivated localization microscopy incorporates into a sample special fluorescent proteins that can be
- 40. STORM (~20–55 nm) Stochastic optical reconstruction microscopy, developed around the same time as PALM, also relies
- 41. Stefan Hell. Разработанный им метод—STimulated Emission Depletion (STED) microscopy — имеет принципиальные отличия. При использовании STED
- 43. Скачать презентацию
 Второй закон Ньютона
Второй закон Ньютона Закон Архимеда
Закон Архимеда Процесс сборки-сварки корпуса емкости дистиллятора Е-201
Процесс сборки-сварки корпуса емкости дистиллятора Е-201 Техническая эксплуатация машинно-транспортного парка
Техническая эксплуатация машинно-транспортного парка Введение в тепловое моделирование
Введение в тепловое моделирование Защита от грозовых и коммутационных перенапряжений
Защита от грозовых и коммутационных перенапряжений Тесты по физике. Темы: Работа. Мощность. Энергия
Тесты по физике. Темы: Работа. Мощность. Энергия Дисперсия и поляризация света. Лекция №6
Дисперсия и поляризация света. Лекция №6 Основы теории индукционного нагрева
Основы теории индукционного нагрева Презентация к уроку физики в 10 классе по теме: Теплота парообразования. Сжижение газов. Влажность воздуха
Презентация к уроку физики в 10 классе по теме: Теплота парообразования. Сжижение газов. Влажность воздуха 20230402_11kl_dop_shutki_s_osterom
20230402_11kl_dop_shutki_s_osterom Силы в природе. Гравитационные силы
Силы в природе. Гравитационные силы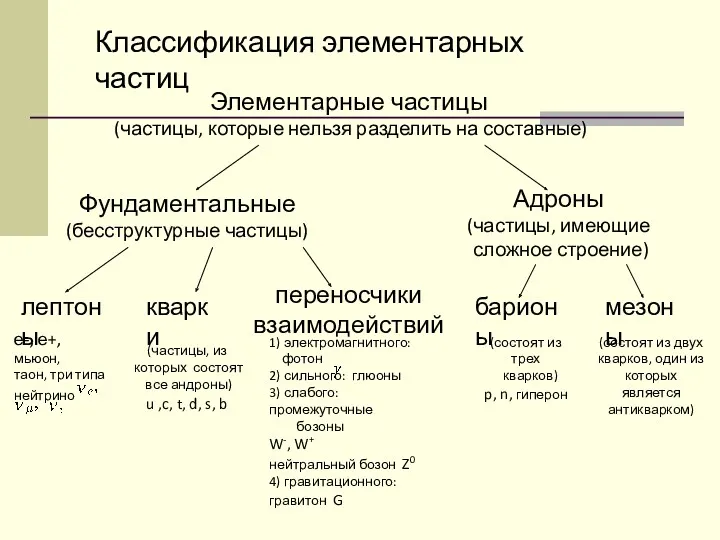 конспект урока по теме Мир элементарных частиц
конспект урока по теме Мир элементарных частиц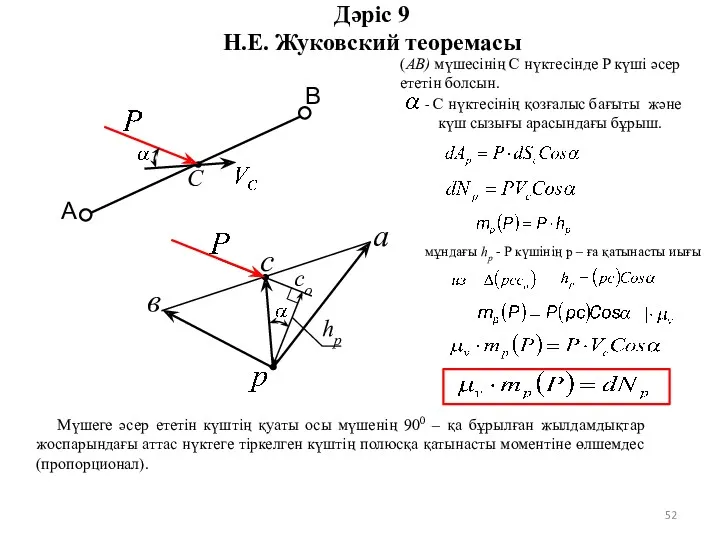 Н.Е. Жуковский теоремасы
Н.Е. Жуковский теоремасы Коливальні рухи. Гармонічні коливання
Коливальні рухи. Гармонічні коливання Урок по физике в 7классе на тему Плотность вещества. Решение задач
Урок по физике в 7классе на тему Плотность вещества. Решение задач Закон сохранения импульса и механической энергии. Решение задач
Закон сохранения импульса и механической энергии. Решение задач Механические свойства твёрдых тел. Кристаллические и аморфные тела
Механические свойства твёрдых тел. Кристаллические и аморфные тела Ходовые части пассажирских вагонов
Ходовые части пассажирских вагонов Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) Параметри електричних ланцюгів змінного струму
Параметри електричних ланцюгів змінного струму Электрические тали
Электрические тали Полюс повороту
Полюс повороту Электрический ток. 10 класс
Электрический ток. 10 класс Давление в газах и жидкостях. Опыты
Давление в газах и жидкостях. Опыты Олимпиадная физика
Олимпиадная физика Военно-специальная подготовка
Военно-специальная подготовка Урок-презентация Внутреннее строение звезд
Урок-презентация Внутреннее строение звезд