Содержание
- 2. Молекулярна фізика вивчає будову речовини, виходячи з молекулярно-кінетичної теорії. Властивості речовини, що експериментально спостерігаються (такі як
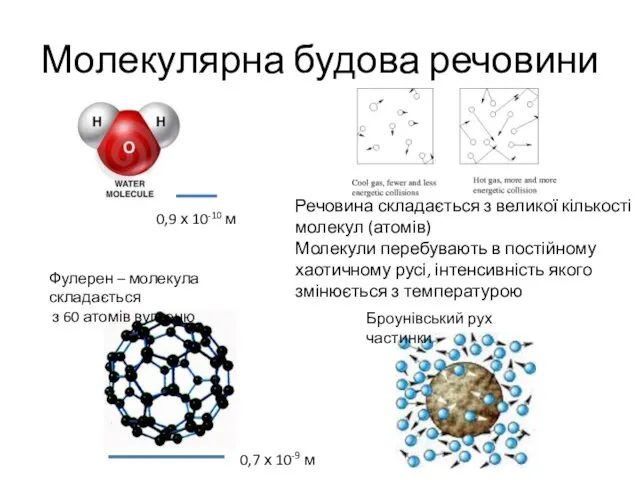
- 3. Молекулярна будова речовини Броунівський рух частинки Фулерен – молекула складається з 60 атомів вуглецю 0,7 х
- 4. Основні поняття молекулярно-кінетичної теорії Атомна (молекулярна) маса [μ]=а.о.м. (1 а.о.м. визначається як 1/12 маси атома карбону)
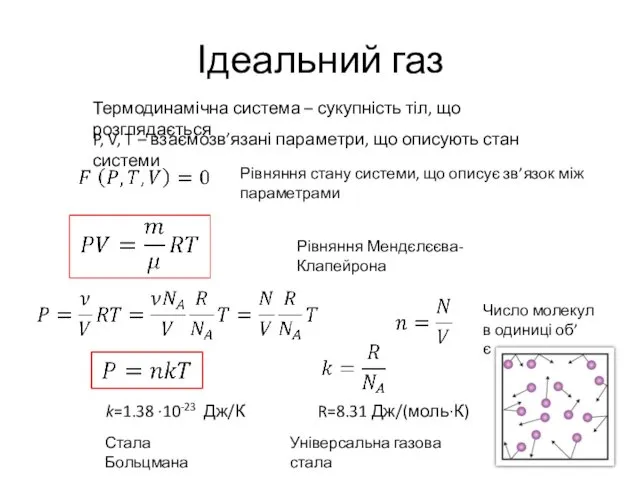
- 5. Ідеальний газ P, V, T – взаємозв’язані параметри, що описують стан системи k=1.38 ∙10-23 Дж/К R=8.31
- 6. Тиск газу L L Для однієї молекули Для N молекул Середній квадрат швидкості Середньоквадратична швидкість
- 7. Енергія і швидкості молекул Середньоквадратична швидкість Найбільш вірогідна швидкість Середня арифметична швидкість Температура є мірою кінетичної
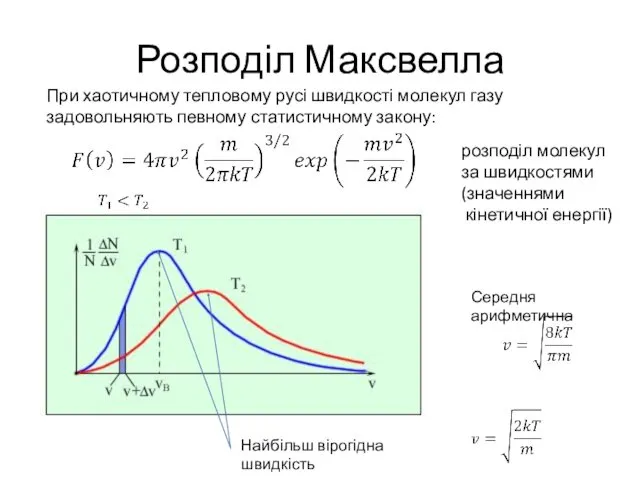
- 8. Розподіл Максвелла Найбільш вірогідна швидкість Середня арифметична При хаотичному тепловому русі швидкості молекул газу задовольняють певному
- 9. Розподіл Больцмана Барометрична формула Розподіл Больцмана – розподіл молекул за значеннями потенціальної енергії
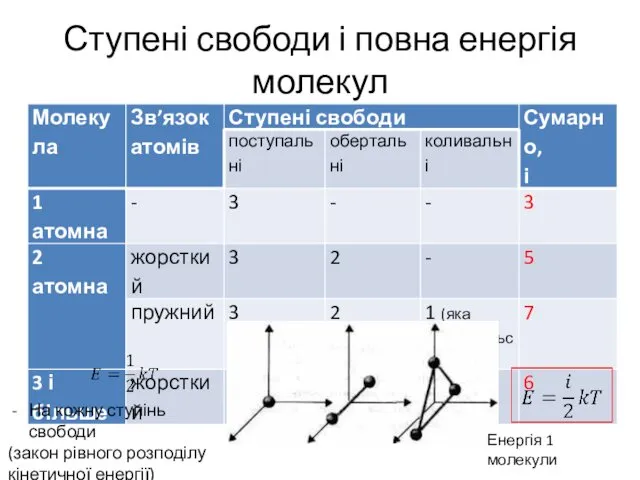
- 10. Ступені свободи - для поступального руху молекули Крім того, можливий обертальний і коливальний рух молекули, що
- 11. Ступені свободи і повна енергія молекул На кожну ступінь свободи (закон рівного розподілу кінетичної енергії) Енергія
- 12. Термодинамічні системи Параметри стану: Т, Р, V Рівноважний і нерівноважний стан
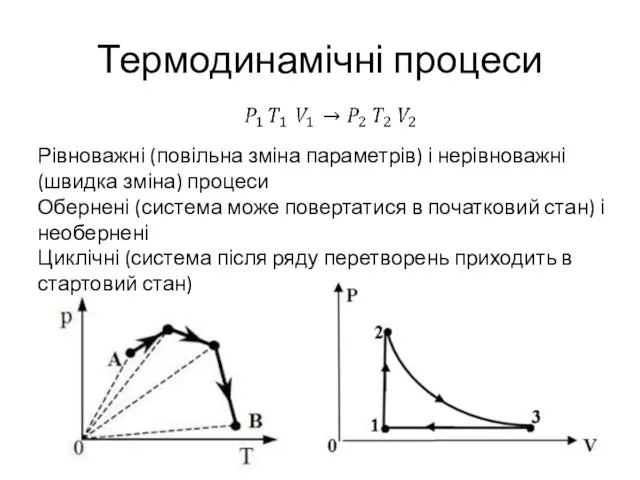
- 13. Термодинамічні процеси Рівноважні (повільна зміна параметрів) і нерівноважні (швидка зміна) процеси Обернені (система може повертатися в
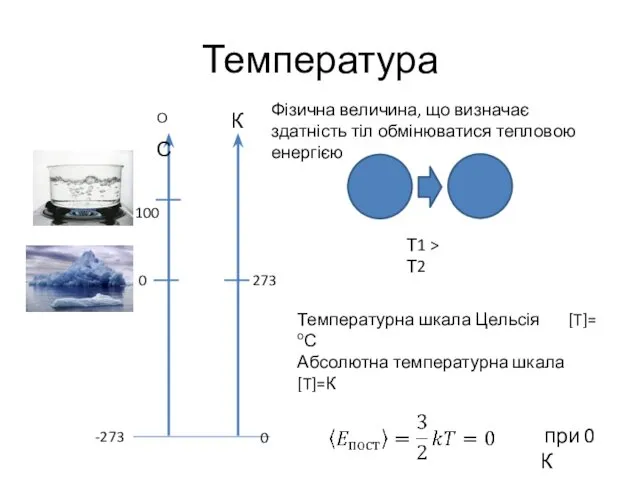
- 14. Температура О С 100 0 -273 273 0 К Фізична величина, що визначає здатність тіл обмінюватися
- 15. Внутрішня енергія системи Швидкість V Внутрішня енергія системи включає: Кінетичну енергію теплового хаотичного руху молекул, Потенціальну
- 16. Перший початок термодинаміки Зміна внутрішньої енергії системи: - При отриманні або віддачі енергії (у вигляді тепла)
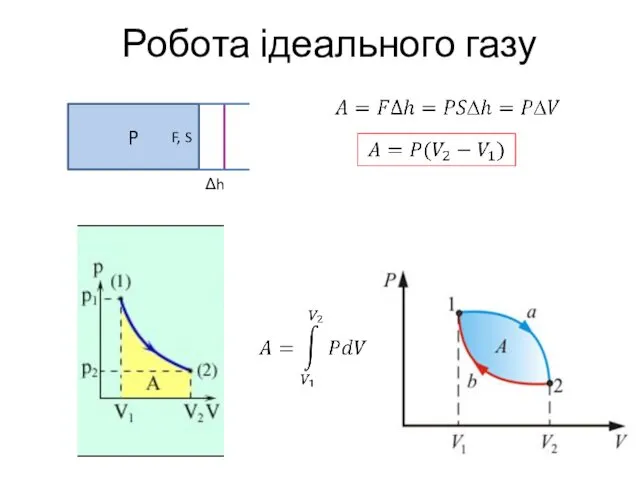
- 17. Робота ідеального газу
- 18. Теплоємність [C]=Дж/К Молярна теплоємність при постійному тиску Молярна теплоємність при постійному об’єму [C]=Дж/(моль К) - молярна
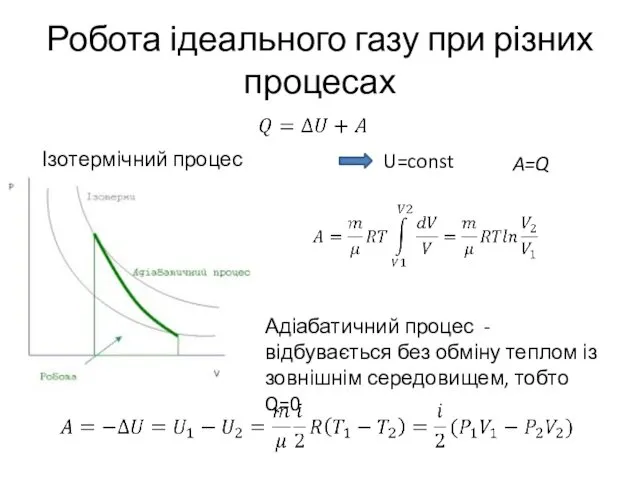
- 19. Робота ідеального газу при різних процесах Ізохоричний процес V=const Ізобаричний процес Р=const A=0
- 20. Робота ідеального газу при різних процесах Ізотермічний процес Т=const U=const A=Q Адіабатичний процес - відбувається без
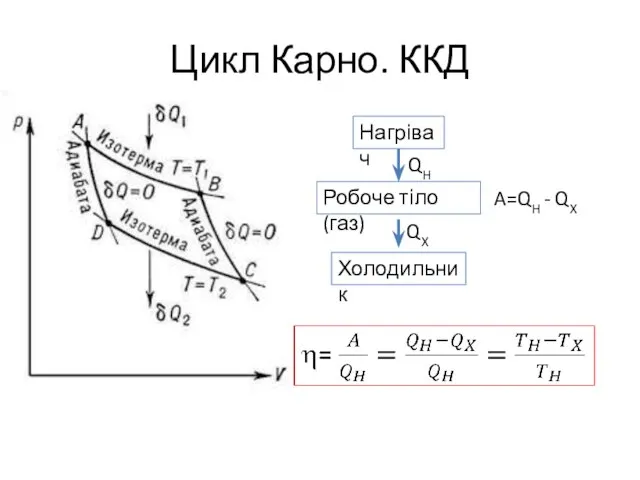
- 21. Цикл Карно. ККД QH A=QH - QX QX
- 22. Рівняння Пуассона Рівняння Пуассона (описує адіабатичний процес, визначає зв’язок параметрів стану P i V) - Адіабатичний
- 23. Стан макроскопічної системи (тіла) Макростани – задаються інтегральними параметрами (P, V, T, U) Мікростани – стан
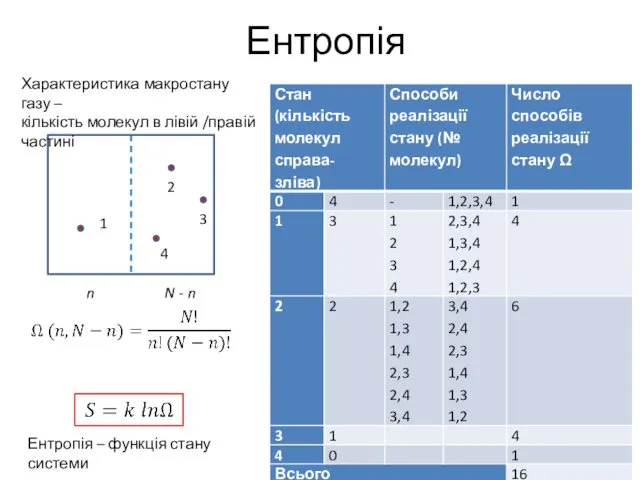
- 24. Ентропія n N - n Характеристика макростану газу – кількість молекул в лівій /правій частині Ентропія
- 25. Ентропія. Другий початок термодинаміки зворотні процеси Незворотні процеси При абсолютному нулі Т=0 Ω=1 Теорема Нернста (3-й
- 26. Принцип мінімуму енергії (при T=const, зворотні процеси) Вільна енергія – та частина повної енергії, що може
- 27. Кристалічна будова твердих тіл Іонні кристали (іонний зв’язок) – NaCl, CaF Атомні кристали (ковалентний зв’язок) –
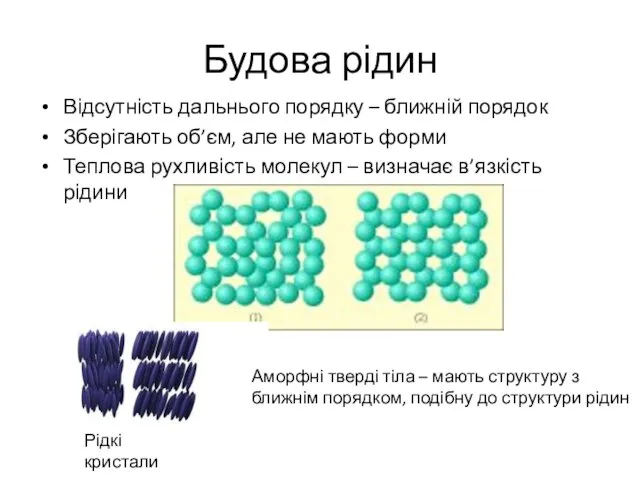
- 28. Будова рідин Відсутність дальнього порядку – ближній порядок Зберігають об’єм, але не мають форми Теплова рухливість
- 30. Скачать презентацию

![Основні поняття молекулярно-кінетичної теорії Атомна (молекулярна) маса [μ]=а.о.м. (1 а.о.м.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/17476/slide-3.jpg)







![Теплоємність [C]=Дж/К Молярна теплоємність при постійному тиску Молярна теплоємність при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/17476/slide-17.jpg)






 Нанотехнологии и физика
Нанотехнологии и физика Червячные передачи
Червячные передачи История изобретения паровых машин
История изобретения паровых машин Дифракционная теория изображений
Дифракционная теория изображений Решение задач по волновой и геометрической оптике
Решение задач по волновой и геометрической оптике Внеклассные мероприятия по физике.
Внеклассные мероприятия по физике. Medbiophysics as a branch of applied physics. Mechanical vibrations in the medical applications
Medbiophysics as a branch of applied physics. Mechanical vibrations in the medical applications Голография. История голографии
Голография. История голографии Стабилитроны
Стабилитроны Будова і технічне обслуговування транспортного засобу
Будова і технічне обслуговування транспортного засобу Replacement of controller (Decos Ⅲc)
Replacement of controller (Decos Ⅲc) Элементы машиноведения. Составные части машин
Элементы машиноведения. Составные части машин Виды контроля коррозии
Виды контроля коррозии Сила Лоренца. Второй закон Ньютона. Напряженность электрического поля
Сила Лоренца. Второй закон Ньютона. Напряженность электрического поля Своя игра по физике
Своя игра по физике Агрегатные состояния вещества
Агрегатные состояния вещества экологическое воспитание на уроках физики
экологическое воспитание на уроках физики Сила упругости. Закон Гука. 7 класс
Сила упругости. Закон Гука. 7 класс Werkstoffkunde
Werkstoffkunde Трение в живой природе
Трение в живой природе Особенности распространения радиоволн коротковолнового диапазона
Особенности распространения радиоволн коротковолнового диапазона Викторина ко дню космонавтики.
Викторина ко дню космонавтики. Шкала электромагнитных излучений
Шкала электромагнитных излучений Трансформаторы. Виды трансформаторов
Трансформаторы. Виды трансформаторов Последовательное соединение проводников
Последовательное соединение проводников Определение шума и вибрации
Определение шума и вибрации Кинематика точки
Кинематика точки Лекция 1-01 (2024)
Лекция 1-01 (2024)