Содержание
- 3. Точки пересечения прямых Е-lg и E-lg для каждой из двух ОВР (5) и (6) дают значения
- 4. В реальном коррозионном биэлектроде ( М в растворе, содержащем Мn+ , Ох и R) рЕМn+/М и
- 5. C учетом (8) и (9) переходит в (12), j ≡ipM. j ≡ipM = iвR (12) Если
- 6. Если условия (12) и (13) не соблюдаются, потенциал под током не стационарен. Кривые E-lg iк и
- 7. В ы х о д п о т о к у В ы х о д
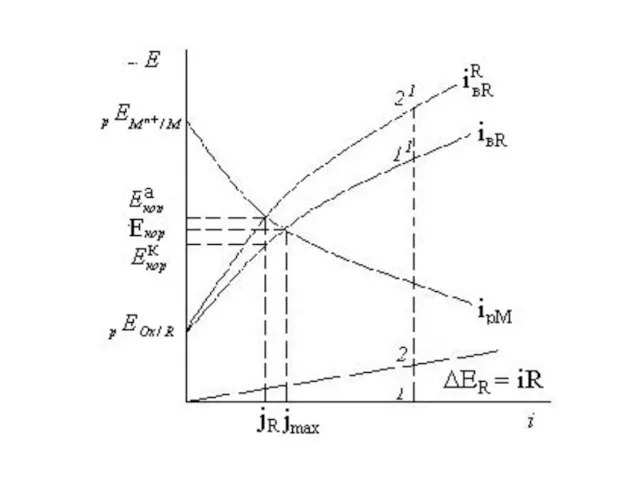
- 8. Если между катодным и анодным участками существует омическое падение напряжения. Графически уравнение закона Ома описывается прямой
- 9. пересечения дает один Екор и максимальную скорость коррозии jмах. Для учета омического фактора следует перестроить одну
- 11. Виды контроля коррозии При стационарном Екор растворение металла и катодная деполяризация являются сопряженными реакциями, изменение скорости
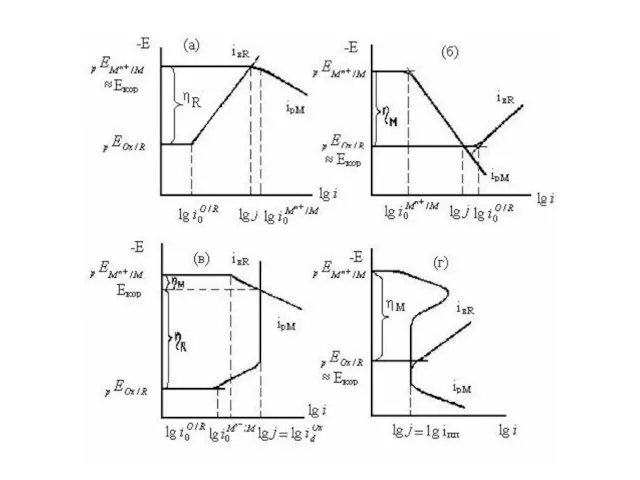
- 13. Рис. а,б иллюстрируют роль i0. Если , процесс протекает с катодным контролем (рис. а) и изменение
- 14. На рис. в,г показана роль крутизны поляризационных кривых. При bк ≈ ∞, что имеет место в
- 15. Сложные коррозионные системы Короткозамкнутая система ( R≈0), у которой поверхность всех металлов, находящихся в электрическом контакте,
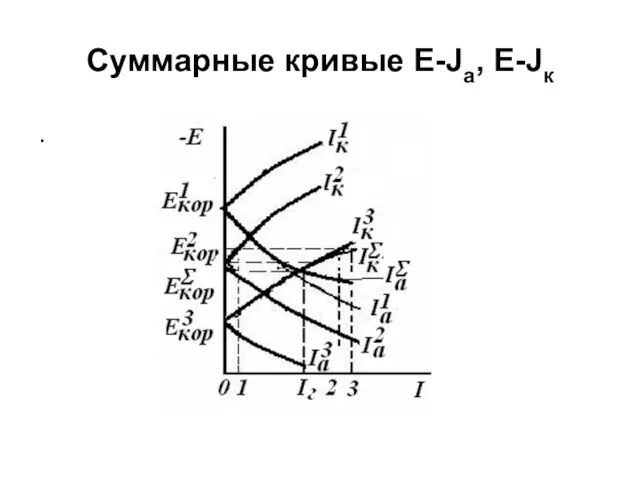
- 16. Суммарные кривые E-Ja, E-Jк .
- 17. Кривая ( ) (при заданном Е) начинается от и до совпадает с кривой т.к. при этих
- 18. при М1 и М2 являются анодами, причем > , а М3 – катод. При этом |
- 19. Используя J вместо i , получаем JpM = Jа + JвR () JвR = Jк +
- 20. Парциальные кривые
- 21. Эти кривые идут от равновесного потенциала, а не от Екор. Аналогично проводится суммирование. Кривая начинается от
- 23. Скачать презентацию
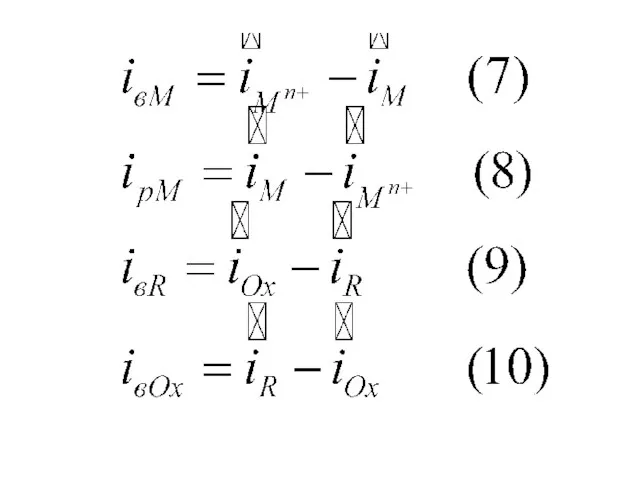
















 Первый закон термодинамики
Первый закон термодинамики Повітряний транспорт
Повітряний транспорт Солнечные источники энергии. Солнечные батареи
Солнечные источники энергии. Солнечные батареи Теория деформаций. Лекция 4
Теория деформаций. Лекция 4 Термодинамика. Законы термодинамики
Термодинамика. Законы термодинамики Сопротивление. Закон Ома
Сопротивление. Закон Ома Техническая эксплуатация машинно-транспортного парка
Техническая эксплуатация машинно-транспортного парка Катушка Теслы
Катушка Теслы Посвящение в юные физики
Посвящение в юные физики Техническое обслуживание и диагностирование неисправностей сельскохозяйственных машин, ремонт отдельных деталей и узлов
Техническое обслуживание и диагностирование неисправностей сельскохозяйственных машин, ремонт отдельных деталей и узлов Источники звука. Звуковые волны. 9 класс
Источники звука. Звуковые волны. 9 класс Инструментальные методы исследования органических веществ. Лекция 11
Инструментальные методы исследования органических веществ. Лекция 11 Транспортная энергетика. Лекция 5. Термодинамика газового потока
Транспортная энергетика. Лекция 5. Термодинамика газового потока Законы Ньютона. 10 класс
Законы Ньютона. 10 класс Механическая работа
Механическая работа Решение краевых задач для уравнения теплопроводности
Решение краевых задач для уравнения теплопроводности Композитные материалы
Композитные материалы Методы разделения и концентрирования. Хроматография
Методы разделения и концентрирования. Хроматография Потенциал. Решение задач
Потенциал. Решение задач Детали машин и основы конструирования. Цепные передачи. (Лекция 6)
Детали машин и основы конструирования. Цепные передачи. (Лекция 6) Статистические и термодинамические свойства макросистем
Статистические и термодинамические свойства макросистем Расчет гармонических колебаний в электрических цепях
Расчет гармонических колебаний в электрических цепях Презентация Спектры (качественные задачи по теме Излучения и спектры)
Презентация Спектры (качественные задачи по теме Излучения и спектры) Презентация по физике Механические колебания
Презентация по физике Механические колебания Лекция 1-01 (2024)
Лекция 1-01 (2024) BRAIN-RING ФИЗИКИ
BRAIN-RING ФИЗИКИ Определение мощности. Лабораторная работа
Определение мощности. Лабораторная работа Энергия
Энергия