Содержание
- 2. Внутренняя энергия определяется суммой кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул,
- 3. Кинетическая энергия частиц определяется температурой тела. Меняется только при изменении температуры Потенциальная энергия – определяется взаимным
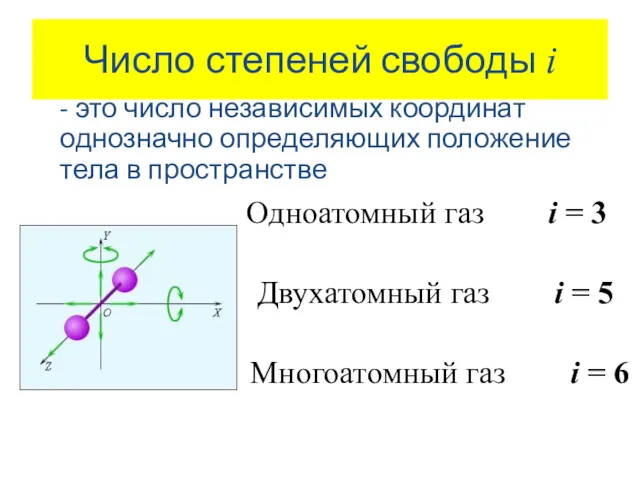
- 4. Число степеней свободы i - это число независимых координат однозначно определяющих положение тела в пространстве Одноатомный
- 5. Внутренняя энергия идеального газа определяется только кинетической энергией движения молекул Для одноатомного идеального газа:
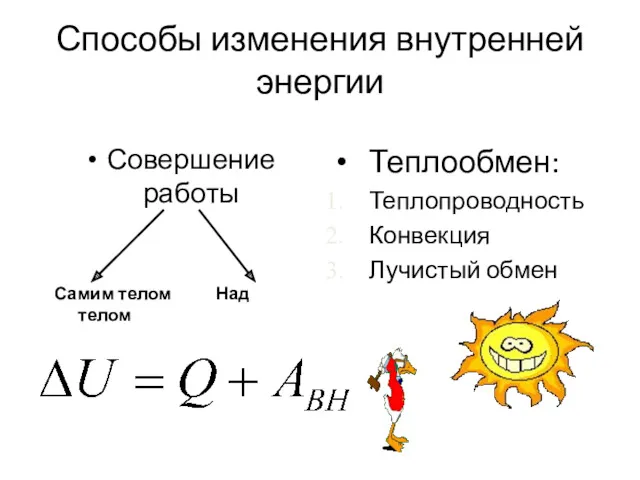
- 6. Способы изменения внутренней энергии Совершение работы Самим телом Над телом Теплообмен: Теплопроводность Конвекция Лучистый обмен
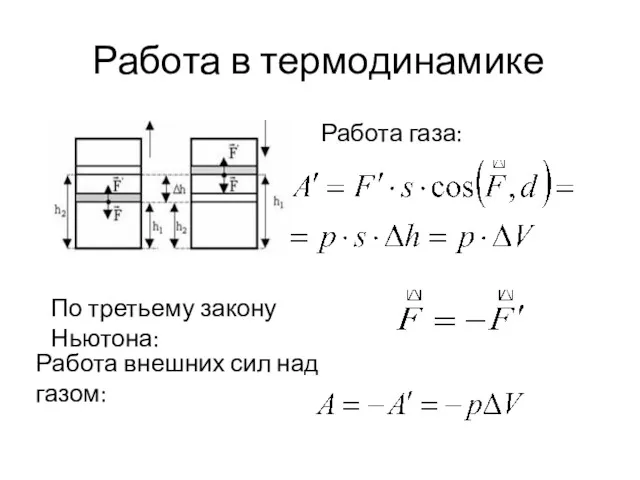
- 7. Работа в термодинамике По третьему закону Ньютона: Работа внешних сил над газом: Работа газа:
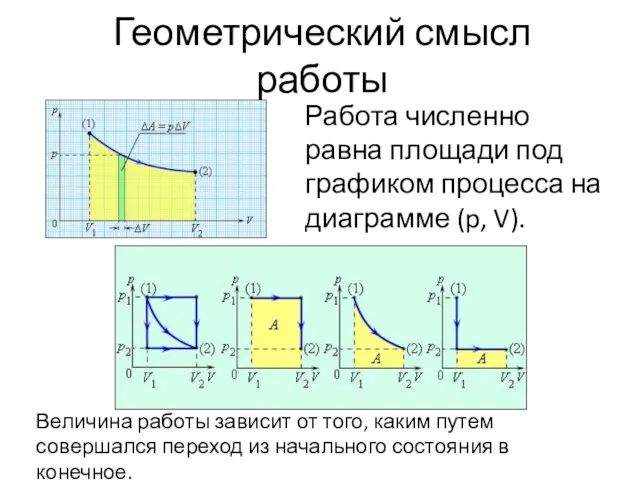
- 8. Геометрический смысл работы Работа численно равна площади под графиком процесса на диаграмме (p, V). Величина работы
- 9. Работа газа при изобарном нагревании ΔV > 0, работу совершает газ ΔV
- 10. Первый закон термодинамики Подводимая к системе теплота расходуется на совершение газом работы и изменение его внутренней
- 11. Применение первого закона термодинамики к изобарному процессу
- 12. Применение первого закона термодинамики к изохорному процессу
- 13. Теорема Майера Газовая постоянная численно равна работе которую совершает 1 моль газа при изобарном нагревании на
- 14. Применение первого закона термодинамики к изотермическому процессу
- 16. Скачать презентацию









 Элективный курс Методы решения физических задач
Элективный курс Методы решения физических задач Теорія електричних та електронних кіл
Теорія електричних та електронних кіл LXE10E Piping diagram
LXE10E Piping diagram Интерференция света
Интерференция света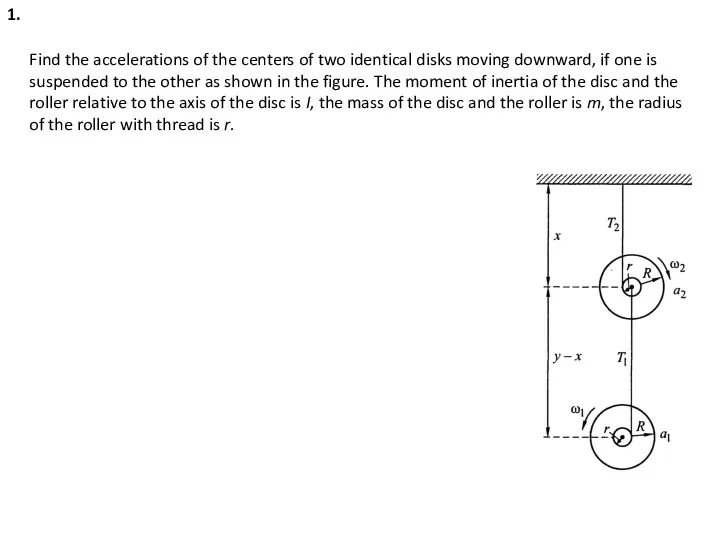 Find the acceleration centers of two identical disks moving down
Find the acceleration centers of two identical disks moving down Електричний струм. Закон Ома
Електричний струм. Закон Ома Оптика – это раздел физики, в котором изучаются световые явления
Оптика – это раздел физики, в котором изучаются световые явления Метод фазированных решеток. Базовые понятия
Метод фазированных решеток. Базовые понятия Истечение газов и паров
Истечение газов и паров Колебательный контур. Свободные и вынужденные электромагнитные колебания
Колебательный контур. Свободные и вынужденные электромагнитные колебания Роль домашнего и демонстрационного эксперимента в формировании интереса учащихся к изучению физики
Роль домашнего и демонстрационного эксперимента в формировании интереса учащихся к изучению физики Основные понятия и определения. Структурный анализ механизмов
Основные понятия и определения. Структурный анализ механизмов Электр станцияларының электр жабдықтары: аккумуляторлық, конденсаторлық қондырғылар
Электр станцияларының электр жабдықтары: аккумуляторлық, конденсаторлық қондырғылар Сила трения
Сила трения Коэффициент полезного действия (КПД) механизма
Коэффициент полезного действия (КПД) механизма История развития мотоиндустрии
История развития мотоиндустрии Тема урока. Решение задач по теме: Электрические явления.
Тема урока. Решение задач по теме: Электрические явления.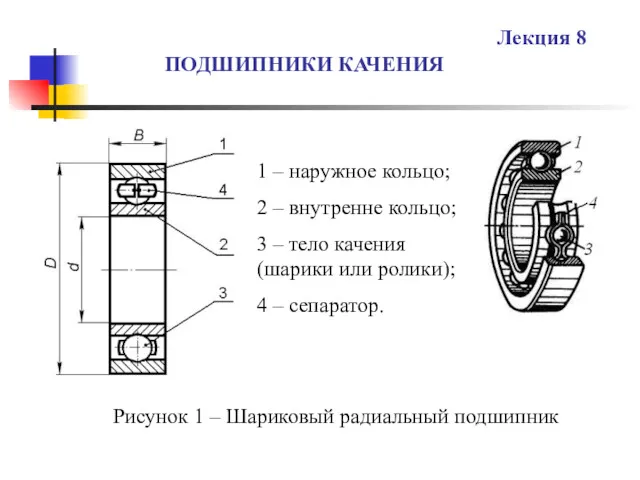 Подшипники качения. (Лекция 8)
Подшипники качения. (Лекция 8) Свет в нашей жизни.
Свет в нашей жизни. Основы слесарно-сборочных и электромонтажных работ. Обязанности электромонтера по ремонту и обслуживанию электрооборудования
Основы слесарно-сборочных и электромонтажных работ. Обязанности электромонтера по ремонту и обслуживанию электрооборудования Гидравлический пресс
Гидравлический пресс Потенциальная энергия
Потенциальная энергия Физика – фундаментальная наука о природе
Физика – фундаментальная наука о природе Використання лазерів в медицині
Використання лазерів в медицині 8. Плоскопараллельное движение твердого тела (плоское)
8. Плоскопараллельное движение твердого тела (плоское) Динамика материальной точки
Динамика материальной точки Измерение времени. (2 класс)
Измерение времени. (2 класс) Модуль: Физика будущего
Модуль: Физика будущего