Содержание
- 2. Спектроскопические методы – Масс-спектрометрия
- 3. Масс-спектрометрия
- 4. Масс-спектрометрия 1912 – Дж. Дж. Томсон создаёт первый масс-спектрограф и получает масс-спектры молекул кислорода, азота, угарного
- 5. Масс-спектрометрия История масс-спектрометрии 1932 – К. Бейнбридж строит масс-спектрометр с разрешающей способностью 600 и чувствительностью 1/10000.
- 6. Масс-спектрометрия История масс-спектрометрии 1972 – В.И. Каратаев и Б.А. Мамырин изобретают времяпролётный масс-анализатор с фокусировкой, значительно
- 7. Масс-спектрометрия Масс-спектрометрия (масс-спектроскопия, масс-спектрография, масс-спектрометрический анализ) – метод исследования вещества, основанный на определении отношения массы к
- 8. Масс-спектрометрия Применение масс-спектрометрии в органической химии Определение изотопного состава элементов Точное измерение атомных масс Элементный анализ
- 9. Масс-спектрометрия высокая абсолютная чувствительность метода масс-спектрометрии позволяет использовать его для анализа очень небольшого количества вещества (~
- 10. Масс-спектрометрия Ионизация – эндотермический процесс образования ионов из нейтральных атомов или молекул. Положительно заряженный ион образуется,
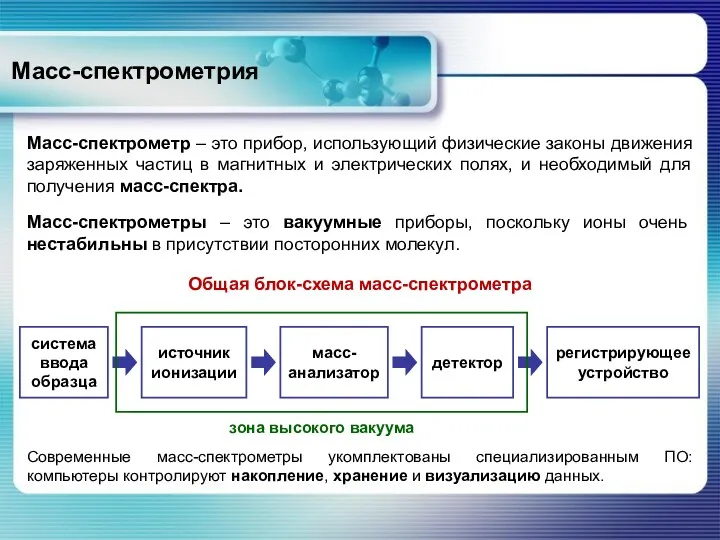
- 11. Масс-спектрометрия Масс-спектрометр – это прибор, использующий физические законы движения заряженных частиц в магнитных и электрических полях,
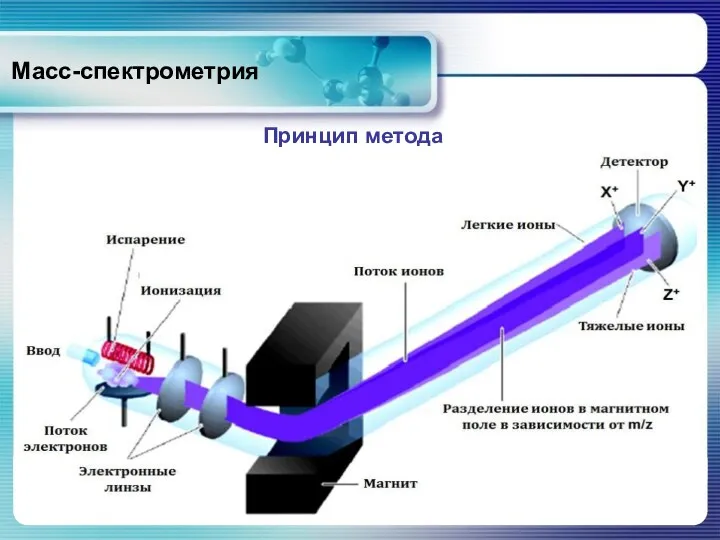
- 12. Масс-спектрометрия Пробу вводят в источник ионизации, где молекулы ионизируются. Принцип метода Образующиеся положительные ионы выводятся из
- 13. Масс-спектрометрия Газовая фаза электронная ионизация (EI) химическая ионизация (CI) электронный захват (EC) ионизация в электрическом поле
- 14. Масс-спектрометрия Способы ионизации Способы ионизации атомов и молекул зависят от конкретной цели анализа
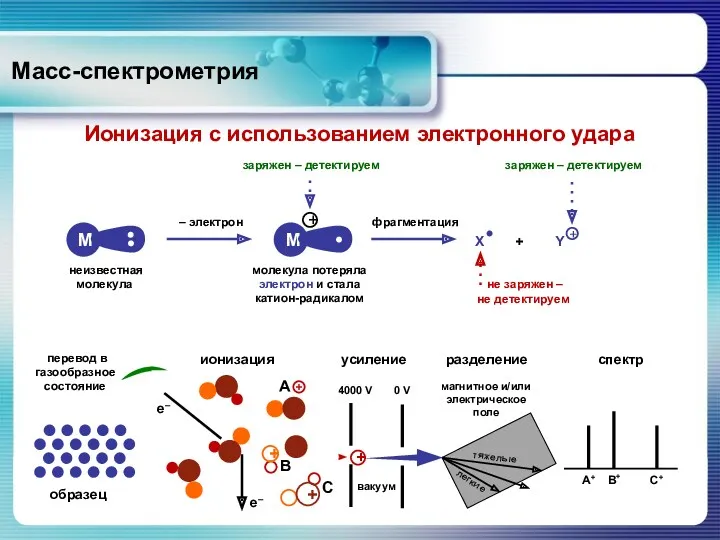
- 15. Масс-спектрометрия Электронный удар Метод ЭУ широко применяется для ионизации органических соединений. Пары образца бомбардируют ускоренными электронами
- 16. Масс-спектрометрия Ионизация с использованием электронного удара + ионизация +
- 17. Масс-спектрометрия Ионизация с использованием электронного удара При столкновении электронов с органической молекулой вначале образуется катион-радикал: С
- 18. Масс-спектрометрия Масс-спектр с ионизацией молекул электронным ударом Структурный анализ методом масс-спектрометрии заключается в идентификации осколочных ионов
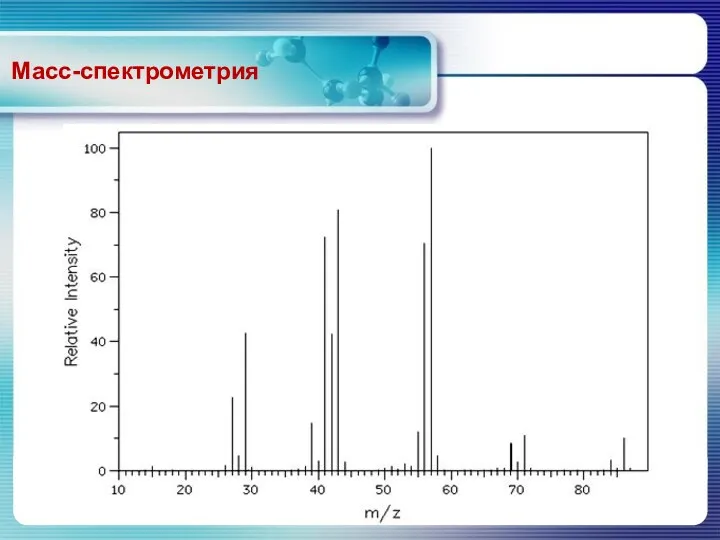
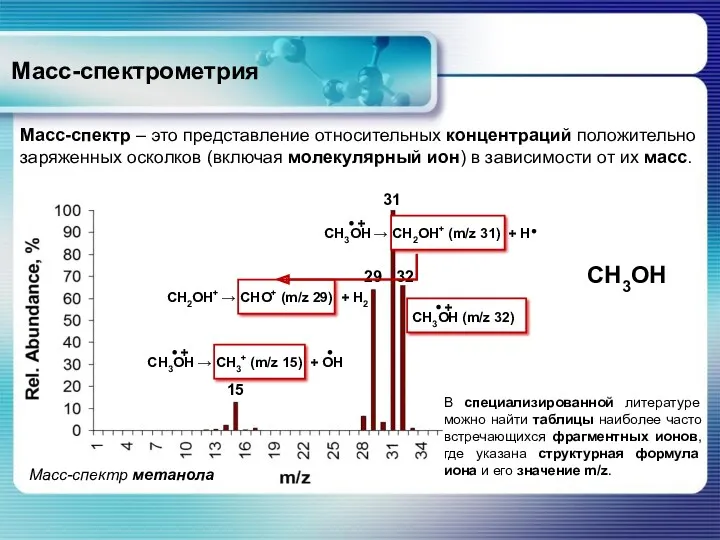
- 19. Масс-спектрометрия Масс-спектр – это представление относительных концентраций положительно заряженных осколков (включая молекулярный ион) в зависимости от
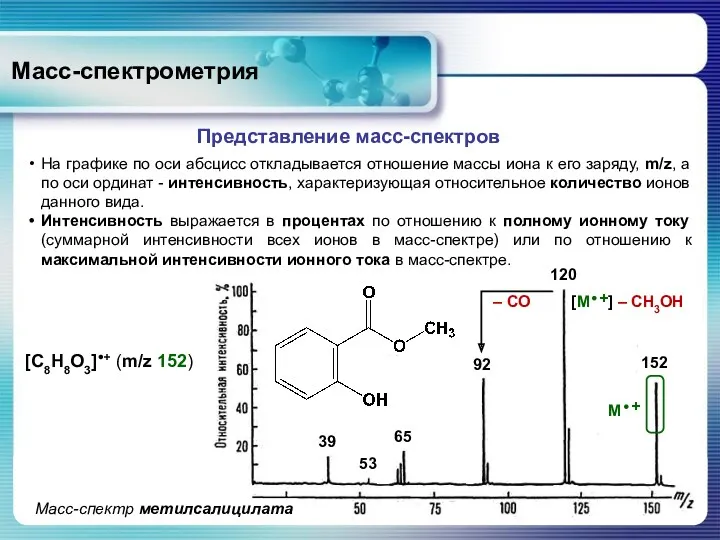
- 20. Масс-спектрометрия Представление масс-спектров На графике по оси абсцисс откладывается отношение массы иона к его заряду, m/z,
- 21. Масс-спектрометрия Высота наиболее интенсивного пика в спектре принимается за 100%, а интенсивности других пиков, включая пик
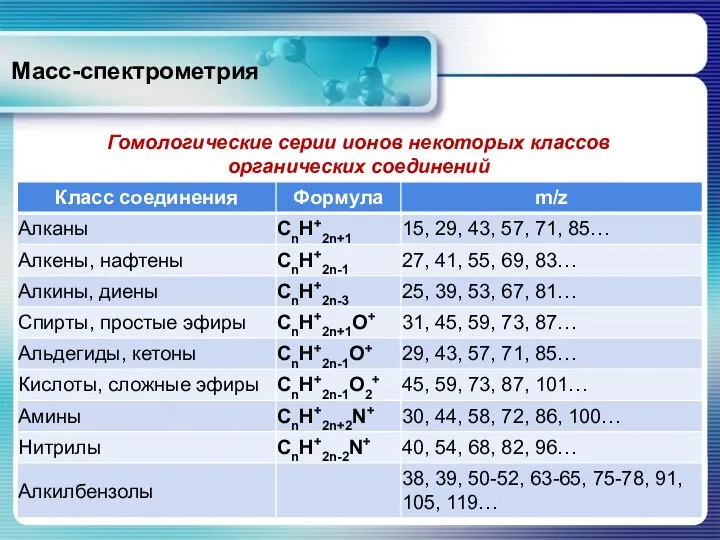
- 22. Масс-спектрометрия Гомологические серии ионов некоторых классов органических соединений
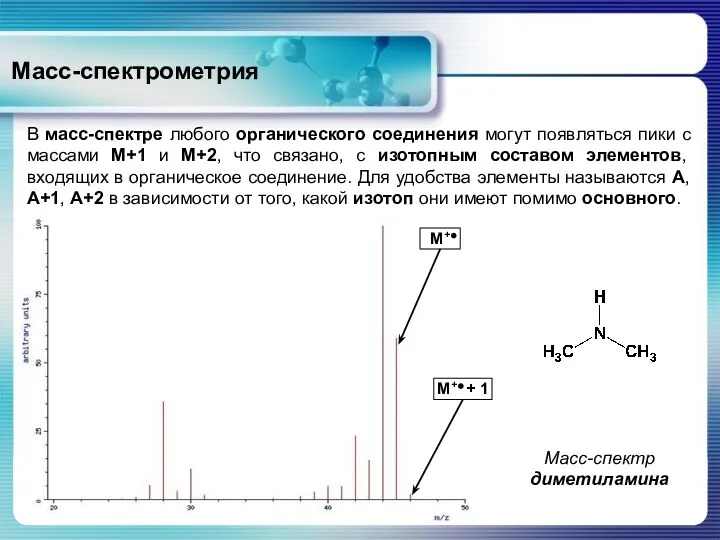
- 23. Масс-спектрометрия В масс-спектре любого органического соединения могут появляться пики с массами М+1 и М+2, что связано,
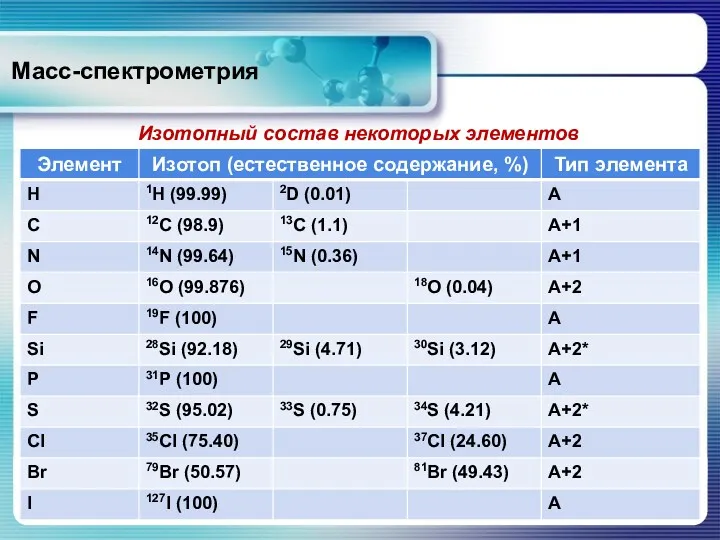
- 24. Масс-спектрометрия Изотопный состав некоторых элементов
- 25. Масс-спектрометрия Соотношение интенсивностей пиков М, М+1 и М+2 зависит от элементного состава, от числа атомов данного
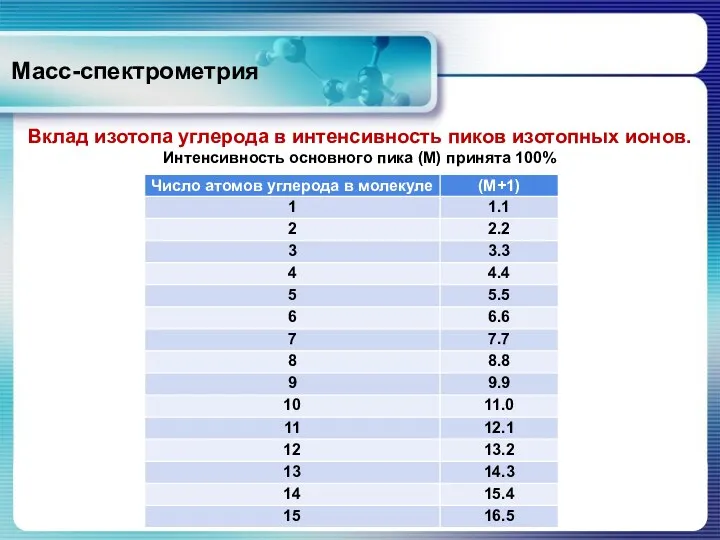
- 26. Масс-спектрометрия Вклад изотопа углерода в интенсивность пиков изотопных ионов. Интенсивность основного пика (М) принята 100%
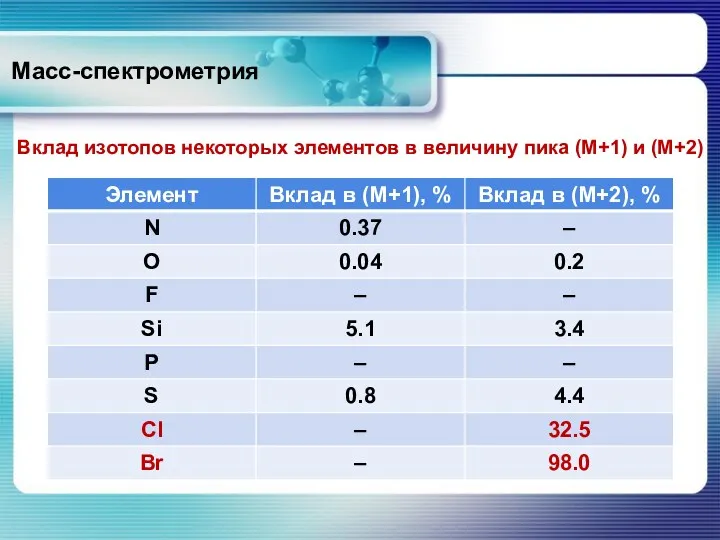
- 27. Масс-спектрометрия Вклад изотопов некоторых элементов в величину пика (М+1) и (М+2)
- 28. Масс-спектрометрия Существует правило: «Если интенсивность пика М+2 составляет менее 3% от интенсивности пика М, соединение не
- 29. Масс-спектрометрия Хлор, бром, сера и кремний хорошо идентифицируются, благодаря характерной для каждого элемента мультиплетности сигнала. В
- 30. Масс-спектрометрия Интерпретация масс-спектров с ионизацией молекул электронным ударом Интерпретация масс-спектра включает в себя идентификацию молекулярного иона,
- 31. Масс-спектрометрия 1. Обязательно необходимо иметь справочную литературу, где описаны основные закономерности фрагментации классов органических веществ, охарактеризованы
- 32. Масс-спектрометрия 4. Необходимо тщательно работать с имеющимися базами спектральных данных (все современные масс-спектрометры снабжены базами данных,
- 33. Масс-спектрометрия Масс-спектр может состоять из нескольких типов ионов: Молекулярный ион Фрагментные ионы Перегруппировочные ионы Многозарядные ионы
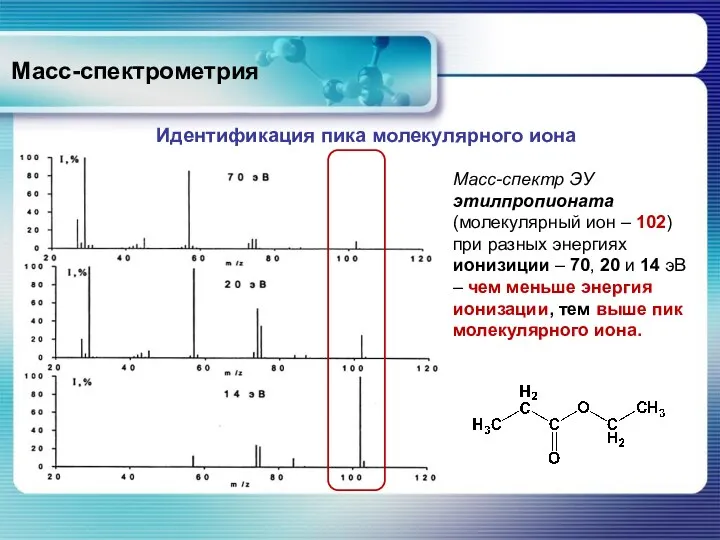
- 34. Масс-спектрометрия Идентификация молекулярного иона в спектрах с ионизацией электронным ударом часто бывает проблематичной: пик может оказаться
- 35. Масс-спектрометрия Идентификация пика молекулярного иона Масс-спектр ЭУ этилпропионата (молекулярный ион – 102) при разных энергиях ионизиции
- 36. Масс-спектрометрия Рекомендуется следовать некоторым эмпирическим правилам: Идентификация пика молекулярного иона 1. Азотное правило: «Молекула с четной
- 37. Масс-спектрометрия 3. Интенсивность пика молекулярного иона определяется его стабильностью. Способность органических соединений давать пик молекулярного иона
- 38. Масс-спектрометрия 4. Обычно заметные пики молекулярных ионов образуют следующие соединения: Идентификация пика молекулярного иона кетоны амины
- 39. Масс-спектрометрия 6. Необходимые условия, которым должен удовлетворять молекулярный ион: Идентификация пика молекулярного иона Степень ненасыщенности -
- 40. Масс-спектрометрия где x, y, z, w – индексы в брутто-формуле иона CxHyNzOw. Степень ненасыщенности Метод расчета
- 41. Масс-спектрометрия все одновалентные элементы (за исключением водорода) заменяются группами СН3, двухвалентные – СН2, трехвалентные – СН,
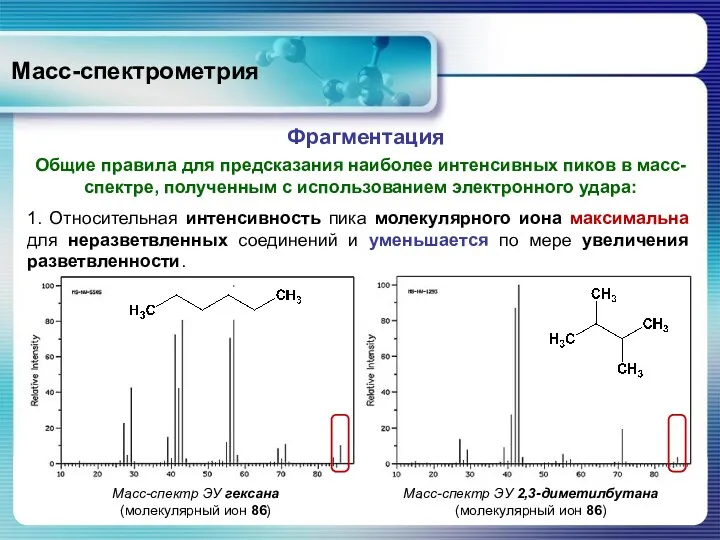
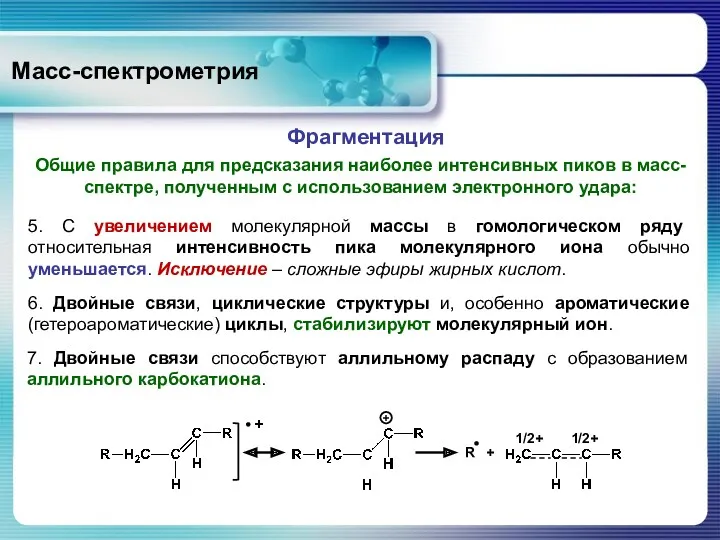
- 42. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
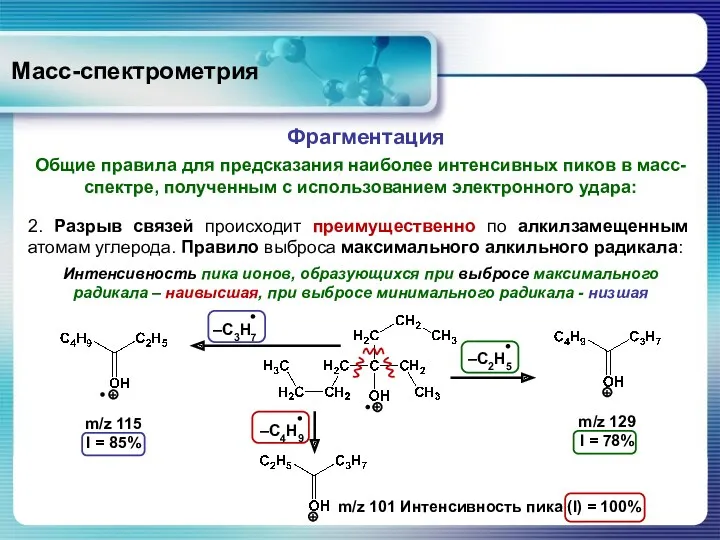
- 43. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
- 44. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
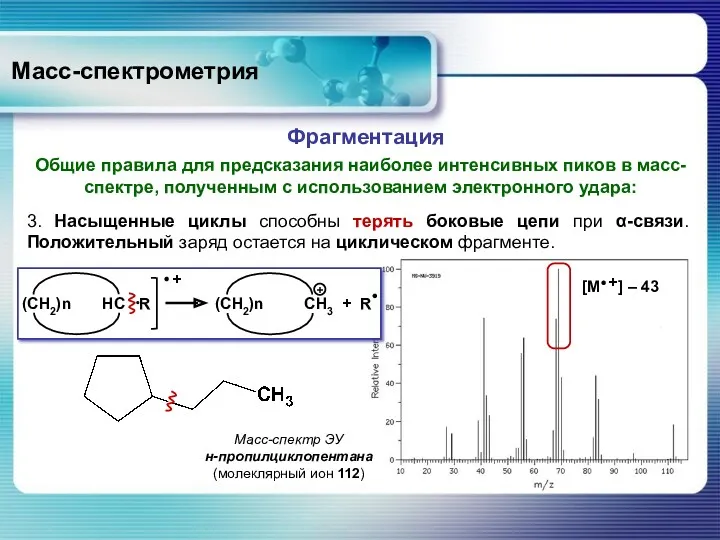
- 45. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
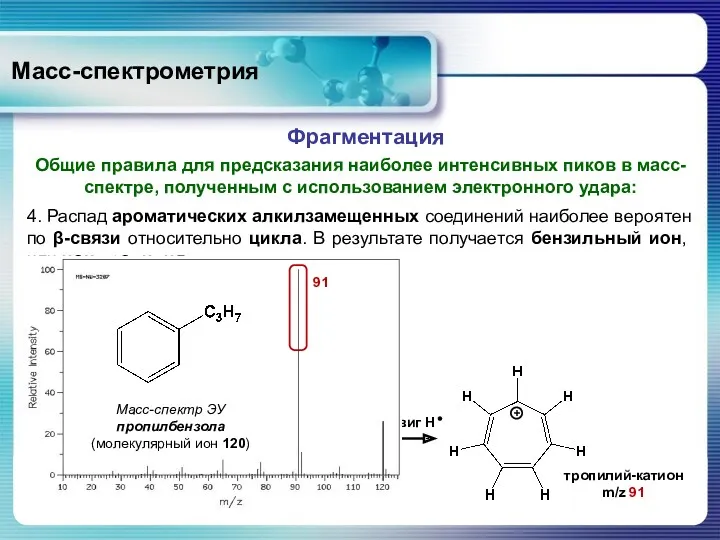
- 46. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
- 47. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
- 48. Масс-спектрометрия Общие правила для предсказания наиболее интенсивных пиков в масс-спектре, полученным с использованием электронного удара: Фрагментация
- 49. Масс-спектрометрия Фрагментация В органической масс-спектрометрии следует уделять пристальное внимание следующим фрагментным ионам: Ионы, характеризующиеся наиболее интенсивными
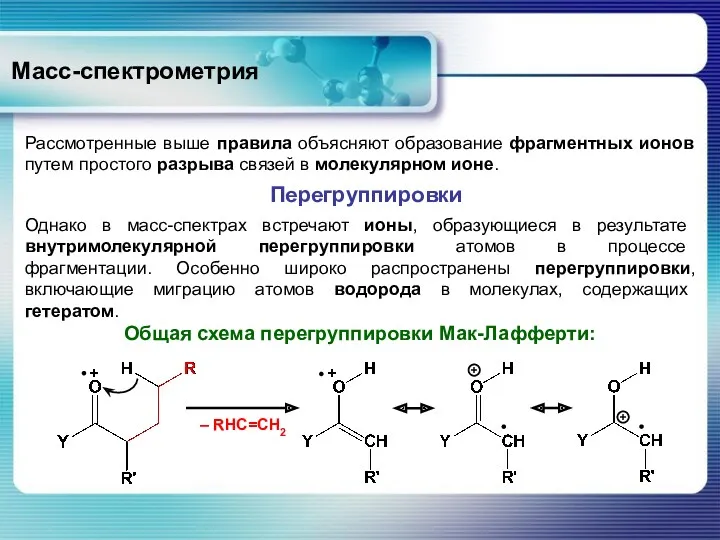
- 50. Масс-спектрометрия Перегруппировки Рассмотренные выше правила объясняют образование фрагментных ионов путем простого разрыва связей в молекулярном ионе.
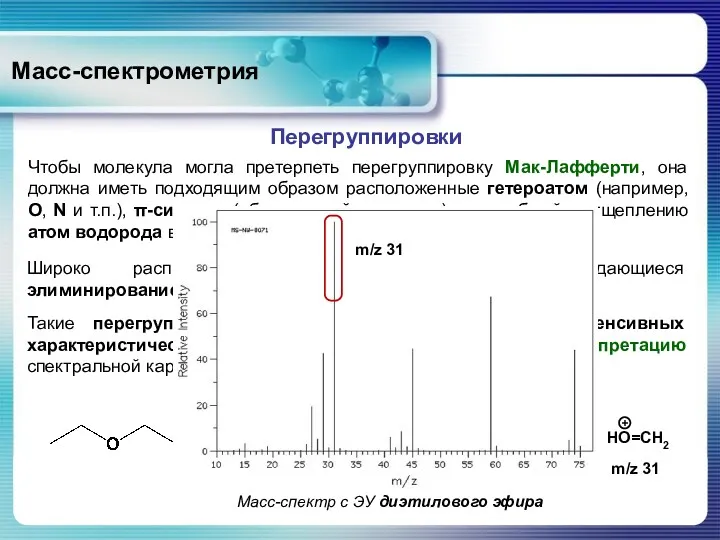
- 51. Масс-спектрометрия Перегруппировки Чтобы молекула могла претерпеть перегруппировку Мак-Лафферти, она должна иметь подходящим образом расположенные гетероатом (например,
- 52. Масс-спектрометрия Перегруппировки Перегруппировка Мак-Лафферти наблюдается при фрагментации молекулярных ионов спиртов, кетонов, сложных эфиров, амидов, алкилгетероциклов, ароматических
- 53. Масс-спектрометрия Многозарядные ионы – ионы, имеющие заряд больший, чем 1 (2, 3 и т.д.). Соответственно, отношение
- 54. Масс-спектрометрия Метастабильные ионы Ионы, имеющие время жизни порядка 10-6-10-5 секунд, далее претерпевают распад на ион и
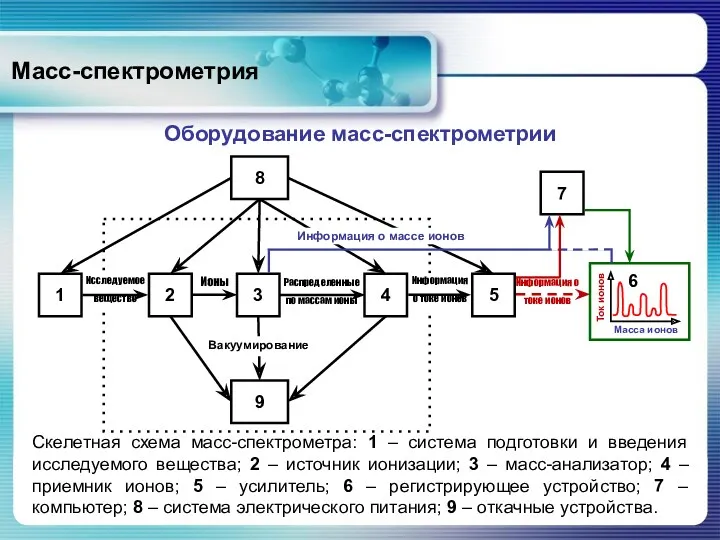
- 55. Масс-спектрометрия Оборудование масс-спектрометрии Скелетная схема масс-спектрометра: 1 – система подготовки и введения исследуемого вещества; 2 –
- 56. Масс-спектрометрия Непрямой способ – пробу вводят в ионизатор в газообразном состоянии. Жидкие и твердые пробы испаряют
- 57. Масс-спектрометрия Масс-анализаторы Типы масс-анализаторов: Второй этап масс-спектрометрического анализа – сортировка ионов по массам (по отношению массы
- 58. Масс-спектрометрия Первые масс-спектрометры использовали в качестве детектора – фотопластинку. Детекторы ионов динодные вторично-электронные умножители В настоящее
- 59. Масс-спектрометрия Характеристики масс-спектрометров Важными техническими характеристиками масс-спектрометров являются чувствительность, динамический диапазон, разрешение, скорость сканирования. Важнейшие характеристики
- 60. Масс-спектрометрия Характеристики масс-спектрометров Самым чувствительным является органический хромато-масс-спектрометр высокого разрешения с двойной фокусировкой. Все масс-спектрометры подразделяются
- 61. Масс-спектрометрия Оборудование масс-спектрометрии Масс-спектрометр Agilent
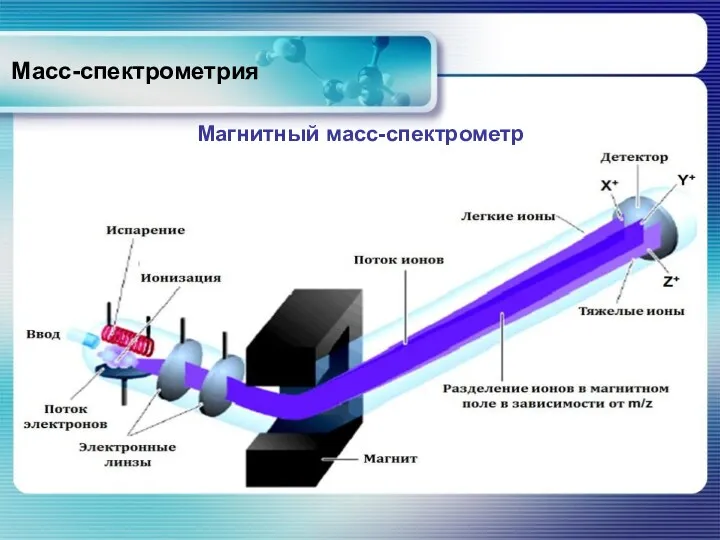
- 62. Масс-спектрометрия Магнитный масс-спектрометр
- 63. Масс-спектрометрия Магнитный масс-спектрометр
- 64. Масс-спектрометрия Времяпролетный масс-спектрометр имеет более высокую чувствительность по сравнению со сканирующими приборами; имеет очень высокую скорость
- 65. Масс-спектрометрия Квадрупольный масс-спектрометр Квадрупольный анализатор: Квадруполь легко управляется компьютером Имеет хороший динамический диапазон (105) Стыкуется со
- 66. Масс-спектрометрия Масс-спектрометр ион-циклотронного резонанса с Фурье-преобразованием (FT-ICR)
- 67. Масс-спектрометрия Масс-спектрометр с индуктивно-связанной плазмой
- 68. Масс-спектрометрия MALDI-TOF масс-спектрометр Bruker Ultraflex III TOF/TOF 200
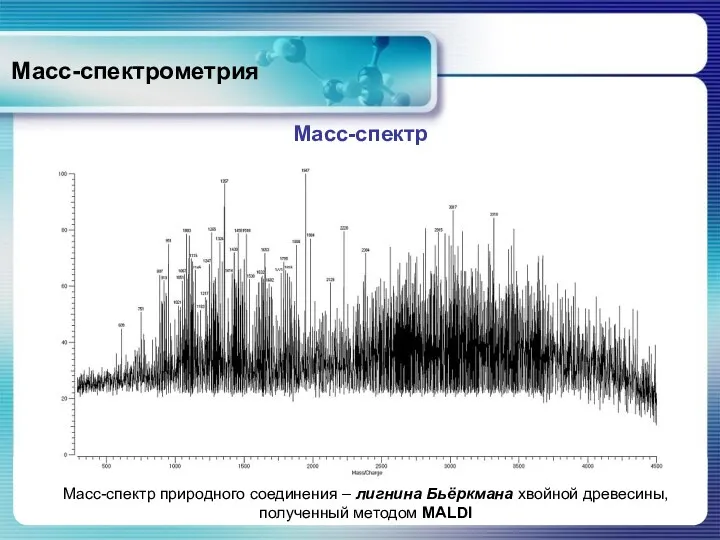
- 69. Масс-спектрометрия Масс-спектр Масс-спектр природного соединения – лигнина Бьёркмана хвойной древесины, полученный методом MALDI
- 70. Масс-спектрометрия Масс-спектрометры используются для анализа органических и неорганических соединений. Хромато-масс-спектрометрия Органические образцы в большинстве случаев представляют
- 71. Масс-спектрометрия Хромато-масс-спектрометр
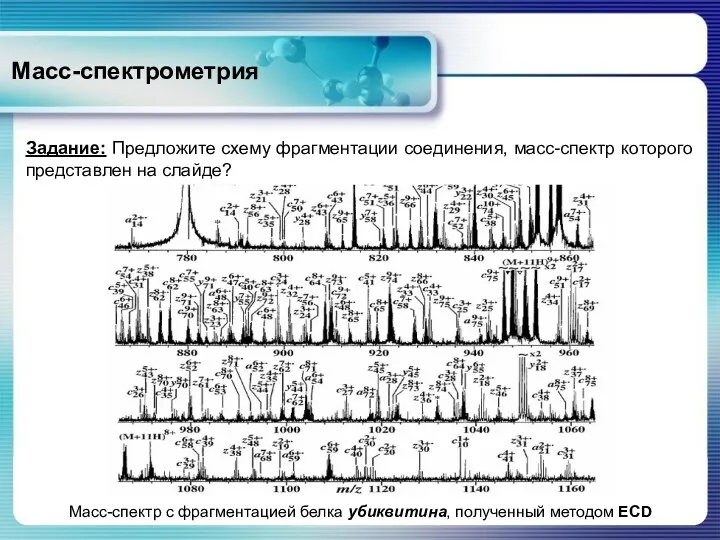
- 72. Масс-спектрометрия Масс-спектр Масс-спектр с фрагментацией белка убиквитина, полученный методом ECD Задание: Предложите схему фрагментации соединения, масс-спектр
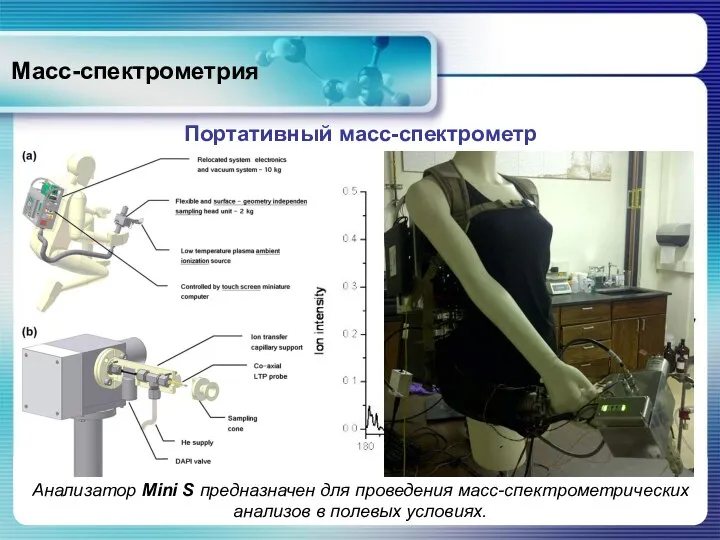
- 73. Масс-спектрометрия Портативный масс-спектрометр Миниатюрный масс-спектрометр, используемый для обнаружения химических веществ на производстве.
- 74. Масс-спектрометрия Портативный масс-спектрометр Масс-спектрометр в продуктовом магазине за считанные минуты определил химические вещества на яблоках и
- 75. Масс-спектрометрия Портативный масс-спектрометр Анализатор Mini S предназначен для проведения масс-спектрометрических анализов в полевых условиях.
- 76. Масс-спектрометрия Масс-спектрометр на марсоходе «Curiosity»
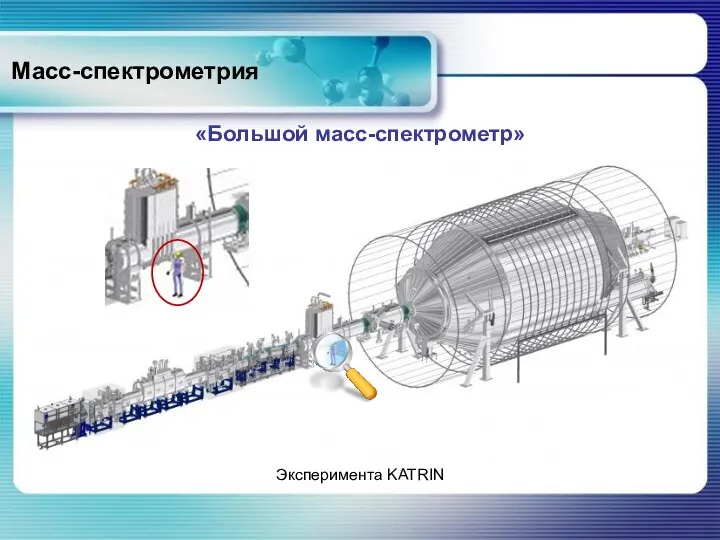
- 77. Масс-спектрометрия «Большой масс-спектрометр» Эксперимента KATRIN
- 78. Масс-спектрометрия «Большой масс-спектрометр» Проект KATRIN (KArlsruhe TRItium Neutrino) Транспортировка вакуумной камеры главного электронного спектрометра через деревню
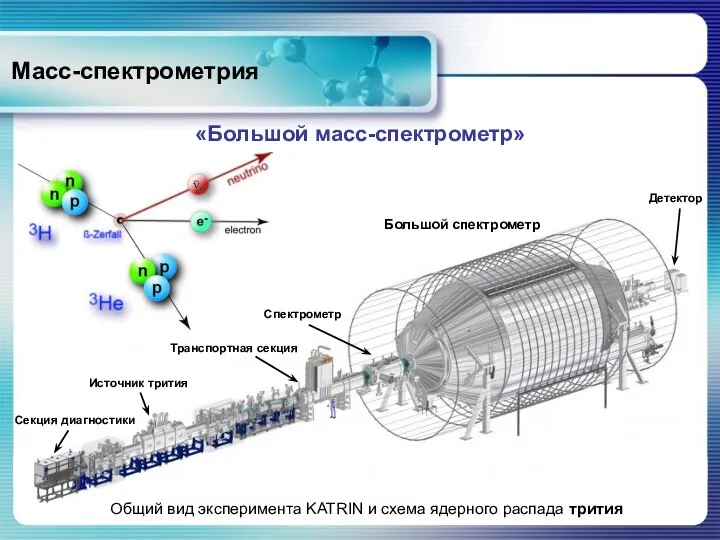
- 79. Масс-спектрометрия «Большой масс-спектрометр» Общий вид эксперимента KATRIN и схема ядерного распада трития
- 80. Масс-спектрометрия «Большой масс-спектрометр» Длина уникального агрегата – 23 метра, ширина – 10 метров. Вес гигантских "весов"
- 81. Инструментальные методы анализа Вопросы к лекции: 2. Основные понятия масс-спектрометрии? 3. Принцип метода масс-спектрометрии? 4. Способы
- 82. ЯМР спектроскопия Казицина А.А., Куплетская Н.Б. Применение ИК-, УФ- и ЯМР-мектроскопии в органической химии − М.:
- 84. Скачать презентацию























































 Средства визуального и измерительного контроля
Средства визуального и измерительного контроля Структура пограничного слоя при продольном обтекании сотовой поверхности
Структура пограничного слоя при продольном обтекании сотовой поверхности Нахождение решения стационарного уравнения
Нахождение решения стационарного уравнения Сферические зеркала.Ход лучей в призме, плоскопараллельной пластине
Сферические зеркала.Ход лучей в призме, плоскопараллельной пластине Микроскоп кұрылысы
Микроскоп кұрылысы Спонтанное и индуцированное излучения
Спонтанное и индуцированное излучения Закон сохранения импульса и механической энергии. Решение задач
Закон сохранения импульса и механической энергии. Решение задач Chemical energy storage
Chemical energy storage Контрольная работа по теме Механическое движение. Взаимодействие тел
Контрольная работа по теме Механическое движение. Взаимодействие тел Презентация Сила.Явление тяготения.Сила тяжести.
Презентация Сила.Явление тяготения.Сила тяжести. Устами младенца. Игра для 7 класса по физике
Устами младенца. Игра для 7 класса по физике Злітно-посадочні пристрої вертольота
Злітно-посадочні пристрої вертольота Оптика. Задачи
Оптика. Задачи Методика проведения фронтального опроса учащихся по физике
Методика проведения фронтального опроса учащихся по физике Светильники с лампами ДРЛ: сервисное обслуживание и ремонт. Монтаж, наладка и испытания
Светильники с лампами ДРЛ: сервисное обслуживание и ремонт. Монтаж, наладка и испытания Спектроскоп. Устройство, принцип работы спектроскопа
Спектроскоп. Устройство, принцип работы спектроскопа Виды спектров. Спектральный анализ
Виды спектров. Спектральный анализ Радуга
Радуга Теплотехника. Основы технической термодинамики
Теплотехника. Основы технической термодинамики Электромагнитные помехи
Электромагнитные помехи Сила упругости. Закон Гука. 7 класс
Сила упругости. Закон Гука. 7 класс Введение. Проблемы прочности в технике
Введение. Проблемы прочности в технике Отчет по производственной практике по специализации: Слесарь по контрольно-измерительным приборам и автоматике
Отчет по производственной практике по специализации: Слесарь по контрольно-измерительным приборам и автоматике Радиоактивные превращения атомных ядер
Радиоактивные превращения атомных ядер Podstawowe pojęcia z zakresu RADIOMETRII
Podstawowe pojęcia z zakresu RADIOMETRII Устройство, техническое обслуживание и ремонт рулевого управления трактора
Устройство, техническое обслуживание и ремонт рулевого управления трактора Средства измерения температуры
Средства измерения температуры Частицы и взаимодействия
Частицы и взаимодействия