Содержание
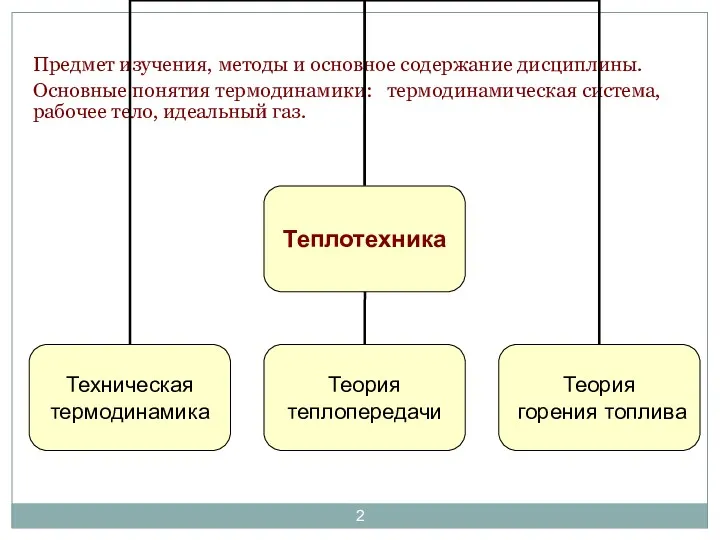
- 2. Предмет изучения, методы и основное содержание дисциплины. Основные понятия термодинамики: термодинамическая система, рабочее тело, идеальный газ.
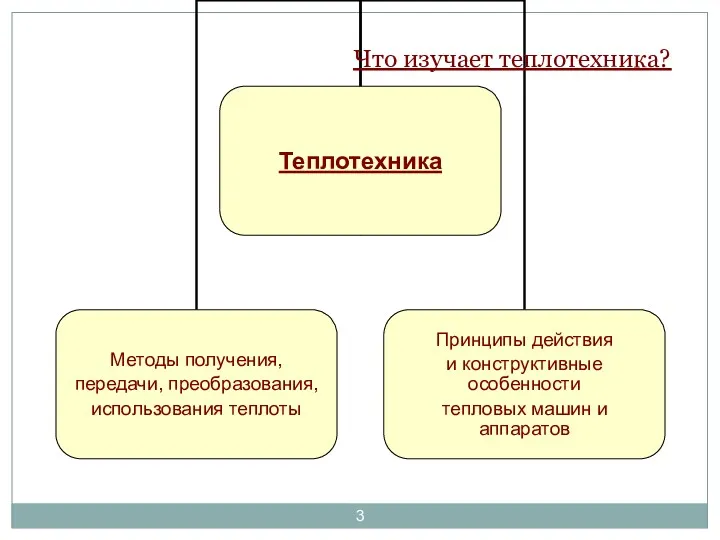
- 3. Что изучает теплотехника?
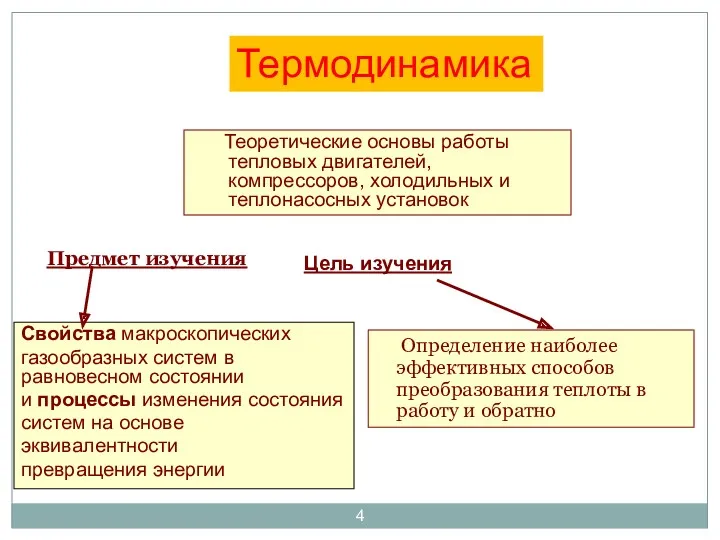
- 4. Предмет изучения Определение наиболее эффективных способов преобразования теплоты в работу и обратно Свойства макроскопических газообразных систем
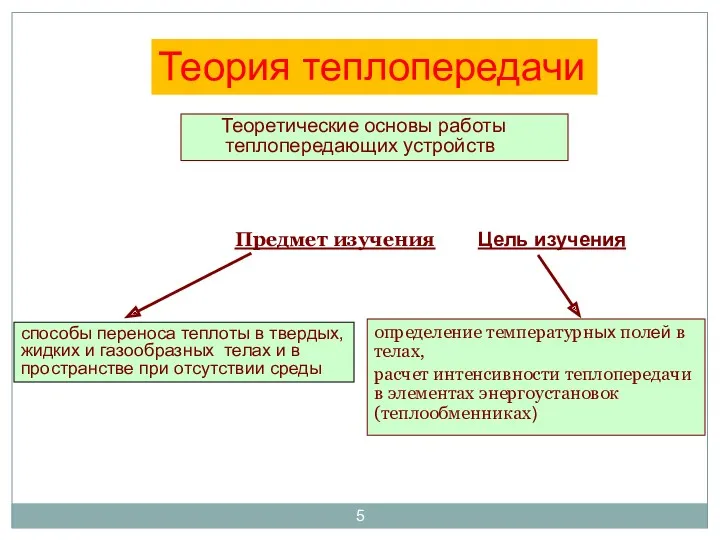
- 5. Предмет изучения определение температурных полей в телах, расчет интенсивности теплопередачи в элементах энергоустановок (теплообменниках) способы переноса
- 6. «Начала» термодинамики» Первое начало: невозможен процесс возникновения или исчезновения энергии (общий закон сохранения энергии) Второе начало:
- 7. Содержание дисциплины «Техническая термодинамика»
- 8. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА 1.Теплотехника: Учебник для втузов. Под общ. ред. А.М. Архарова, В.Н., Афанасьева.– М., Изд-во. ГТУ
- 9. Параметры термодинамического состояния Абсолютное давление (p), Па. Давление: Абсолютное, барометрическое (атмосферное) В=101325 Па ≈ 0,1 МПа
- 10. Параметры термодинамического состояния Абсолютная температура, T Абсолютная температура: представляет собой меру средней кинетической энергии молекул характеризует
- 11. Уравнение состояния идеального газа для 1 моля (кмоля): где Rμ - универсальная газовая постоянная работа, совершаемая
- 12. Уравнение состояния идеального газа для 1 кг: где R - индивидуальная газовая постоянная - работа единицы
- 13. Термодинамические процессы и циклы Термодинамический процесс: всякое изменение хотя бы одного из параметров состояния. Прямые и
- 14. Термодинамические процессы Политропный процесс изохорный изобарный изотермический адиабатический n=0 n=±∞ n=1 n=k 1
- 15. Термодинамические процессы
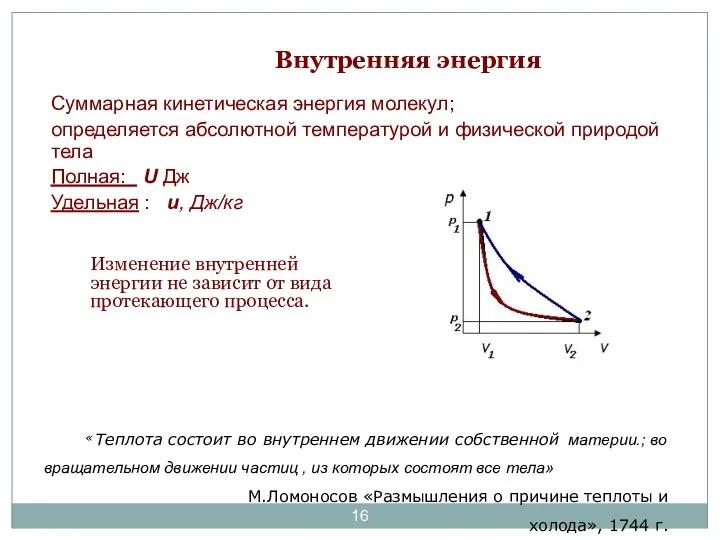
- 16. Внутренняя энергия Изменение внутренней энергии не зависит от вида протекающего процесса. «Теплота состоит во внутреннем движении
- 17. Теплота и работа «Теплота состоит во внутреннем движении собственной материи.; во вращательном движении частиц , из
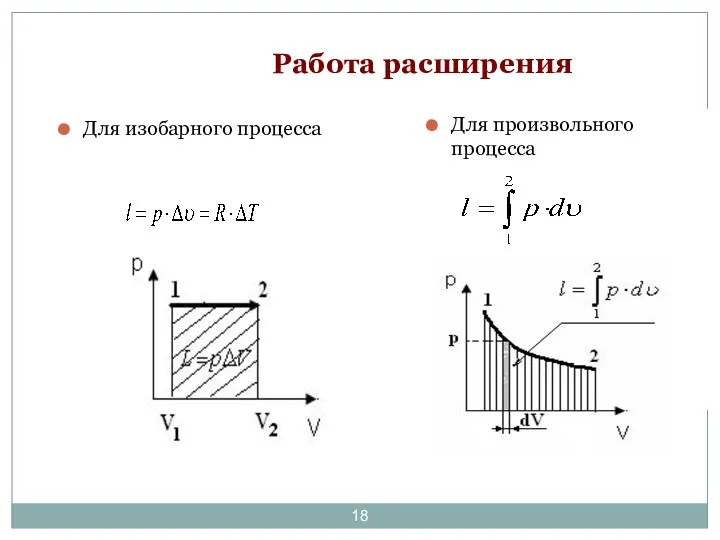
- 18. Работа расширения Для изобарного процесса Для произвольного процесса
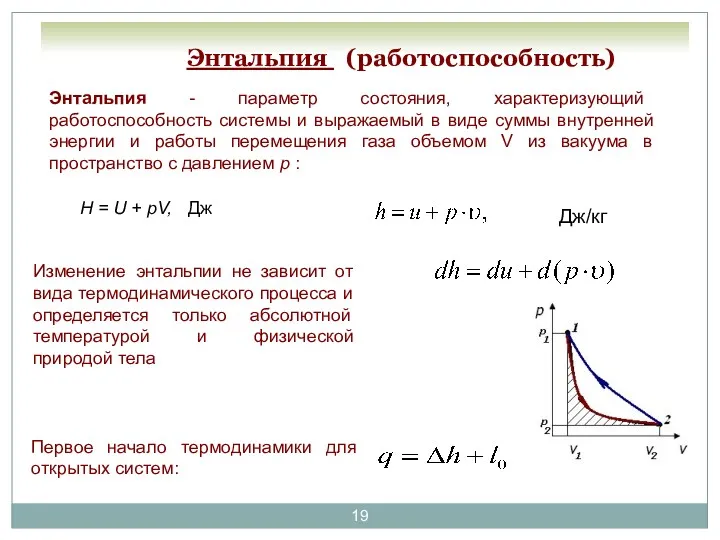
- 19. Энтальпия (работоспособность) H = U + pV, Дж Энтальпия - параметр состояния, характеризующий работоспособность системы и
- 20. Работа Работа расширения, используется для неизменной массы системы (в закрытых термодинамических системах) и определяется в общем
- 21. Энтропия Энтропия – есть мера неупорядоченности системы: Важно изменение энтропии, а не её абсолютное значение! Энтропия
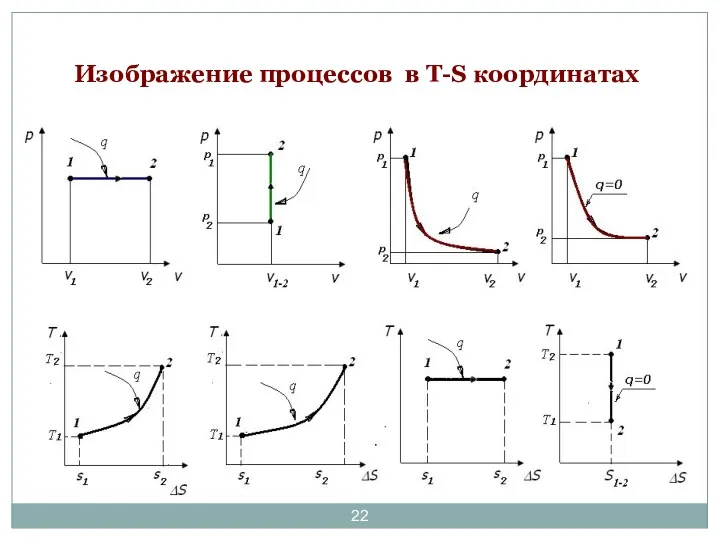
- 22. Изображение процессов в Т-S координатах изобарный изохорный изотермический адиабатический
- 23. Теплоемкость идеальных газов Очевидно: При подводе теплоты к рабочему телу увеличивается внутренней энергии и изменяются параметры
- 24. Теплоёмкость - свойство рабочего тела, характеризующее количество теплоты, получаемое или отдаваемое телом, отнесенное к изменению температуры
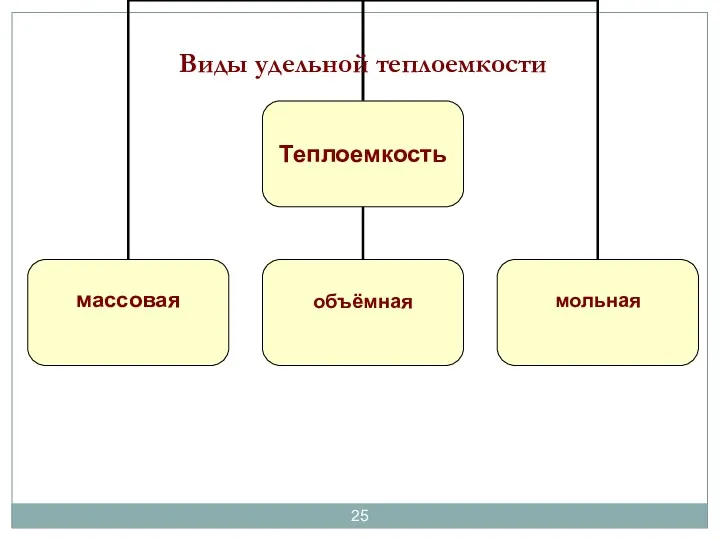
- 25. Виды удельной теплоемкости
- 26. Виды удельной теплоемкости массовая объёмная мольная (z – количество молей) Взаимосвязь между массовой и мольной:
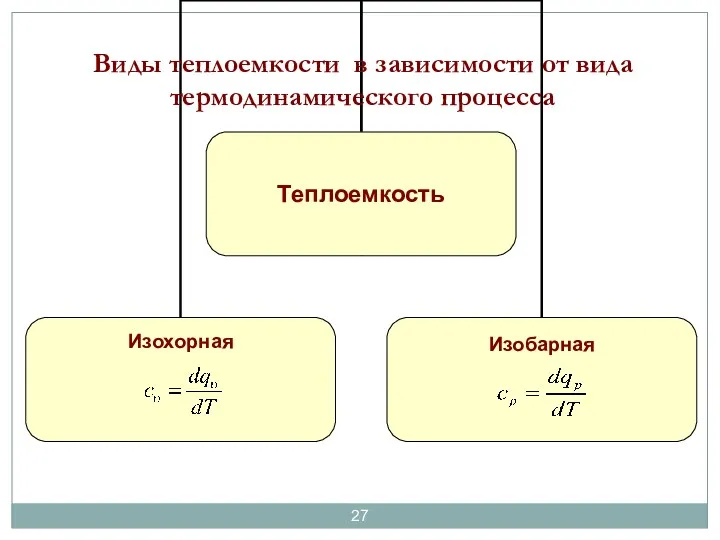
- 27. Виды теплоемкости в зависимости от вида термодинамического процесса
- 28. Важные соотношения k- показатель адиабаты k =5/3 = 1,67 - 1- атомный газ; k = 7/5
- 29. Смеси идеальных газов (газовые смеси) Состав смеси обычно задается объемными, массовыми мольными долями.
- 30. Термодинамические параметры смеси, заданной объемными долями Плотность Молярная кажущаяся масса Газовая постоянная Парциальные давления
- 31. Термодинамические параметры смеси, заданной массовыми долями Плотность Молярная кажущаяся масса Газовая постоянная Парциальные давления
- 32. Политропные процессы в идеальных газах Уравнение политропного процесса Показатель политропы Теплоемкость процесса Соотношения между параметрами состояния
- 33. Изменение внутренней энергии Изменение энтропии Изменение энтальпии Энергетические параметры состояния для неизотермического политропного процесса
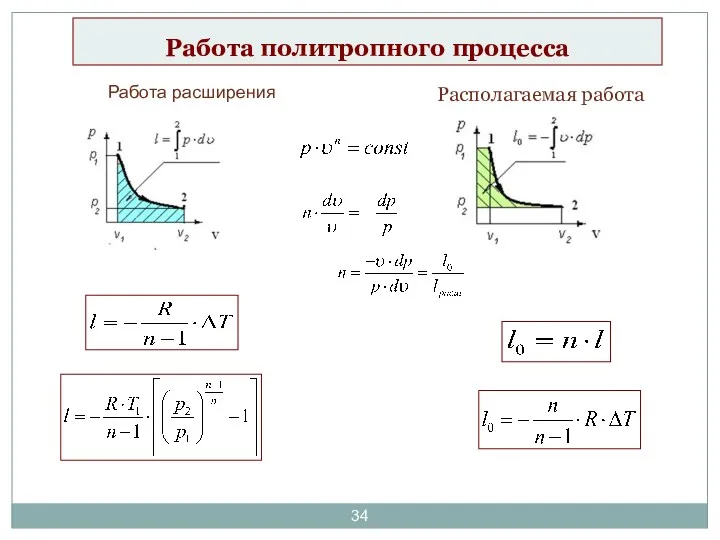
- 34. Работа политропного процесса Работа расширения Располагаемая работа
- 36. Скачать презентацию






















 Парогенераторы АЭС. Первичные теплоносители. (Тема 3)
Парогенераторы АЭС. Первичные теплоносители. (Тема 3) Сила трения
Сила трения Синтез наноматериалов золь-гель методом. (Лекция 5)
Синтез наноматериалов золь-гель методом. (Лекция 5) Nanophotonics class 4. Density of states
Nanophotonics class 4. Density of states Изопроцессы
Изопроцессы Сложение скоростей
Сложение скоростей ТРИЗ Электричество
ТРИЗ Электричество Все о ракетах
Все о ракетах Физика в профессии Слесарь по ремонту автомобилей
Физика в профессии Слесарь по ремонту автомобилей Электрооборудование автомобилей. Автоматическая коробка переключения передач с электронным управлением
Электрооборудование автомобилей. Автоматическая коробка переключения передач с электронным управлением Методы оптической молекулярной спектроскопии
Методы оптической молекулярной спектроскопии Types of Forces
Types of Forces Магнітне поле постійного струму
Магнітне поле постійного струму Внутренняя энергия. Первый закон термодинамики
Внутренняя энергия. Первый закон термодинамики Заттың агрегаттық күйлерінің өзгеруі. 8 сынып
Заттың агрегаттық күйлерінің өзгеруі. 8 сынып Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8
Тонкостенные оболочки. Основные допущения. Уравнение Лапласа. Лекция 8 Тяговый расчет автомобиля
Тяговый расчет автомобиля Сообщающие сосуды
Сообщающие сосуды Лампа накаливания
Лампа накаливания Interest in the synthesis of metal nanoparticles by explosion
Interest in the synthesis of metal nanoparticles by explosion Электромагнитные колебания
Электромагнитные колебания Взаимодействие электромагнитных световых волн с веществом. Поляризация света. Виды поляризации
Взаимодействие электромагнитных световых волн с веществом. Поляризация света. Виды поляризации Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов
Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов Физика. Физические основы механики
Физика. Физические основы механики Критерії роботоздатності деталей машин. (Лекція 2)
Критерії роботоздатності деталей машин. (Лекція 2) Дыбыс, кең мағынасында
Дыбыс, кең мағынасында Magnit orici
Magnit orici Законы постоянного тока
Законы постоянного тока