Содержание
- 2. ЗОЛЬ - КОЛЛОИДНЫЙ РАСТВОР, ГЕЛЬ - ЗОЛЬ С КОЛЛОИДНЫМИ ЧАСТИЦАМИ, ОБРАЗУЮЩИМИ ПРОСТРАНСТВЕННУЮ СЕТКУ СВЯЗЕЙ КСЕРОГЕЛЬ -
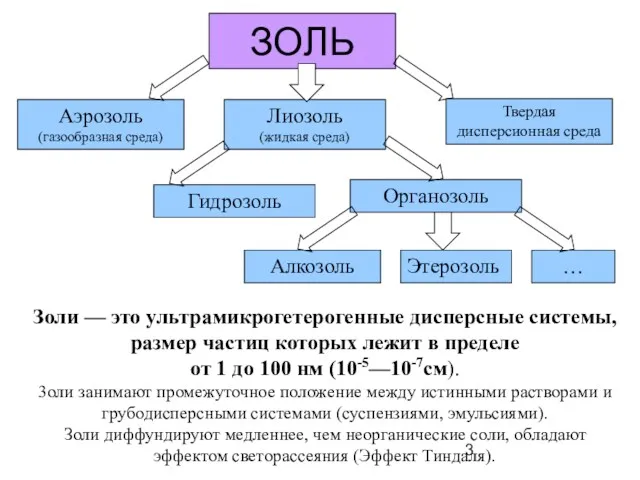
- 3. ЗОЛЬ Золи — это ультрамикрогетерогенные дисперсные системы, размер частиц которых лежит в пределе от 1 до
- 4. ГЕЛЬ Гель – золь с коллоидными частицами, образующими пространственную сетку связей. Или, другими словами, гели —дисперсные
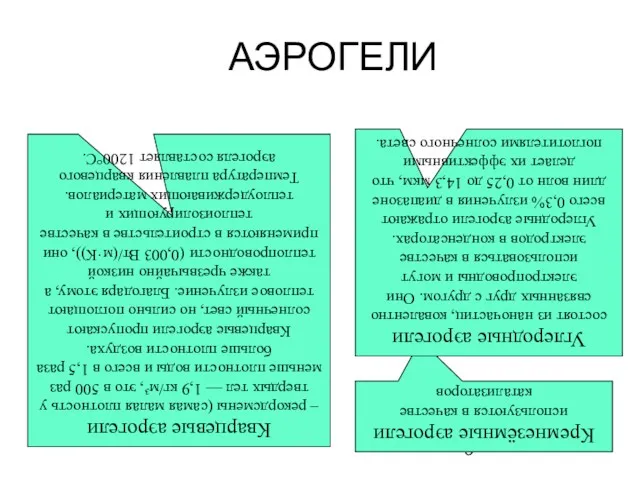
- 5. АЭРОГЕЛИ Кремнезёмные аэрогели используются в качестве катализаторов Углеродные аэрогели состоят из наночастиц, ковалентно связанных друг с
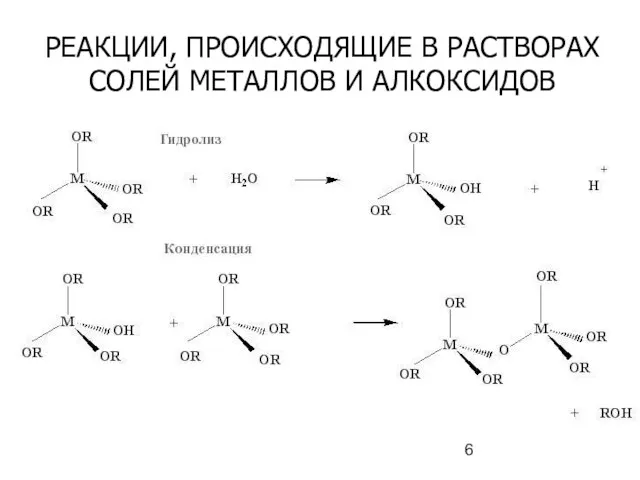
- 6. РЕАКЦИИ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ СОЛЕЙ МЕТАЛЛОВ И АЛКОКСИДОВ
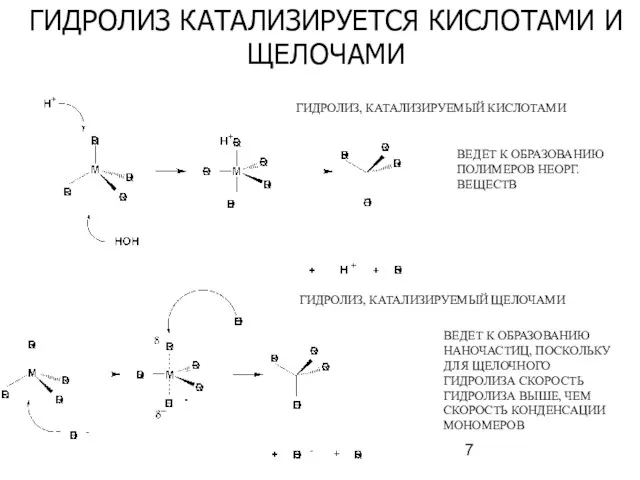
- 7. ГИДРОЛИЗ КАТАЛИЗИРУЕТСЯ КИСЛОТАМИ И ЩЕЛОЧАМИ ВЕДЕТ К ОБРАЗОВАНИЮ ПОЛИМЕРОВ НЕОРГ. ВЕЩЕСТВ ГИДРОЛИЗ, КАТАЛИЗИРУЕМЫЙ ЩЕЛОЧАМИ ВЕДЕТ К
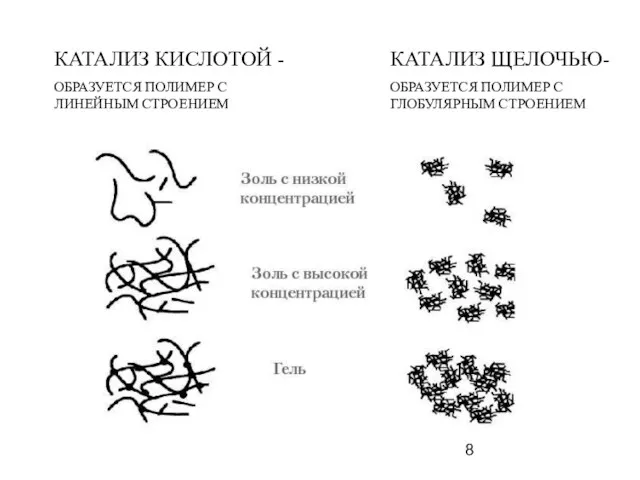
- 8. КАТАЛИЗ КИСЛОТОЙ - ОБРАЗУЕТСЯ ПОЛИМЕР С ЛИНЕЙНЫМ СТРОЕНИЕМ КАТАЛИЗ ЩЕЛОЧЬЮ- ОБРАЗУЕТСЯ ПОЛИМЕР С ГЛОБУЛЯРНЫМ СТРОЕНИЕМ
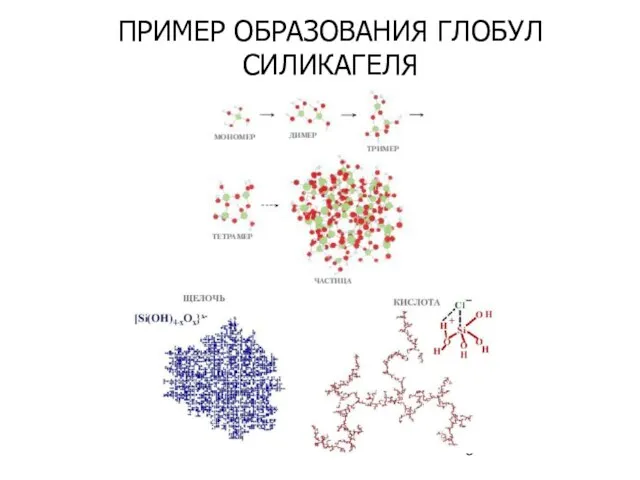
- 9. ПРИМЕР ОБРАЗОВАНИЯ ГЛОБУЛ СИЛИКАГЕЛЯ
- 10. Особенности синтеза нанокомпозитов золь – гель методом Существует возможность синтеза многокомпонентных силикатных и гибридных органо-неорганических золь-гель
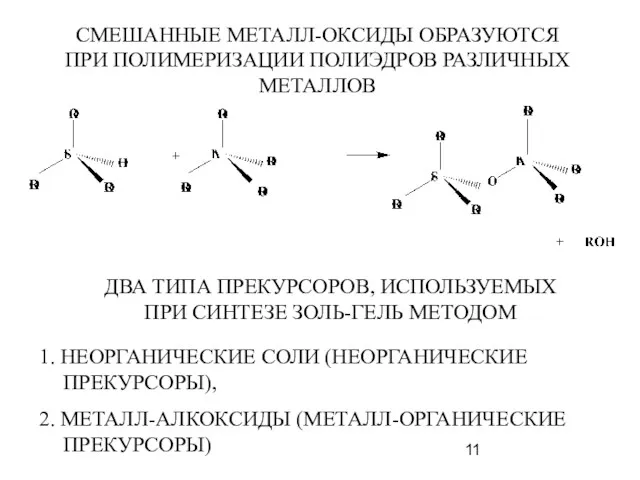
- 11. СМЕШАННЫЕ МЕТАЛЛ-ОКСИДЫ ОБРАЗУЮТСЯ ПРИ ПОЛИМЕРИЗАЦИИ ПОЛИЭДРОВ РАЗЛИЧНЫХ МЕТАЛЛОВ
- 12. +1 металлы (Li, Na и др.) имеют низкий заряд и проявляют свойства “инертных электролитов”. Формируют щелочные
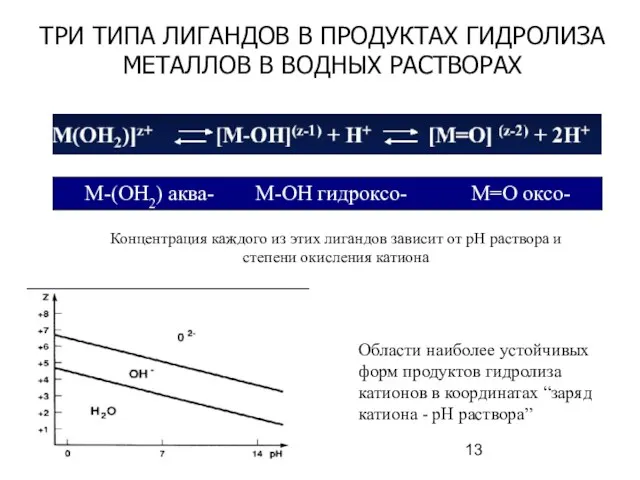
- 13. ТРИ ТИПА ЛИГАНДОВ В ПРОДУКТАХ ГИДРОЛИЗА МЕТАЛЛОВ В ВОДНЫХ РАСТВОРАХ Концентрация каждого из этих лигандов зависит
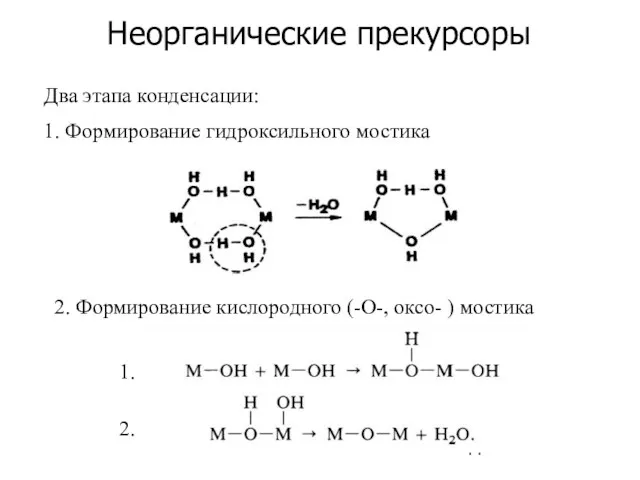
- 14. Неорганические прекурсоры Два этапа конденсации: 1. Формирование гидроксильного мостика 2. Формирование кислородного (-О-, оксо- ) мостика
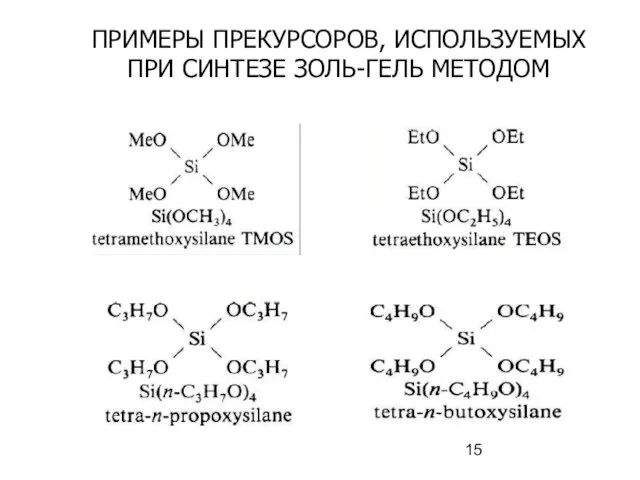
- 15. ПРИМЕРЫ ПРЕКУРСОРОВ, ИСПОЛЬЗУЕМЫХ ПРИ СИНТЕЗЕ ЗОЛЬ-ГЕЛЬ МЕТОДОМ
- 16. ПРИ СИНТЕЗЕ ЗОЛЬ-ГЕЛЬ МЕТОДОМ ИСПОЛЬЗУЮТСЯ СЛЕДУЮЩИЕ ЛИГАНДЫ АЛКОКСИДОВ Наибольшее применение находят алкоксиды d -элементов в высшей
- 17. ПОСЛЕДОВАТЕЛЬНОСТЬ ХИМИЧЕСКИХ ПРОЦЕСОВ ПРИ СИНТЕЗЕ ЗОЛЬ-ГЕЛЬ МЕТОДОМ С ИСПОЛЬЗОВАНИЕМ АЛКОКСИДОВ ЧАСТИЧНЫЙ ГИДРОЛИЗ АЛКОКСИДОВ ПОЛИКОНДЕНСАЦИЯ С ОБРАЗОВАНИЕМ
- 18. ЭФФЕКТ ВЛИЯНИЯ рН РАСТВОРА В зависимости от концентрации ионов H+ в растворе изменяется степень гидролиза прекурсоров,
- 19. 1. Al+3 + 3OH- = Al(OH)3 (s) Ksp0 = [Al+3][OH]3 Гидролиз многозарядных катионов является многоступенчатым и
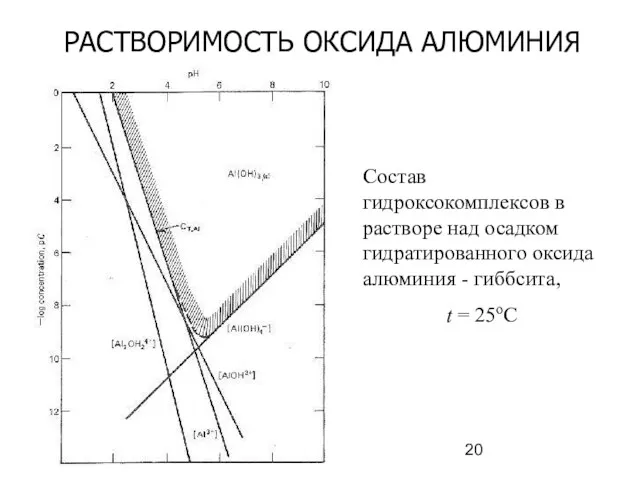
- 20. РАСТВОРИМОСТЬ ОКСИДА АЛЮМИНИЯ Состав гидроксокомплексов в растворе над осадком гидратированного оксида алюминия - гиббсита, t =
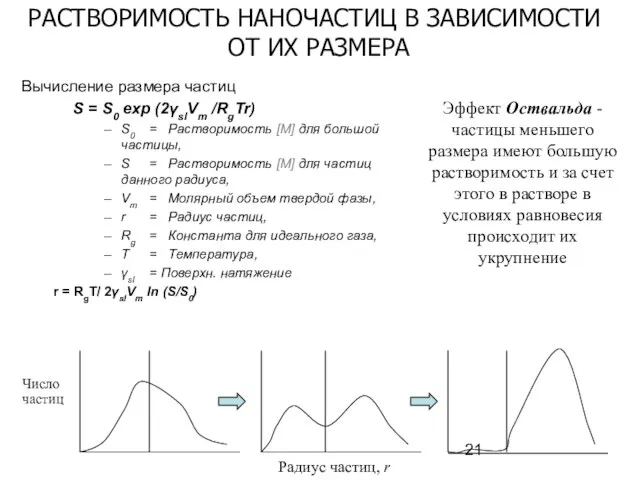
- 21. Вычисление размера частиц S = S0 exp (2γslVm /RgTr) S0 = Растворимость [M] для большой частицы,
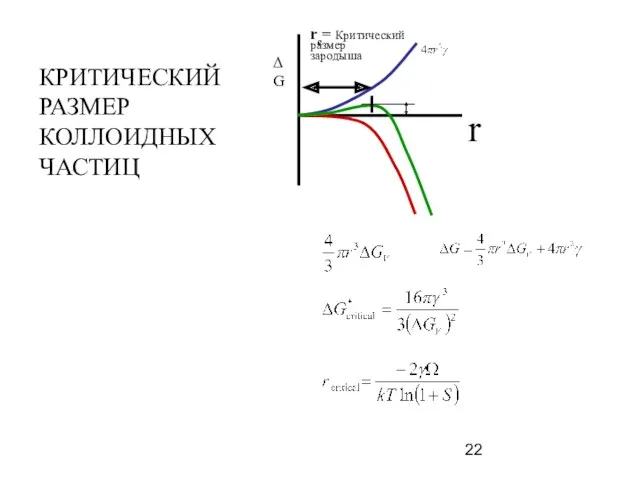
- 22. r ΔG rc= Критический размер зародыша КРИТИЧЕСКИЙ РАЗМЕР КОЛЛОИДНЫХ ЧАСТИЦ
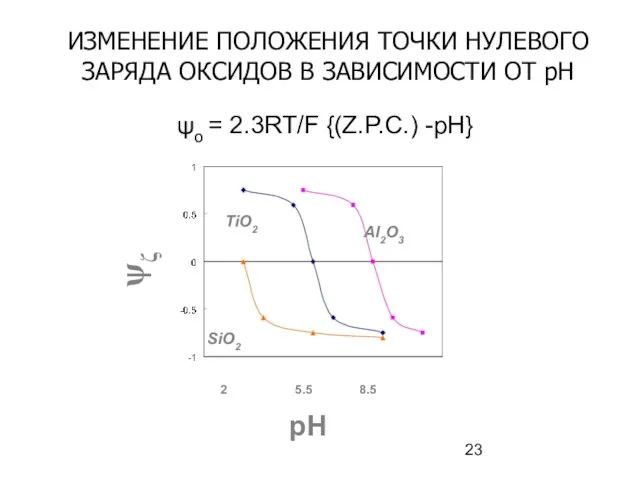
- 23. ψo = 2.3RT/F {(Z.P.C.) -pH} ψζ pH 2 5.5 8.5 Al2O3 TiO2 SiO2 ИЗМЕНЕНИЕ ПОЛОЖЕНИЯ ТОЧКИ
- 24. Точки нулевого заряда различных веществ
- 25. We Are H2O ВЛИЯНИЕ РАСТВОРИТЕЛЯ НАИБОЛЕЕ ЧАСТО В КАЧЕСТВЕ РАСТВОРИТЕЛЯ ИСПОЛЬЗУЮТ ВОДУ Для веществ, которые реагируют
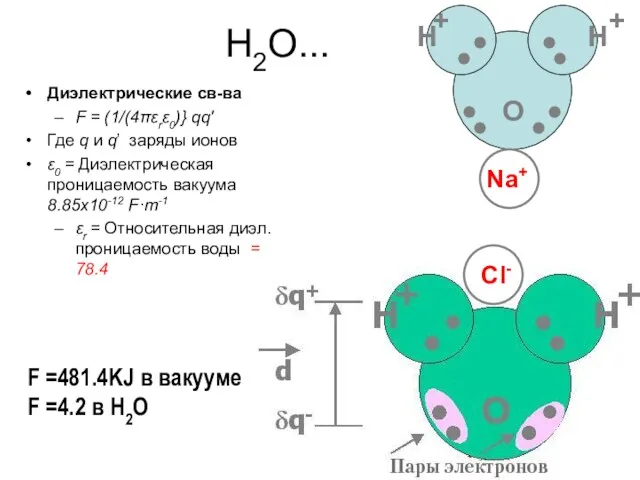
- 26. H2O... Диэлектрические св-ва F = (1/(4πεrε0)} qq′ Где q и q’ заряды ионов ε0 = Диэлектрическая
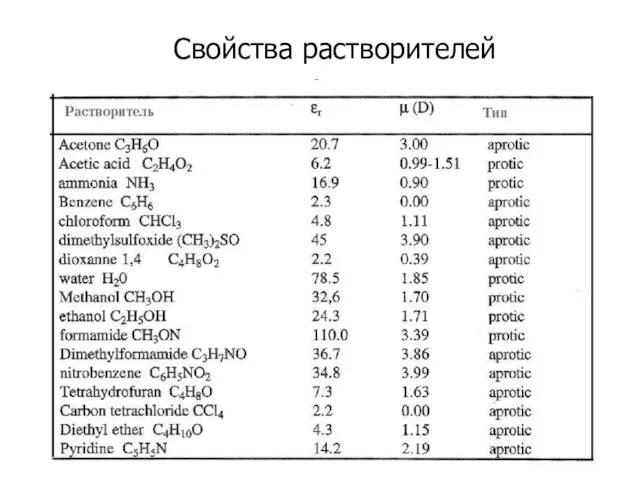
- 27. Свойства растворителей
- 28. ПРИ СИНТЕЗЕ МУЛЬТИКОМПОНЕНТНЫХ МАТЕРИАЛОВ ИСПОЛЬЗУЮТ ГЕТЕРО- И ОКСО- АЛКОКСИДЫ Например, при синтезе LiNbO3 используют [LiNb(OEt)6], а
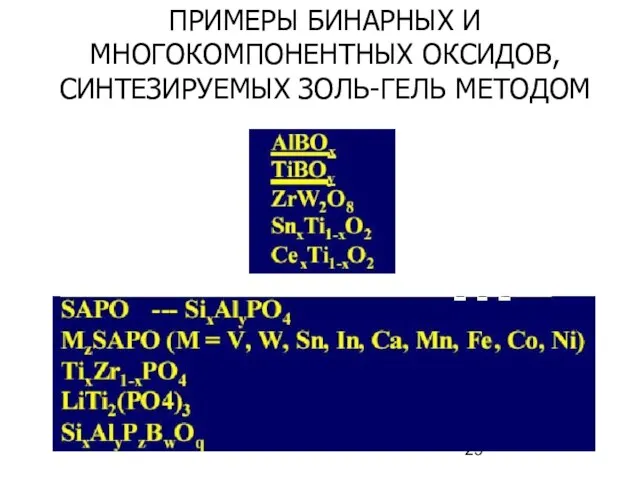
- 29. ПРИМЕРЫ БИНАРНЫХ И МНОГОКОМПОНЕНТНЫХ ОКСИДОВ, СИНТЕЗИРУЕМЫХ ЗОЛЬ-ГЕЛЬ МЕТОДОМ
- 30. СРАВНЕНИЕ УСЛОВИЙ СИНТЕЗА MgAl2O4 ЗОЛЬ -ГЕЛЬ МЕТОДОМ И МЕТОДОМ СПЕКАНИЯ ОКСИДОВ МЕТОД СПЕКАНИЯ ЗОЛЬ-ГЕЛЬ МЕТОД
- 31. Прямой синтез спеканием исходных прекурсоров при температуре 700оС дает смесь оксидов: СИНТЕЗ ЗОЛЬ-ГЕЛЬ МЕТОДОМ КРИСТАЛЛОВ ScMnO3
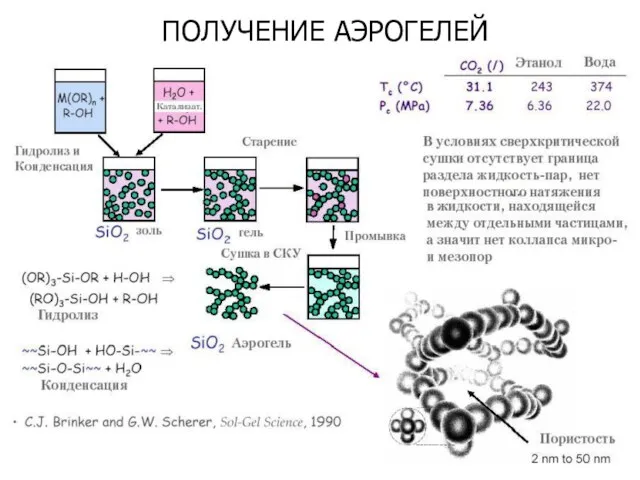
- 32. ПОЛУЧЕНИЕ АЭРОГЕЛЕЙ
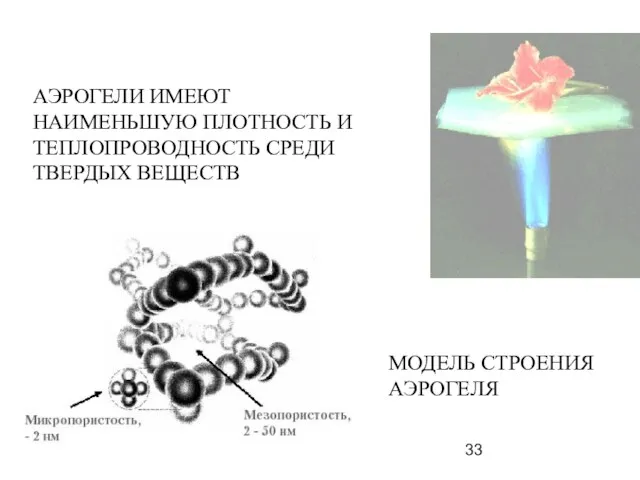
- 33. АЭРОГЕЛИ ИМЕЮТ НАИМЕНЬШУЮ ПЛОТНОСТЬ И ТЕПЛОПРОВОДНОСТЬ СРЕДИ ТВЕРДЫХ ВЕЩЕСТВ МОДЕЛЬ СТРОЕНИЯ АЭРОГЕЛЯ
- 34. Уникальные свойства аэрогелей Аэрогели относятся к самым легким в мире веществам и имеют самую низкую плотность
- 35. СИНТЕЗ КОМПОЗИЦИОННЫХ НАНОМАТЕРИАЛОВ НА ОСНОВЕ АЭРОГЕЛЕЙ На поверхности частиц аэрогеля могут быть получены слои других веществ
- 36. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА РАЗЛИЧНЫХ СПОСОБОВ МОДИФИЦИРОВАНИЯ ПОВЕРХНОСТИ ЧАСТИЦ АЭРОГЕЛЯ
- 37. Области применения нанокомпозитных материалов на основе аэрогелей В качестве теплоизоляторов. Аэрогели могут использоваться в качестве газовых
- 38. СИНТЕЗ ТОНКИХ ПЛЕНОК ЗОЛЬ-ГЕЛЬ МЕТОДОМ Синтез включает следующие шаги: 1. Приготовление растворов металл- алкоксидов и их
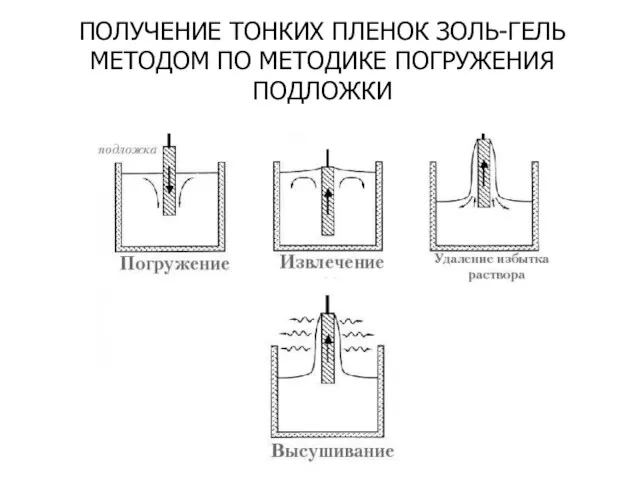
- 39. ПОЛУЧЕНИЕ ТОНКИХ ПЛЕНОК ЗОЛЬ-ГЕЛЬ МЕТОДОМ ПО МЕТОДИКЕ ПОГРУЖЕНИЯ ПОДЛОЖКИ
- 41. Скачать презентацию







![1. Al+3 + 3OH- = Al(OH)3 (s) Ksp0 = [Al+3][OH]3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/419964/slide-18.jpg)










 Простые механизмы
Простые механизмы Закон Ома для участка цепи, последовательное и параллельное соединение проводников. Физический диктант
Закон Ома для участка цепи, последовательное и параллельное соединение проводников. Физический диктант Teoria câmpului electromagnetic
Teoria câmpului electromagnetic Нормирование точности типовых элементов деталей машин
Нормирование точности типовых элементов деталей машин Получение и передача переменного электрического тока. Трансформатор
Получение и передача переменного электрического тока. Трансформатор Методическая разработка открытого занятия кружка по физике: Мыльная опера на все времена, или что такое...
Методическая разработка открытого занятия кружка по физике: Мыльная опера на все времена, или что такое... Проблемы механики при проектировании дронов пожарного назначения
Проблемы механики при проектировании дронов пожарного назначения Презентация к уроку Сила тока. Измерение силы тока
Презентация к уроку Сила тока. Измерение силы тока Синтез зубчатых передач
Синтез зубчатых передач Звуковые волны
Звуковые волны Классификация методов расчета полей нейтронов и гамма-квантов. Обзор методов расчета полей нейтронов и гамма-квантов
Классификация методов расчета полей нейтронов и гамма-квантов. Обзор методов расчета полей нейтронов и гамма-квантов Виды сил: тяжести, упругости, трения
Виды сил: тяжести, упругости, трения Проводники в электростатическом поле
Проводники в электростатическом поле Профессии, связанные с обработкой металла
Профессии, связанные с обработкой металла Электромобиль. Возможности и перспективы использования (7 класс)
Электромобиль. Возможности и перспективы использования (7 класс) Элементы теории поля. Векторное поле
Элементы теории поля. Векторное поле Давление твердых тел. 7 класс
Давление твердых тел. 7 класс Пневматична система
Пневматична система Физические методы измерений. Виды и методы измерений. (Лекция 1)
Физические методы измерений. Виды и методы измерений. (Лекция 1) Теории прочности горных пород
Теории прочности горных пород Нерелятивистская квантовая механика
Нерелятивистская квантовая механика Тема 6. Электромагнитные волны
Тема 6. Электромагнитные волны Магнит өрісі
Магнит өрісі Кинематика. Бірқалыпты түзу сызықты қозғалыс
Кинематика. Бірқалыпты түзу сызықты қозғалыс Презентация к уроку Диффузия. Движение молекул. (7 класс)
Презентация к уроку Диффузия. Движение молекул. (7 класс) Моторные масла
Моторные масла Технологическое обслуживание и ремонт легковых автомобилей
Технологическое обслуживание и ремонт легковых автомобилей Опиливание металла
Опиливание металла