Содержание
- 2. 1. Основные положения молекулярно-кинетической теории и их опытное обоснование. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального
- 3. Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул
- 4. Фактом, подтверждающим существование молекул, является возможность определить их массу и размеры (ионный микроскоп, рентгеноструктурный анализ, масс-спектроскопия,
- 5. Единица количества вещества называется молем. Моль равен количеству вещества, содержащего столько же частиц, сколько атомов содержится
- 6. Она показывает, сколько атомов или молекул содержится в одном моле вещества. Молярная масса - это масса
- 7. Молярная масса может быть вычислена через массу молекулы Mr, измеренную в атомных единицах массы.
- 8. Модель идеального газа предполагает следующее: молекулы обладают пренебрежимо малым объемом, между молекулами не действуют силы притяжения,
- 9. На основе использования законов динамики и положений молекулярно-кинетической теории было получено основное уравнение МКТ. где m0
- 10. Обозначив среднее значение кинетической энергии поступательного движения Е: получим
- 11. Если сосуд заполнили смесью газов, то давление смеси равно сумме парциальных давлений газов (закон Дальтона): .
- 12. 2. Температура. Связь температуры со скоростью движения молекул. Температурные шкалы
- 13. Состояние системы, при котором макроскопические параметры, характеризующие ее, остаются длительное время неизменными, называется тепловым равновесием.
- 14. Экспериментальные исследования показали, что для любых газов, находящихся в тепловом равновесии, отношение произведения давления газа на
- 15. Так как
- 16. Следовательно, средняя кинетическая энергия молекул любых газов, находящихся в тепловом равновесии одинакова. Величина Θ измеряется в
- 17. В физике обычно температуру измеряют в градусах, принимая, что температура Т и величина Θ связаны уравнением
- 18. Шкала измерения температуры в соответствии с этим уравнением называется абсолютной шкалой. Ее предложил английский физик У.Кельвин.
- 19. С введением постоянной Больцмана следует еще одно из уравнений молекулярно-кинетической теории
- 20. Сравнив последнее уравнение с уравнением Получим
- 21. Итак температура – есть мера средней кинетическая энергия хаотического движения молекул газа.
- 22. Исходя из этого, легко рассчитать среднюю квадратичную скорость движения молекул Соотношение подтверждено экспериментально (опыт Штерна).
- 23. 3. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Изотермический, изохорный и изобарный процессы
- 24. Используя зависимость давления газа от его температуры и концентрации молекул можно найти связь между основными макроскопическими
- 25. Число молекул газа где R=NAk называется универсальной газовой постоянной R=8,31 Дж/(моль К). Соотношение называют уравнением состояния
- 26. При неизменной массе газа величина Поэтому
- 27. Процессы, происходящие при неизменном значении одного из параметров состояния называются изопроцессами.
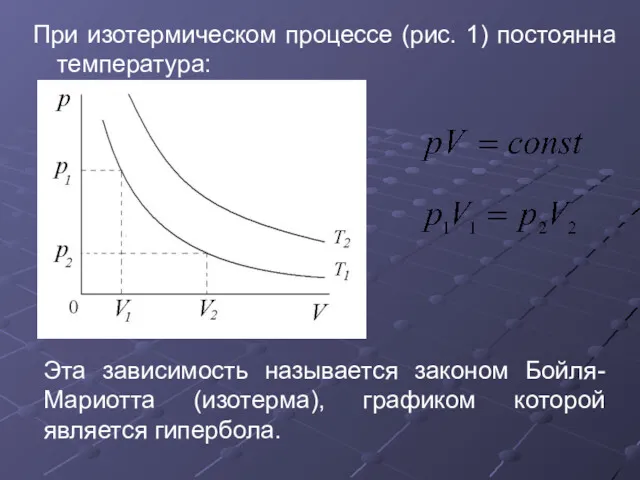
- 28. При изотермическом процессе (рис. 1) постоянна температура: Эта зависимость называется законом Бойля-Мариотта (изотерма), графиком которой является
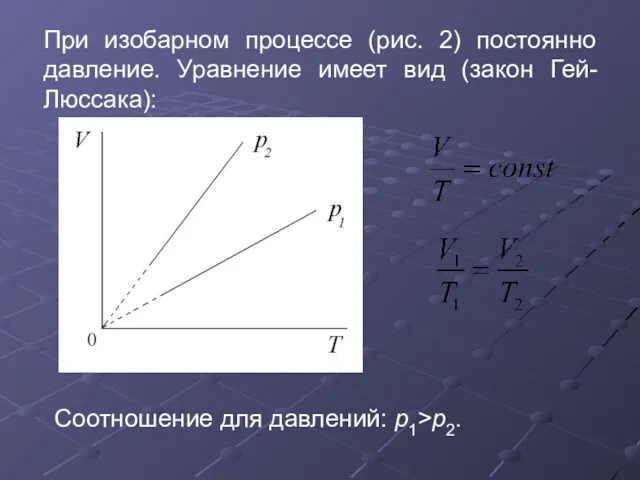
- 29. При изобарном процессе (рис. 2) постоянно давление. Уравнение имеет вид (закон Гей-Люссака): Соотношение для давлений: p1>p2.
- 30. Выбирая начальное состояние, соответствующее Т0=273К, запишем Соотношение связывает объем газа и его температуру (0С) при изобарном
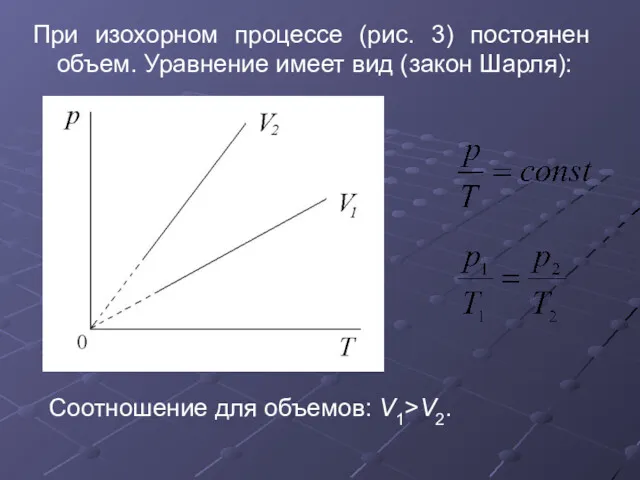
- 31. При изохорном процессе (рис. 3) постоянен объем. Уравнение имеет вид (закон Шарля): Соотношение для объемов: V1>V2.
- 33. Скачать презентацию



























 Двигатели внутреннего сгорания
Двигатели внутреннего сгорания Сущность электромагнитной теории Максвелла
Сущность электромагнитной теории Максвелла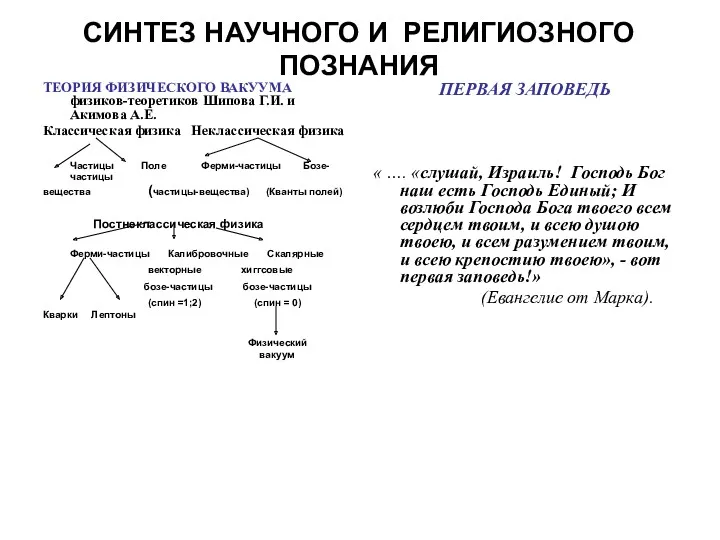 Синтез научного и религиозного познания. Теория физического вакуума
Синтез научного и религиозного познания. Теория физического вакуума ОГЭ по физике. Экспериментальное задание 23
ОГЭ по физике. Экспериментальное задание 23 Магнитное поле. Основные уравнения магнитостатики в вакууме. (Лекция 8)
Магнитное поле. Основные уравнения магнитостатики в вакууме. (Лекция 8) Взаимодействие рентгеновского излучения с веществом
Взаимодействие рентгеновского излучения с веществом Электродинамика курсындағы қолданбалы материалдар
Электродинамика курсындағы қолданбалы материалдар Режимы работы электродвигателей
Режимы работы электродвигателей ГАЗ 31029: Механика, технические характеристики, комплектация
ГАЗ 31029: Механика, технические характеристики, комплектация Механика. Работа и энергия
Механика. Работа и энергия Работа. Мощность. Энергия. 10 заданий
Работа. Мощность. Энергия. 10 заданий Решение задач на расчет массы и объёма тела по его плотности
Решение задач на расчет массы и объёма тела по его плотности Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул The Electric Field
The Electric Field к уроку физики в 7 классе на тему: Простые механизмы в картинках и задачи в картинках
к уроку физики в 7 классе на тему: Простые механизмы в картинках и задачи в картинках Презентация к уроку Интерференция
Презентация к уроку Интерференция Итоговый урок по теме Тепловые явления. Изменение агрегатных состояний вещества
Итоговый урок по теме Тепловые явления. Изменение агрегатных состояний вещества Direct Shift Gearbox. Коробки передач
Direct Shift Gearbox. Коробки передач Малая ядерная энергетика. Лекция 12
Малая ядерная энергетика. Лекция 12 Презентация к уроку физики в 10 классе Закон всемирного тяготения
Презентация к уроку физики в 10 классе Закон всемирного тяготения Презентации 7 класс: ВВЕДЕНИЕ
Презентации 7 класс: ВВЕДЕНИЕ Строение атома
Строение атома Властивості поверхні рідини. Поверхневий натяг рідини
Властивості поверхні рідини. Поверхневий натяг рідини Типы фотоэлементов. Давление света. Понятие о корпускулярно-волновой теории света
Типы фотоэлементов. Давление света. Понятие о корпускулярно-волновой теории света Тепловое движение атомов и молекул. Диффузия. Модели строения газа, жидкости, твердого тела
Тепловое движение атомов и молекул. Диффузия. Модели строения газа, жидкости, твердого тела Тема урока. Решение задач по теме: Электрические явления.
Тема урока. Решение задач по теме: Электрические явления. Испытания автомобильных двигателей
Испытания автомобильных двигателей Қыздыру үдерістері
Қыздыру үдерістері