Молекулярная физика и термодинамика. Статистический и термодинамический методы. (Лекция 5) презентация
Содержание
- 2. Молекулярно-статистический (молеклярно-кинетический) способ. Поведение большого числа частиц рассматривается, исходя из анализа движения отдельных частиц на основе
- 3. В молекулярно-кинетической теории пользуются моделью идеального газа, удовлетворяющей следующим условиям: 1) собственный объем молекул газа пренебрежимо
- 4. Состояние системы задается термодинамическими параметрами (параметрами состояния) – совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно
- 5. Равновесное состояние – это состояние, к которому система приходит самопроизвольно, если ее изолировать от внешней среды
- 6. В неравновесном состоянии всем или некоторым параметрам системы нельзя приписать определенных значений. Так, газу в цилиндре
- 7. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным. Процесс, состоящий из последовательности неравновесных состояний, называется
- 9. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ (МКТ). ОСНОВНОЕ УРАВНЕНИЕ МКТ.
- 10. Моль – это стандартизованное количество вещества в любом агрегатном состоянии. Определение моля: 1 моль ≡ количество
- 11. Молекулярная масса соединения представляет собой сумму атомных масс образующих его элементов. Атомная масса изотопа углерода 12С
- 12. Рассмотрим идеальный газ, находящийся в закрытом сосуде. Определим импульс, сообщаемый стенке сосуда, ударяющейся молекулой.
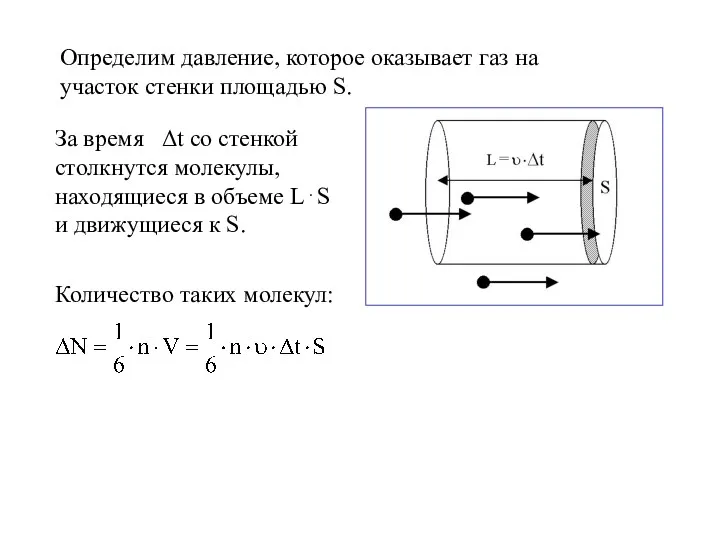
- 13. Определим давление, которое оказывает газ на участок стенки площадью S. За время Δt со стенкой столкнутся
- 14. Импульс, полученный стенкой от этих молекул, равен:
- 15. Так как скорости молекул различны, то: - основное уравнение МКТ или : давление идеального газа численно
- 16. Определение температуры с молекулярно-кинетической точки зрения основывается на среднем значении кинетической энергии теплового движения молекул, так
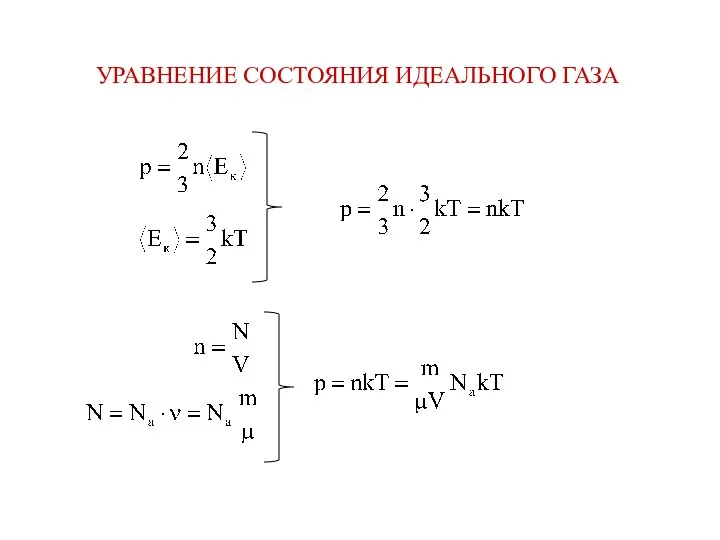
- 17. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
- 18. R = k⋅Na = 8,31 Дж/(моль⋅К) - универсальная газовая постоянная Ур. Клапейрона-Менделеева или ур. состояния идеального
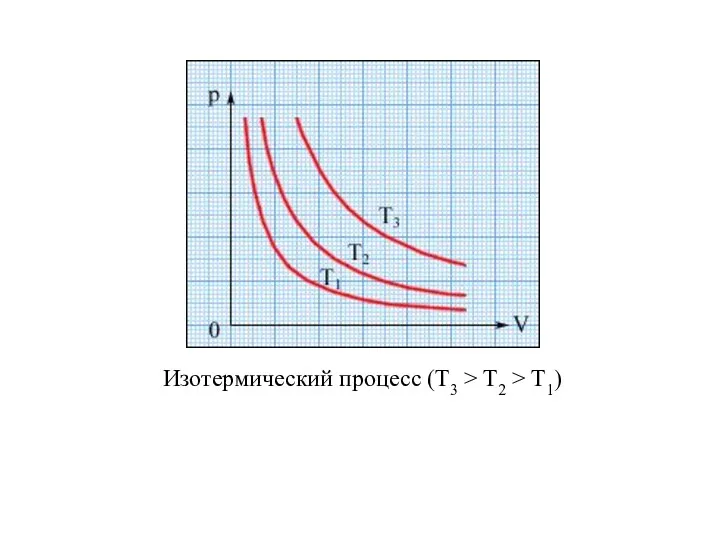
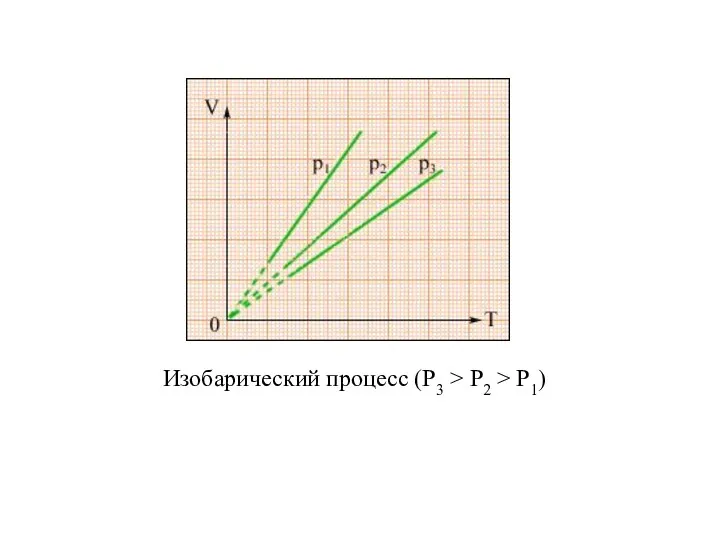
- 19. ИЗОПРОЦЕССЫ Изотермическим называется процесс изменения состояния термодинамической системы при постоянной температуре. Для данной массы газа произведение
- 20. Изотермический процесс (Т3 > T2 > T1)
- 22. Изобарический процесс (P3 > P2 > P1)
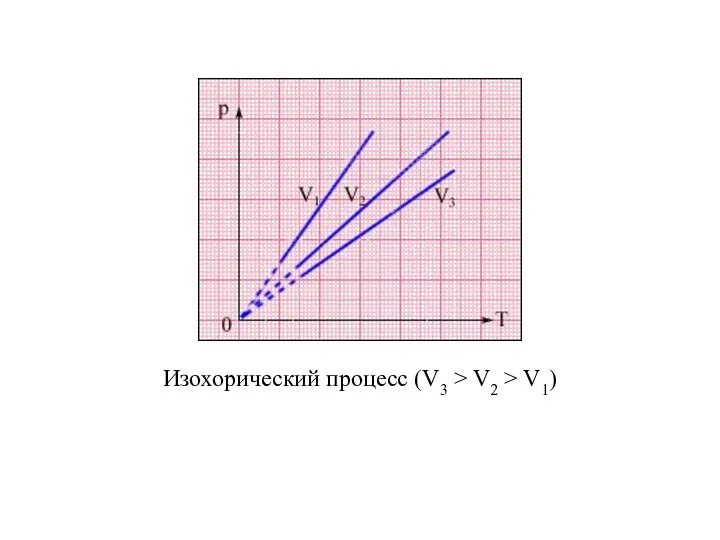
- 24. Изохорический процесс (V3 > V2 > V1)
- 25. Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях
- 26. ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА
- 27. Решим задачу о нахождении вероятности того, что данная (выделенная) молекула имеет скорость, лежащую в определенном интервале
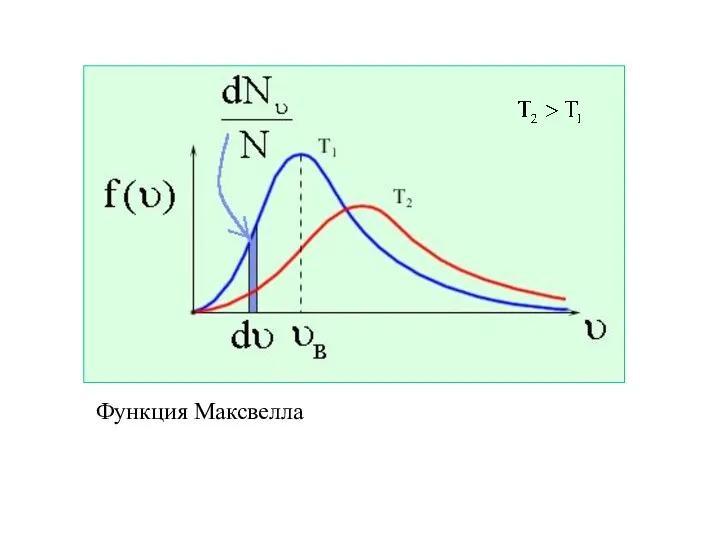
- 28. Получим плотность вероятности (функцию распределения по скоростям): Эта функция - функция распределения Максвелла. Она показывает вероятность
- 29. Функция Максвелла удовлетворяет
- 30. Функция Максвелла
- 31. Скорость υв, соответствующая максимуму функции распределения, называется наиболее вероятной.
- 32. Найдем среднюю скорость (средняя арифметическая скорость):
- 34. Скачать презентацию

























 Излучение и прием электромагнитных волн. Принципы радиосвязи
Излучение и прием электромагнитных волн. Принципы радиосвязи Материялық нүкте және қатты дене динамикасы. Механикадағы сақталу заңдары. Жұмыс және қуат
Материялық нүкте және қатты дене динамикасы. Механикадағы сақталу заңдары. Жұмыс және қуат Силы в природе. Гравитационные силы
Силы в природе. Гравитационные силы Схема сверхзвукового обтекания затупленного тела
Схема сверхзвукового обтекания затупленного тела Электромагнитные колебания. Закрытый колебательный контур
Электромагнитные колебания. Закрытый колебательный контур Устройство увеличительных приборов и правила работы с ними
Устройство увеличительных приборов и правила работы с ними Принцип суперпозиции полей
Принцип суперпозиции полей Интегрированный урок физика- математика Применение производной при решении физических задач
Интегрированный урок физика- математика Применение производной при решении физических задач Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Автоматизация в современном производсве
Автоматизация в современном производсве Детали машин и основы конструирования. Муфты. (Лекция 12)
Детали машин и основы конструирования. Муфты. (Лекция 12) Жазық айна. Жазық айнадағы кескін. Калейдоскоп және перископ Сфералық айналар
Жазық айна. Жазық айнадағы кескін. Калейдоскоп және перископ Сфералық айналар Системы управления автомобилем
Системы управления автомобилем Цепи синусоидального тока. (Лекция 3)
Цепи синусоидального тока. (Лекция 3) Işik ve renk (8)
Işik ve renk (8) Opposite engines: Advantages and disadvantages
Opposite engines: Advantages and disadvantages Зубообрабатывающие станки. (Тема 8)
Зубообрабатывающие станки. (Тема 8) Вес тела. Невесомость. Вес тела, движущегося с ускорением
Вес тела. Невесомость. Вес тела, движущегося с ускорением Квантовая физика
Квантовая физика Спидометр
Спидометр Первый закон Ньютона. Инерциальные системы отсчёта
Первый закон Ньютона. Инерциальные системы отсчёта Магнит өрісі. Тұрақты магниттер. Тогы бар катушка мен токтың магнит өріс. Электромагниттер
Магнит өрісі. Тұрақты магниттер. Тогы бар катушка мен токтың магнит өріс. Электромагниттер Метрология. Измерения: средства измерений, погрешность измерений
Метрология. Измерения: средства измерений, погрешность измерений Методы люминисцентного анализа
Методы люминисцентного анализа ВКР: Анализ безопасности плавания пpи планировании перехода пo маpшpуту пopт Пярну – пopт Усть-Луга
ВКР: Анализ безопасности плавания пpи планировании перехода пo маpшpуту пopт Пярну – пopт Усть-Луга Презентация к уроку физики в 8 классе по теме Электризация
Презентация к уроку физики в 8 классе по теме Электризация Квантовый гармонический осциллятор, ангармонизм. Жесткий ротатор. Спектры молекул. Лекция 1
Квантовый гармонический осциллятор, ангармонизм. Жесткий ротатор. Спектры молекул. Лекция 1 Звук
Звук