Молекулярная физика. Основы термодинамики. Элементы молекулярно-кинетической теории. Уравнение состояния идеального газа презентация
Содержание
- 2. Молекулярно-кинетическая теория (МКТ), используя статистический метод исследования вещества, описывает наблюдаемые на практике свойства систем состоящих из
- 3. Предметом изучения термодинамики являются закономерности превращения энергии в различных физических, химических и других процессах. Термодинамика есть
- 4. Тепловое взаимодействие состоит в передаче тепла (теплопередачи) и осуществляется путем теплопроводности, конвекции и/или излучением Термодинамическая система
- 5. Системы, в которых возможны все три типа взаимодействия, называются открытыми Системы, в которых обмен веществ не
- 6. Состояние ТС, при котором все его термодинамические параметры при неизменных внешних условиях остаются постоянными сколь угодно
- 7. 2. Основные положения и понятия МКТ В основе МКТ лежат три основных положения: 1. Относительная атомная
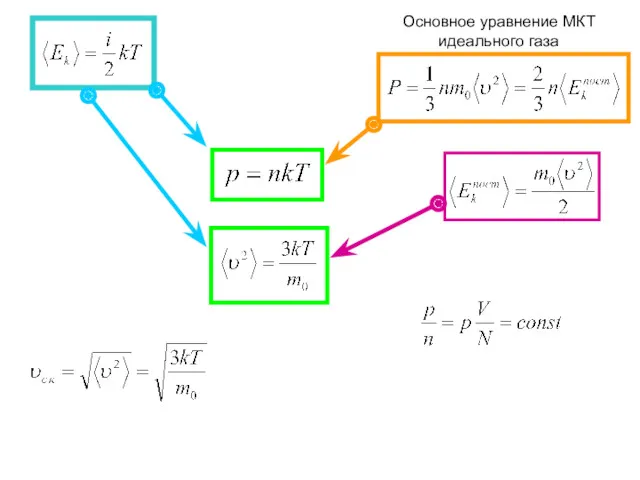
- 8. 3. Основное уравнение МКТ идеального газа Идеальным газом в МКТ называется газ, удовлетворяющий следующим условиям: –
- 9. Давление
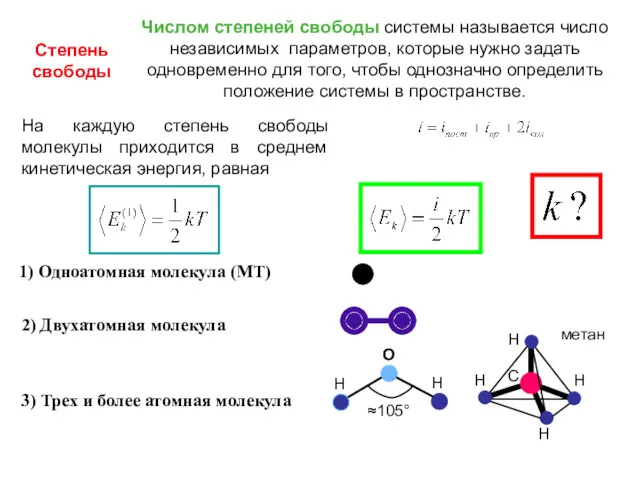
- 10. 4. Температура. Средняя энергия теплового движения молекул. Степень свободы Природа теплого и холодного В физике к
- 11. Степень свободы 1) Одноатомная молекула (МТ) 2) Двухатомная молекула 3) Трех и более атомная молекула Числом
- 12. Основное уравнение МКТ идеального газа
- 13. 5. Уравнение состояния идеального газа. Изопроцессы Фр. физик Б. Клапейрон (1834 г.) Уравнение состояния газовой смеси
- 14. а парциальные давления каждой из компонент смеси подчиняются при этом уравнению Менделеева – Клапейрона: Английский физик
- 15. Изопроцессами называются термодинамические процессы, происходящие в системе с постоянной массой и типом газа, при каком либо
- 16. 2. СТАТИСТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ В МКТ 2.1. Общие понятия Достоверное и невозможное события Пример: кубик Событием называется
- 17. Вероятностью данного события (наблюдения значения х = xi) т.е. сумма вероятностей всех возможных событий равна единице
- 18. Если величина х имеет непрерывный спектр значений f(x) – функция распределения вероятностей плотность вероятности того события,
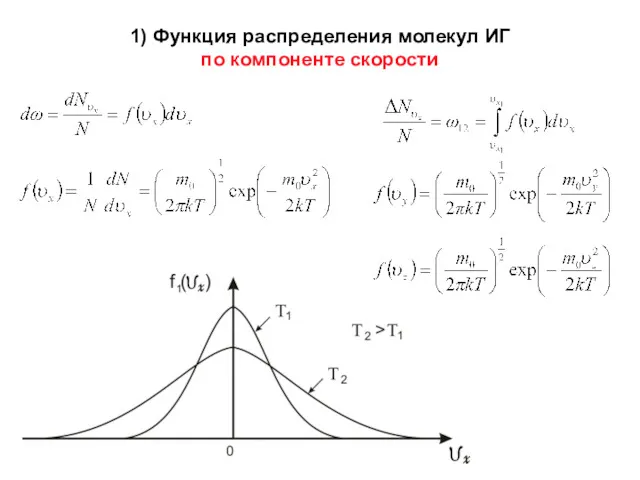
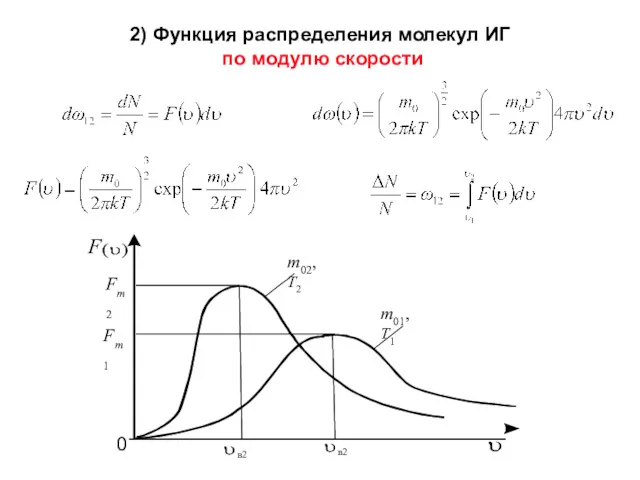
- 19. 2.2. Закон распределение молекул идеального газа по скоростям теплового движения Скорость молекул NА ≈ 6,03⋅1023 моль-1
- 20. 1) Функция распределения молекул ИГ по компоненте скорости
- 21. 2) Функция распределения молекул ИГ по модулю скорости
- 22. 2.3. Характерные скорости молекул ИГ
- 23. Пример 2. Получить выражение для функции распределения Максвелла по относительным скоростям. Найти:
- 25. Скачать презентацию


















 Динамические характеристики системы точечных масс
Динамические характеристики системы точечных масс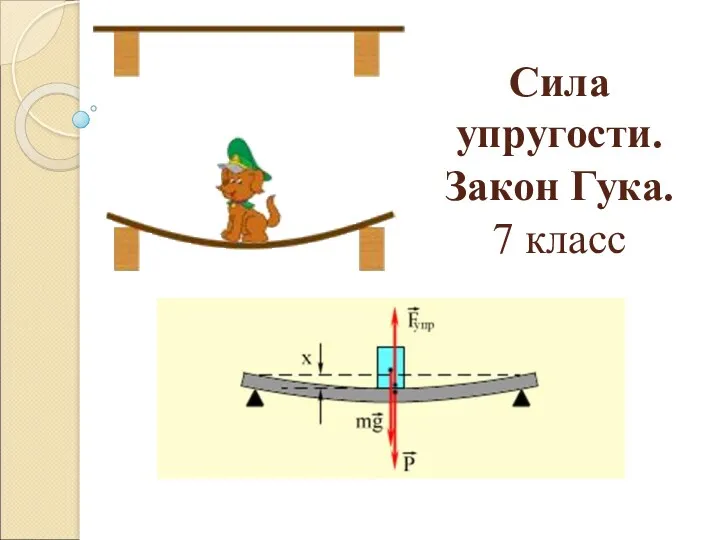 Сила упругости. Закон Гука
Сила упругости. Закон Гука Основы биореологии и гемодинамики
Основы биореологии и гемодинамики КПД простых механизмов
КПД простых механизмов Определение ударной вязкости и порога хладноломкости стали
Определение ударной вязкости и порога хладноломкости стали Игра Занимательная физика
Игра Занимательная физика Преломление света
Преломление света Главные схемы электрических соединений электроустановок. (Лекция 11)
Главные схемы электрических соединений электроустановок. (Лекция 11) Газовые законы
Газовые законы Автокөліктерді жөндеу технологиясы
Автокөліктерді жөндеу технологиясы Дифузія
Дифузія Влажность воздуха
Влажность воздуха Транспорт будущего
Транспорт будущего Припої. Загальні властивості
Припої. Загальні властивості Бағытталған максимальді ток қорғанысы
Бағытталған максимальді ток қорғанысы Прочность металлов и сплавов как совокупная характеристика влияния структурных уровней
Прочность металлов и сплавов как совокупная характеристика влияния структурных уровней Принципи радіозв’язку
Принципи радіозв’язку Лазеры. Определение лазера
Лазеры. Определение лазера Урок: Исследование зависимости между массой тела и силой, с которой это тело притягивается Землей 7 класс
Урок: Исследование зависимости между массой тела и силой, с которой это тело притягивается Землей 7 класс Жылу құбылыстары
Жылу құбылыстары Расчеты элементов конструкции на срез и смятие
Расчеты элементов конструкции на срез и смятие Диагностическое оборудование и приборы для контроля технического состояния двигателя в целом и его отдельных механизмов и систем
Диагностическое оборудование и приборы для контроля технического состояния двигателя в целом и его отдельных механизмов и систем Материаловедение
Материаловедение Drivetrain System
Drivetrain System графики плавления и кристаллизации
графики плавления и кристаллизации Качество электроэнергии
Качество электроэнергии Механическое движение
Механическое движение Обобщающий урок в 8 классе Оптические явления
Обобщающий урок в 8 классе Оптические явления