Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы презентация
Содержание
- 2. Повторение Перечислите основные положения МКТ. Дайте определение относительной молекулярной массы. Что такое количество вещества? Что такое
- 3. "изос"-от греческого слова "равный" Уравнение состояния идеального газа.
- 4. Изопроцессы в газах Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. Рассмотрим следующие изопроцессы:
- 5. (Название процесса)
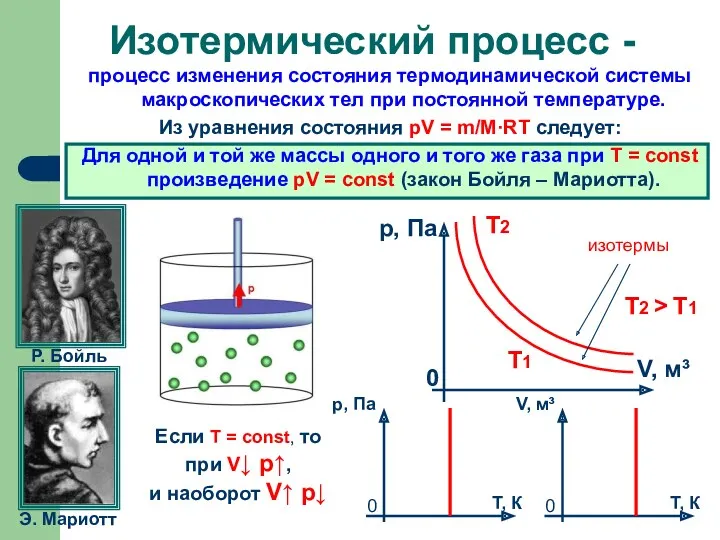
- 6. Изотермический процесс
- 7. Для данной массы данного вещества, произведение давления газа на его объем постоянно, если температура газа не
- 8. процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре. Из уравнения состояния pV = m/M·RT
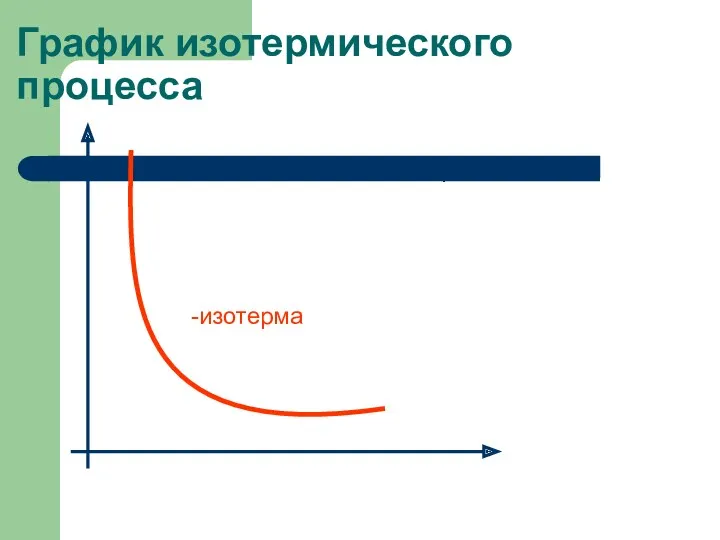
- 9. График изотермического процесса -изотерма p V =const
- 10. (Название процесса)
- 11. Изобарный процесс
- 12. Для данной массы данного вещества, отношение объема газа к его температуре постоянно, если давление не меняется.
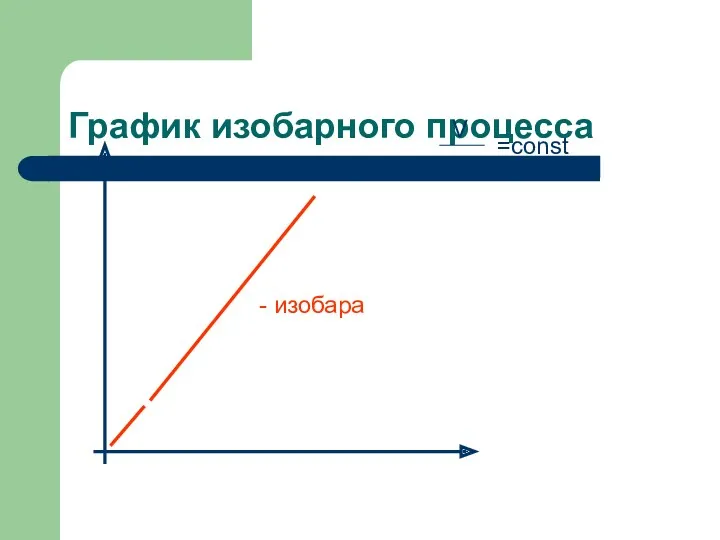
- 13. График изобарного процесса - изобара V T =const
- 14. процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Из уравнения состояния pV = m/M·RT
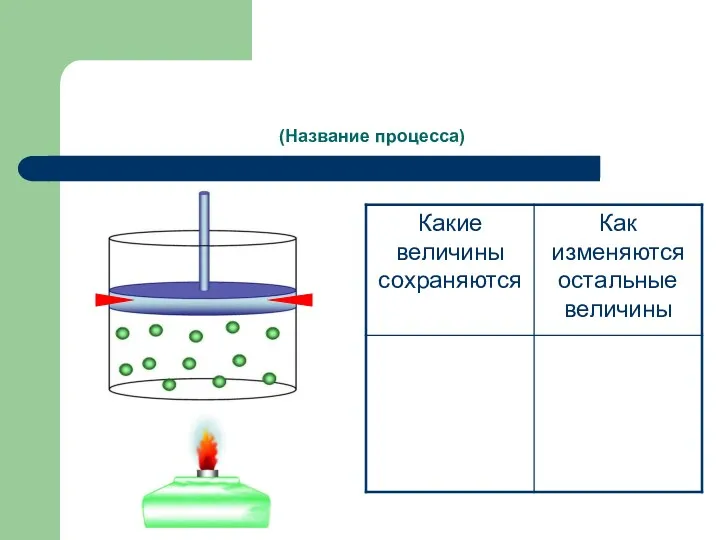
- 15. (Название процесса)
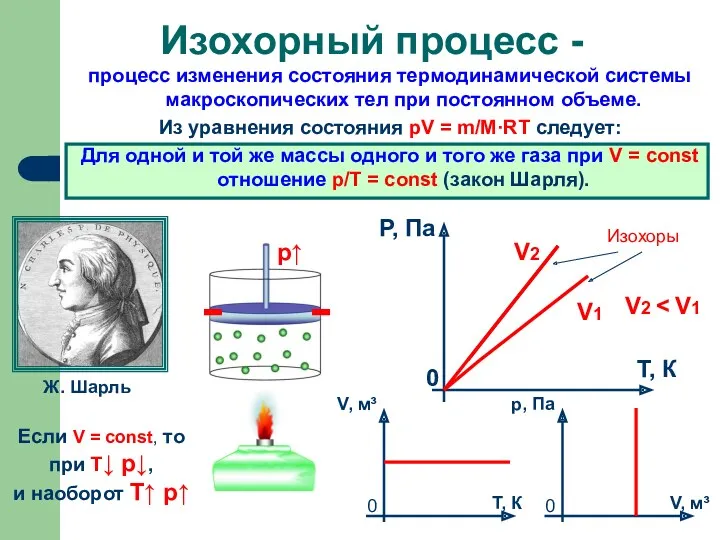
- 16. Изохорный процесс
- 17. Для данной массы данного вещества, отношение давления газа к температуре постоянно, если объем не меняется. Закон
- 18. График изохорного процесса -изохора p Т =const
- 19. процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме. Из уравнения состояния pV = m/M·RT
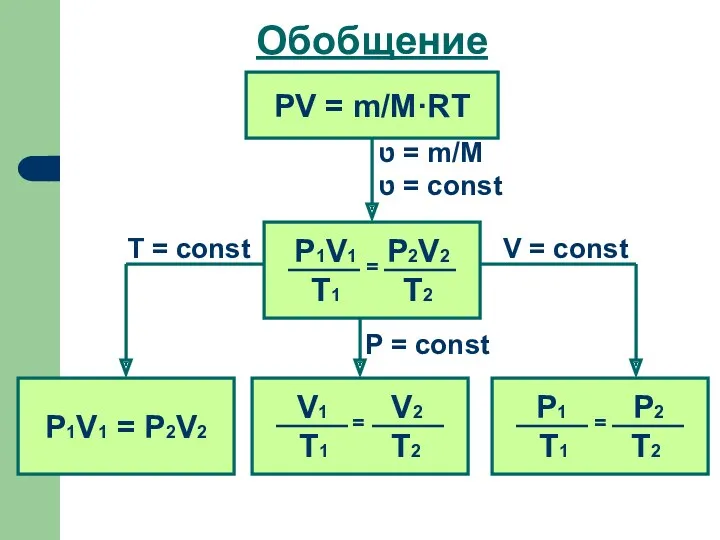
- 20. Обобщение PV = m/M·RT ט = m/M ט = const P1V1 = P2V2 V = const
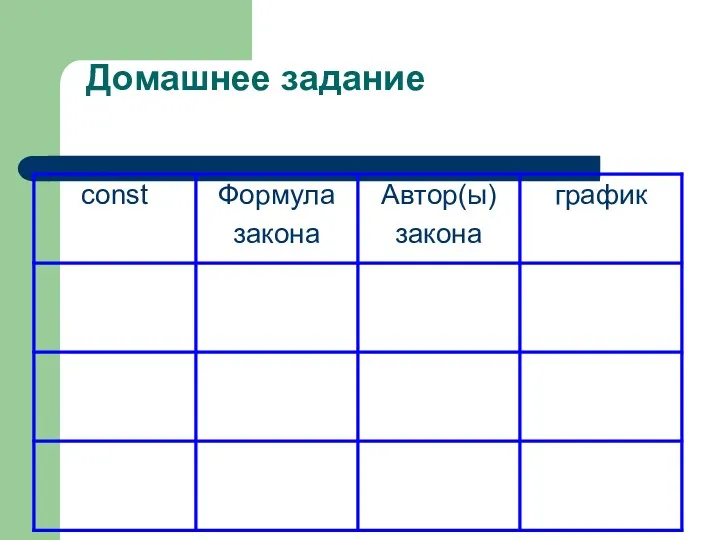
- 21. Домашнее задание
- 22. запомни и используй! Любой газовый закон получают из уравнения состояния идеального газа. Выучи уравнение - получи
- 23. Задача: На рисунке дан график изменения состояния идеального газа в координатах V,T.Представьте этот процесс на графиках
- 25. Скачать презентацию














 Устройство и принципы работы жидкостного и металлического манометров
Устройство и принципы работы жидкостного и металлического манометров Деформация тела. Сила упругости. Закон Гука
Деформация тела. Сила упругости. Закон Гука Микроструктурные эффекты в порошковой дифракции и методы их описания
Микроструктурные эффекты в порошковой дифракции и методы их описания Электроразведка. Бакалавриат
Электроразведка. Бакалавриат Электромагнитная индукция
Электромагнитная индукция Паровая машина. Паровой двигатель Уатта
Паровая машина. Паровой двигатель Уатта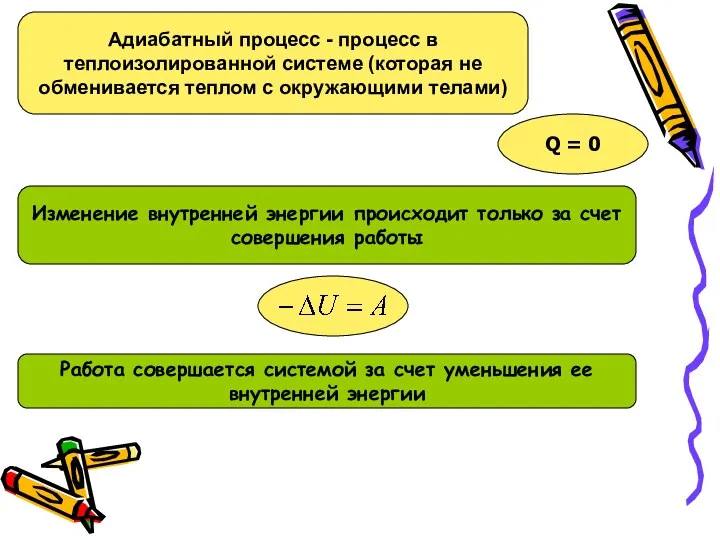 Адиабатный процесс
Адиабатный процесс Масса, плотность, объем. 7 класс
Масса, плотность, объем. 7 класс Профессия автомеханик
Профессия автомеханик Техническое обслуживание и ремонт систем энергообеспечения и запуска двигателя
Техническое обслуживание и ремонт систем энергообеспечения и запуска двигателя Електрична провідність матеріалів: провідники, напівпровідники та діелектрики. Струм у металах
Електрична провідність матеріалів: провідники, напівпровідники та діелектрики. Струм у металах Объемные резонаторы
Объемные резонаторы Әр түрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі
Әр түрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі Технология ультразвукового контроля узлов и агрегатов электропоезда
Технология ультразвукового контроля узлов и агрегатов электропоезда Равномерное движение по окружности
Равномерное движение по окружности Эксергетический КПД сушильной установки
Эксергетический КПД сушильной установки Реальные газы. Равновесие фаз
Реальные газы. Равновесие фаз Изобретение радио. Принципы радиосвязи. Телевидение
Изобретение радио. Принципы радиосвязи. Телевидение Урок физики в 7 классе Способы изменения давления Урок физики №32 в 7-м классе на тему Способы изменения давления
Урок физики в 7 классе Способы изменения давления Урок физики №32 в 7-м классе на тему Способы изменения давления Теплота сгорания топлива
Теплота сгорания топлива Инфракрасная спектроскопия
Инфракрасная спектроскопия Распределительное устройство 10 кВ
Распределительное устройство 10 кВ Воздухоплавание. Плавание судов
Воздухоплавание. Плавание судов Архимедова сила
Архимедова сила Соединения. Резьбовые, сварные, заклепочные, шпоночные, шлицевые, штифтовые, гладкие соединения
Соединения. Резьбовые, сварные, заклепочные, шпоночные, шлицевые, штифтовые, гладкие соединения Система передачи информации
Система передачи информации Энергия топлива. Теплота сгорания топлива
Энергия топлива. Теплота сгорания топлива Смачивание и капиллярные явления. Урок 6. Физика. 8 класс
Смачивание и капиллярные явления. Урок 6. Физика. 8 класс