Содержание
- 2. 4. Изменения энтропии при обратимых и необратимых процессах Итак, энтропия – отношение полученной или отданной системой
- 3. Обратимый цикл Карно Мы знаем, что, в тепловой машине, работающей по принципу Карно, имеются три тела:
- 4. Изменение энтропии нагревателя: (4.1) Для холодильника: (4.2) А т.к.
- 5. то , т.е. или (4.3) т.е. S – константа. Это выражение называют равенство Клаузиуса.
- 6. Необратимый цикл Мы знаем, что т.е., (4.4) Отсюда тогда
- 7. Таким образом или (4.5) Это неравенство Клаузиуса. При любом необратимом процессе в замкнутой системе энтропия возрастает
- 8. Тогда для замкнутой системы (4.7) – математическая запись второго начала термодинамики. Таким образом, для произвольного процесса,
- 9. 5. Второе начало термодинамики Термодинамика, это наука о тепловых процессах, о превращении тепловой энергии. Для описания
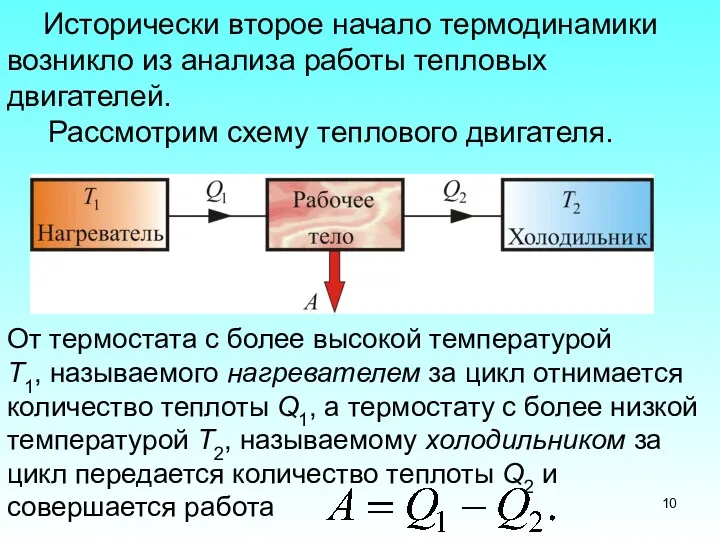
- 10. Исторически второе начало термодинамики возникло из анализа работы тепловых двигателей. Рассмотрим схему теплового двигателя. От термостата
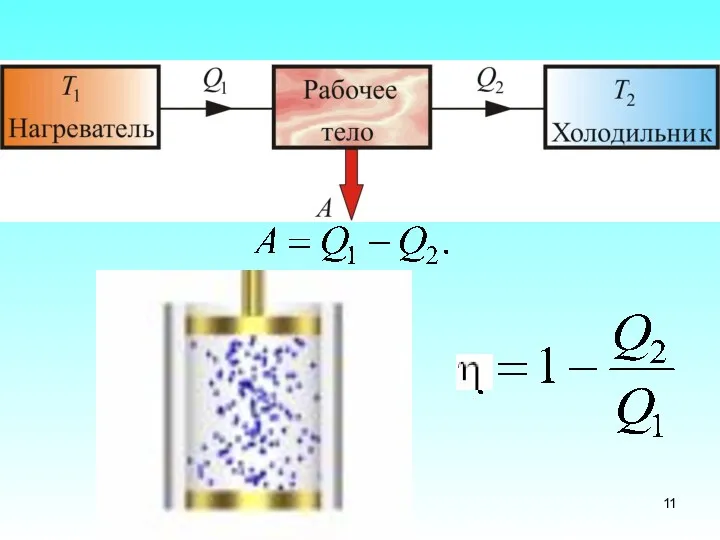
- 12. Чтобы термический коэффициент полезного действия теплового двигателя был , должно быть выполнено условие , т.е. тепловой
- 13. 1. Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя в эквивалентную ей
- 14. Математической формулировкой второго начала является выражение Энтропия замкнутой системы при любых происходивших в ней процессах не
- 15. При обратимомном процессе (5.1) При необратимом процессе, как доказал Клаузиус (5.2) − изменение энтропии больше приведенной
- 16. Первое и второе начала термодинамики в объединенной форме имеют вид: (5.4)
- 17. 6. Свободная и связанная энергии Как следует из первого и второго начала термодинамики в объединенной форме
- 18. Обозначим, , где F – разность двух функций состояний, поэтому сама является также функцией состояния. Ее
- 19. следовательно свободная энергия есть та работа, которую могло бы совершить тело в обратимом изотермическом процессе или,
- 20. Связанная энергия – та часть внутренней энергии, которая не может быть превращена в работу – это
- 21. В термодинамике есть еще понятие – энергетическая потеря в изолированной системе (6.3)
- 22. При любом необратимом процессе энтропия увеличивается до того, пока не прекратятся какие-либо процессы, т.е. пока не
- 23. 7. Статистический смысл энтропии Посмотрим на энтропию с другой стороны.
- 24. Макросостояние – это состояние вещества, характеризуемое его термодинамическими параметрами. Состояние же системы, характеризуемое состоянием каждой входящей
- 25. Термодинамической вероятностью или статистическим весом макросостояния W − называется число микросостояний, осуществляющих данное макросостояние (или число
- 26. В состоянии равновесия в термодинамике и вероятность максимальна и энтропия максимальна. Из этого можно сделать вывод,
- 27. А вероятность сложного события, есть произведение вероятностей где W1 – первое состояние; W2 – второе состояние.
- 28. Больцман предложил, что (7.1) где k – коэффициент Больцмана. С этой точки зрения энтропия выступает, как
- 29. Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии
- 30. Энтропия – вероятностная статистическая величина. Утверждение о возрастании энтропии потеряло свою категоричность. Её увеличение вероятно, но
- 31. Российские физики Я.Б. Зельдович и И.Д. Новиков, так же опровергли эту теорию, и показали, что Р.
- 32. 8. Третье начало термодинамики Недостатки первого и второго начал термодинамики в том, что они не позволяют
- 33. Нернст Вальтер Фридрих Герман (1864 – 1941) – немецкий физик и физико- химик, один из основоположников
- 34. Согласно Нернсту, изменение энтропии ΔS стремится к нулю при любых обратимых изотермических процессах, совершаемых между двумя
- 35. Как первое и второе начала термодинамики, теорема Нернста может рассматриваться как результат обобщения опытных фактов, поэтому
- 36. Отсюда следует, что при T → 0 интеграл сходится на нижнем пределе, т.е. имеет конечное значение
- 37. При T = 0, внутренняя энергия и тепловая функция системы прекращают зависеть от температуры, кроме того,
- 38. Согласно классическим представлениям при абсолютном нуле, возможно непрерывное множество микросостояний системы. Объяснение теоремы Нернста можно дать
- 39. Третье начало термодинамики иногда формулируют следующим образом: при абсолютном нуле температуры любые изменения термодинамической системы происходят
- 40. Принцип Нернста бал развит Планком, предположившим, что при абсолютном нуле температуры энергия системы минимальна (но не
- 42. Скачать презентацию





































 Частотно-независимые антенны. Лекция № 12. АФУ
Частотно-независимые антенны. Лекция № 12. АФУ Экзамен ПМ 01. Билет № 4. Такелажные работы при монтаже технологического оборудования и трубопроводов
Экзамен ПМ 01. Билет № 4. Такелажные работы при монтаже технологического оборудования и трубопроводов Конденсаторы. Классификация конденсаторов
Конденсаторы. Классификация конденсаторов боготол отчий
боготол отчий Теплотехника. Недостатки поршневых ДВС. (Лекция 9)
Теплотехника. Недостатки поршневых ДВС. (Лекция 9) Аеродинаміка та динаміка польоту літака. Характеристики профілю крила. Поздовжні аеродинамічні сили та момент. (Лекція 3.2.1)
Аеродинаміка та динаміка польоту літака. Характеристики профілю крила. Поздовжні аеродинамічні сили та момент. (Лекція 3.2.1) Кинематический анализ шарнирно-рычажных механизмов
Кинематический анализ шарнирно-рычажных механизмов Магнитопорошковая дефектоскопия сварных швов
Магнитопорошковая дефектоскопия сварных швов Фотоаппарат. Виды линз
Фотоаппарат. Виды линз Фундаментальные концепции физического описания природы
Фундаментальные концепции физического описания природы Проект “Дизельный двигатель”
Проект “Дизельный двигатель” Итоговый урок по теме Тепловые явления. Изменение агрегатных состояний вещества
Итоговый урок по теме Тепловые явления. Изменение агрегатных состояний вещества Ефект Доплера
Ефект Доплера открытый урок-презентация на тему История Российской атомной энергетики
открытый урок-презентация на тему История Российской атомной энергетики Молекулярно-кинетическая теория
Молекулярно-кинетическая теория Динамика движения материальной точки. Законы Ньютона. Лекция 3
Динамика движения материальной точки. Законы Ньютона. Лекция 3 ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ
ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ Метаматеріали. Фізичні принципи, покладені в основу метаматеріалів
Метаматеріали. Фізичні принципи, покладені в основу метаматеріалів Основные термодинамические процессы идеального газа
Основные термодинамические процессы идеального газа Магнитное поле
Магнитное поле Давление. Сила давления
Давление. Сила давления Физика в познании вещества, поля, пространства и времени.
Физика в познании вещества, поля, пространства и времени. Глаз и зрение
Глаз и зрение 20231111_prilozhenie1._prezentatsiya_prostye_mehanizmy
20231111_prilozhenie1._prezentatsiya_prostye_mehanizmy Постоянный электрический ток
Постоянный электрический ток Тормозная система Lada Priora
Тормозная система Lada Priora Классификации методов получения наночастиц и наноматериалов
Классификации методов получения наночастиц и наноматериалов Магнитное поле
Магнитное поле