Содержание
- 2. Основные выводы МКТ Отношение универсально газовой постоянной R к числу Авогадро NA, называется постоянной Больцмана: Постоянная
- 3. Распределение энергии по степеням свободы Выражение для средней энергии молекул было получено для одноатомного газа –
- 4. Теплоемкость Можно считать, что в идеальном газе молекулы не взаимодействуют друг с другом. Тогда внутренняя энергия
- 5. Теплоемкость Выразим теплоемкости через число степеней свободы и найдем их отношение: Работа, которую совершает моль идеального
- 6. Уравнение адиабаты Адиабатическим процесс – процесс, протекающий без теплообмена с внешней средой. Найдем связь параметров системы
- 7. Политропический процесс Все рассмотренные изопроцессы являются частным случаем политропического процесса. Процесса, при котором давление и объем
- 8. Работа идеального газа Что бы произвести интегрирование необходимо выразить давление через объем: Ранее была найдено выражение
- 10. Скачать презентацию
Основные выводы МКТ
Отношение универсально газовой постоянной R к числу Авогадро NA,
Основные выводы МКТ
Отношение универсально газовой постоянной R к числу Авогадро NA,
Постоянная Больцмана — фундаментальная физическая постоянная, определяющая связь между температурой и энергией.
Абсолютна температура есть величина, пропорциональная средней энергии движения одной молекулы.
Заменив в уравнении состояния идеального газа R:
Если имеется смесь нескольких газов, то давление в этом случае будет равно:
Средняя энергия зависит только от температуры и не зависит от массы молекул.
где n1, n2 – количество молекул первого и второго сорта, содержащееся в единице объема.
Давление – аддитивная величина, скалярная сумма давлений обусловленных молекулами какого-либо сорта – парциальным давлением.
Закон Дальтона – давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь.
Распределение энергии по степеням свободы
Выражение для средней энергии молекул было получено
Распределение энергии по степеням свободы
Выражение для средней энергии молекул было получено
То есть, учитывалась энергия только поступательного движения молекул. В более сложных молекулах запас энергии молекул может быть так же связан с вращательным или колебательным движением.
Число степеней свободы – характеристики движения механической системы, определяет минимальное количество независимых переменных, необходимых для полного описания движения механической системы.
Теорема о равнораспределении – все движения равновероятны, поэтому на каждую степень свободы приходится одинаковое количество энергии.
Тогда средняя энергия молекулы равна:
где i – сумма числа поступательных, вращательных и колебательных степеней свободы молекулы:
x
z
y
x
z
y
x
z
y
ϕ
α
ϕ
α
l
Теплоемкость
Можно считать, что в идеальном газе молекулы не взаимодействуют друг с
Теплоемкость
Можно считать, что в идеальном газе молекулы не взаимодействуют друг с
Для произвольного количества газа:
Теплоемкость – величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус:
В общем случае величина теплоемкости не является постоянной, а зависит от процесса. Наибольший интерес представляют случаи постоянного объема и постоянного давления и соответствующие теплоемкости – Cp и CV
В соответствие с первым началом термодинамики, тепло переданное системе может идти на совершение работы и/или увеличению внутренней энергии.
При постоянном объеме работа не совершается:
Подставив:
Постоянная величина, не зависящая от параметров состояния газа. Через теплоемкость можно выразить внутреннюю энергию:
Если нагревание происходит при постоянном давлении, то газ будет расширятся, совершая работу. Следовательно, для повышения температуры потребуется больше тепла, т.к. часть будет уходить на совершение работы. Из первого начала:
Получим выражение для теплоемкости:
Из уравнения состояния идеального газа можно выразить приращение объема при изменении температуры:
Теплоемкость
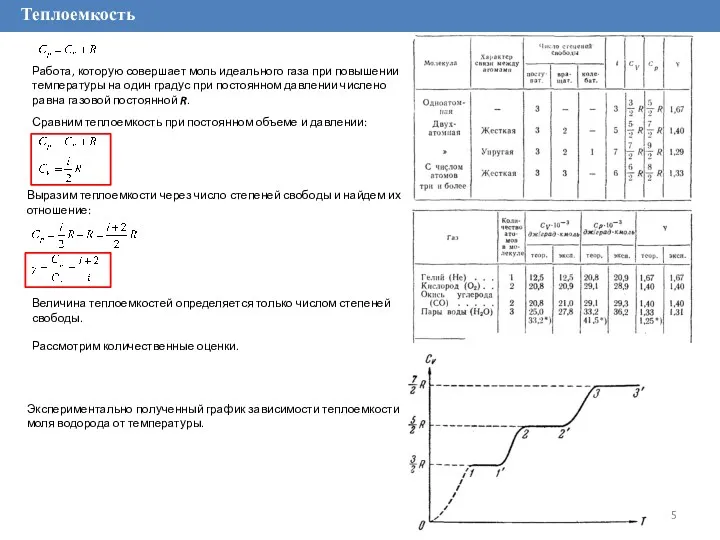
Выразим теплоемкости через число степеней свободы и найдем их отношение:
Работа, которую
Теплоемкость
Выразим теплоемкости через число степеней свободы и найдем их отношение:
Работа, которую
Сравним теплоемкость при постоянном объеме и давлении:
Величина теплоемкостей определяется только числом степеней свободы.
Рассмотрим количественные оценки.
Экспериментально полученный график зависимости теплоемкости моля водорода от температуры.
Уравнение адиабаты
Адиабатическим процесс – процесс, протекающий без теплообмена с внешней средой.
Найдем
Уравнение адиабаты
Адиабатическим процесс – процесс, протекающий без теплообмена с внешней средой.
Найдем
Из уравнения состояния идеального газа выразим давление:
Подставим и проведем сокращение:
Разделим переменные и проведем интегрирование:
Учтем связь теплоемкостей и занесем множитель в показатель:
Адиабатический процесс можно выразить в переменных p и V. Используя уравнения состояния выразим:
Политропический процесс
Все рассмотренные изопроцессы являются частным случаем политропического процесса. Процесса, при
Политропический процесс
Все рассмотренные изопроцессы являются частным случаем политропического процесса. Процесса, при
Политропный процесс — термодинамический процесс, во время которого теплоёмкость газа остаётся неизменной.
n – показатель политропы, может принимать любые значения.
Рассмотрим случай стремления n к бесконечности.
При значениях n= 0, 1 и γ уравнение примет вид соответствующий изобарическому, изотермическому и адиабатическому процессу.
Соответствует случаю изохорического процесса.
Найдем значение теплоемкости при политропическом процессе. Выразим уравнение политропы в переменных T и V с помощью уравнения состояния идеального газа:
Используя первое начало термодинамики и определение теплоемкости:
Найдем полную производную используя уравнение политропы:
Полученное выражение не содержит параметров состояния p, V или T, то есть теплоемкость есть величина постоянная.
Работа идеального газа
Что бы произвести интегрирование необходимо выразить давление через объем:
Ранее
Работа идеального газа
Что бы произвести интегрирование необходимо выразить давление через объем:
Ранее
В общем виде работа газа при переходе из состояния 1 в состояние 2 определяется формулой:
Где индексы 1 и 2 соответствуют начальному и конечному состоянию, а отсутствие индексу – произвольному состоянию между ними. Выразим давление и подставим в общий интеграл.
Рассмотрим случай n≠1
Преобразуем уравнение используя уравнение состояния идеального газа:
Вычислим работу при изотермическом процессе:
Работа при изобарическом процессе:






 Презентация урока по теме Количество теплоты
Презентация урока по теме Количество теплоты Хроматографические методы. (Часть 2)
Хроматографические методы. (Часть 2) Редуктор конический одноступенчатый горизонтальный
Редуктор конический одноступенчатый горизонтальный Термодинамика. Основы термодинамики
Термодинамика. Основы термодинамики Сабақтың тақырыбы Электр тогының жұмысы мен қуаты. Джоуль –Ленц заңы. Ток көзінің пайдалы әсер коэффициенті
Сабақтың тақырыбы Электр тогының жұмысы мен қуаты. Джоуль –Ленц заңы. Ток көзінің пайдалы әсер коэффициенті Буксовый узел грузового вагона. Техническая ревизия буксового узла колесный пары РУ1-Ш
Буксовый узел грузового вагона. Техническая ревизия буксового узла колесный пары РУ1-Ш What is the brake calipers?
What is the brake calipers? Полярография. Ртутно-капающий электрод. Роль метода в медицине и фармации
Полярография. Ртутно-капающий электрод. Роль метода в медицине и фармации Сила Лоренца
Сила Лоренца сила упругости
сила упругости Своя игра. Физика. 7 класс.
Своя игра. Физика. 7 класс. Электромагнитные колебания
Электромагнитные колебания Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас
Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас Трехфазные цепи переменного тока
Трехфазные цепи переменного тока Энергия топлива- урок физики в 8 классе
Энергия топлива- урок физики в 8 классе Влияние на работу дороги природных факторов
Влияние на работу дороги природных факторов Жұмыс орындарындағы электромагниттік сәулеленулер
Жұмыс орындарындағы электромагниттік сәулеленулер Скорость света
Скорость света Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма
Електричний струм у газах. Самостійний і несамостійний газові розряди. Плазма Основные законы идеального газа
Основные законы идеального газа Механика. Основные понятия кинематики
Механика. Основные понятия кинематики Аеродинаміка та динаміка польоту літака. Аеродинамічні характеристики крила. (Лекція 5.2.1)
Аеродинаміка та динаміка польоту літака. Аеродинамічні характеристики крила. (Лекція 5.2.1) Совершенствование коробки передач автомобиля УАЗ ПАТРИОТ
Совершенствование коробки передач автомобиля УАЗ ПАТРИОТ Метод кругового дихроизма и дисперсии оптического вращения
Метод кругового дихроизма и дисперсии оптического вращения Constraints application. Solution and computation of reactions, displacements, rotations, stresses and strains. 19 lesson
Constraints application. Solution and computation of reactions, displacements, rotations, stresses and strains. 19 lesson Рулевое управление
Рулевое управление Електричний струм у різних середовищах
Електричний струм у різних середовищах Модальный метод синтеза непрерывных систем
Модальный метод синтеза непрерывных систем