Содержание
- 2. Молекулярная физика и термодинамика – это разделы физики, в которых изучают макроскопические процессы в телах, состоящих
- 3. Статистический метод В 1см3 газа при нормальных условиях содержится 2,7⋅1019 молекул – число Лошмидта (при ежесекундном
- 4. 3. Свойства коллектива молекул являются макроскопическими свойствами, а свойства каждой молекулы в отдельности – микроскопическими. Связь
- 5. Термодинамический метод Термодинамика – это раздел, в котором изучаются макроскопические свойства систем, способы и формы передачи
- 6. Тема 10. Молекулярно-кинетическая теория газов 1. Параметры состояния идеального газа. 2. Основное уравнение молекулярно-кинетической теории. 3.
- 7. 1 учебный вопрос: Параметры состояния идеального газа Идеальный газ – это идеализированная система частиц, обладающая следующими
- 8. Параметры состояния идеального газа: 1. давление; 2. температура; 3. удельный объем (плотность) 4. количество вещества 1.
- 9. 2. Температура − скалярная величина, характеризующая интенсивность хаотического поступательного движения молекул, и пропорциональная средней кинетической энергии
- 10. 3. Удельный объем (плотность) − удельный объем − это объем вещества массой в 1 кг; −
- 11. 4. Количество вещества ν - физическая величина, характеризующая количество однотипных структурных единиц (атомов, молекул, ионов…) содержащихся
- 12. Молярная масса вещества = молекулярная масса этого вещества × количество молекул в 1 моле (число Авогадро).
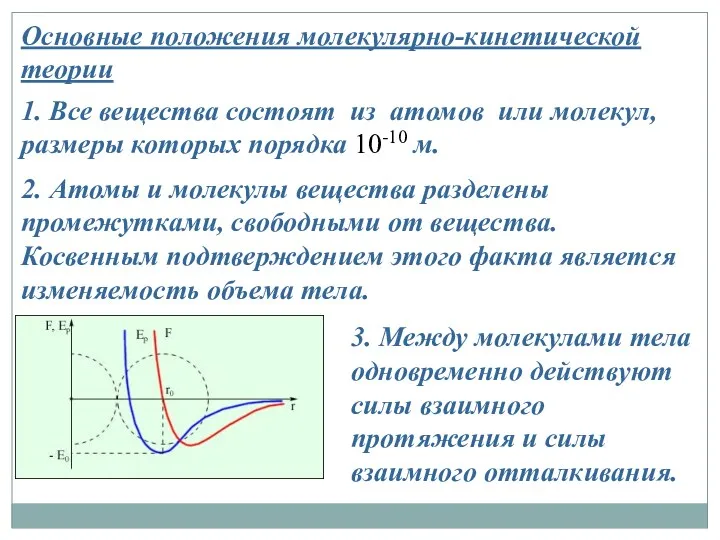
- 13. Основные положения молекулярно-кинетической теории 1. Все вещества состоят из атомов или молекул, размеры которых порядка 10-10
- 14. 4. Молекулы всех тел находятся в состоянии беспорядочного непрерывного движения (тепловое движение) Скорость движения молекул определяет
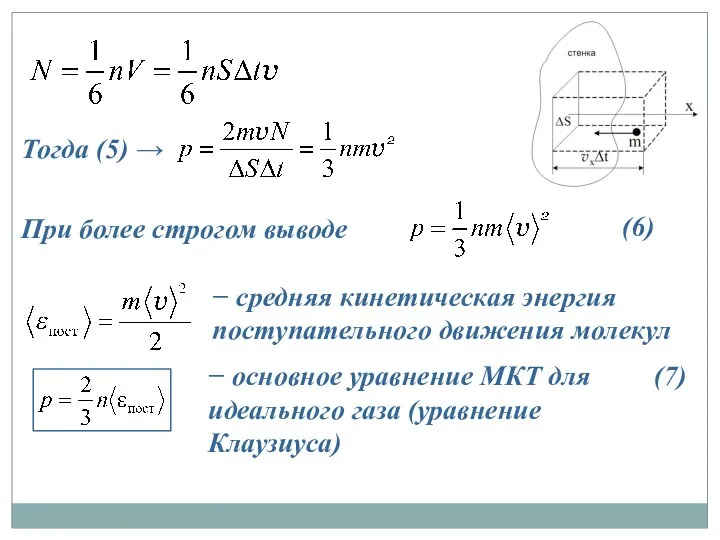
- 15. 2 учебный вопрос: Основное уравнение молекулярно-кинетической теории Вычислим давление, оказываемое молекулами на площадку ΔS. 2-й закон
- 16. Упрощение: Пусть все частицы обладают одинаковой скоростью v Тогда (4) → Так как молекулы движутся хаотически,
- 17. Тогда (5) → (6) При более строгом выводе − средняя кинетическая энергия поступательного движения молекул −
- 18. 3 учебный вопрос: Уравнение состояния идеального газа (Менделеева-Клапейрона) − уравнение Менделеева-Клапейрона (8)
- 19. 1-й закон Авогадро: киломоли всех газов при нормальных условиях занимают одинаковый объем, равный 22,4 м3/кмоль. Если
- 20. (11) − постоянная Больцмана.
- 21. Давление идеального газа при данной температуре определяется только числом молекул в единице объема и не зависит
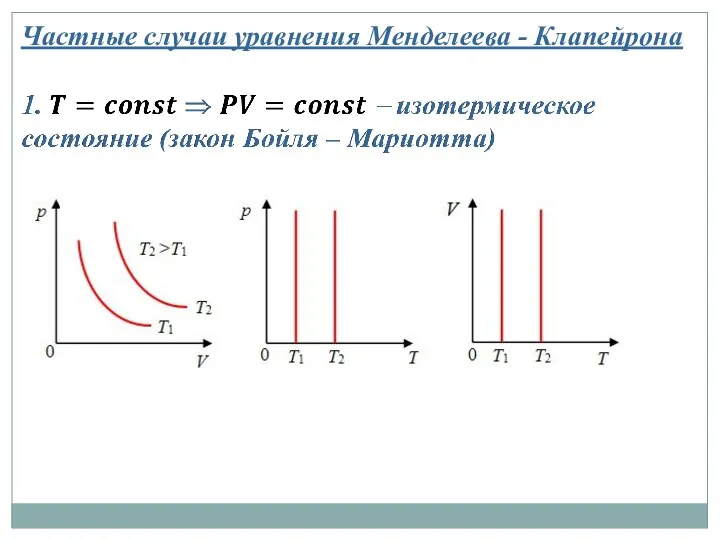
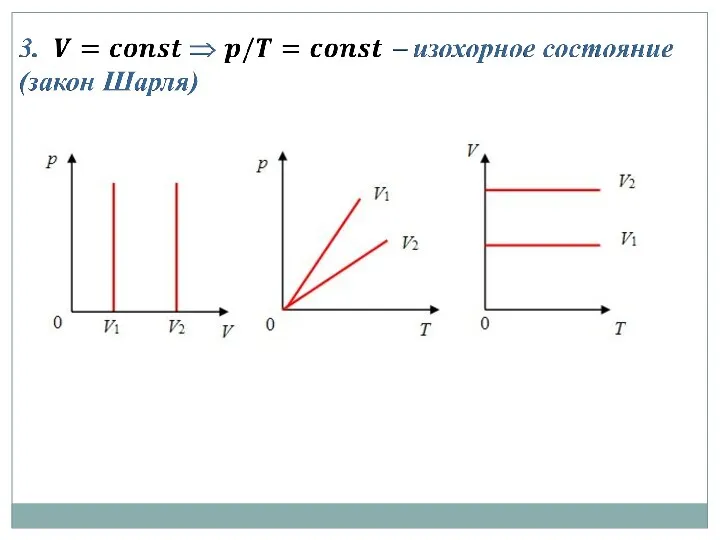
- 22. Частные случаи уравнения Менделеева - Клапейрона
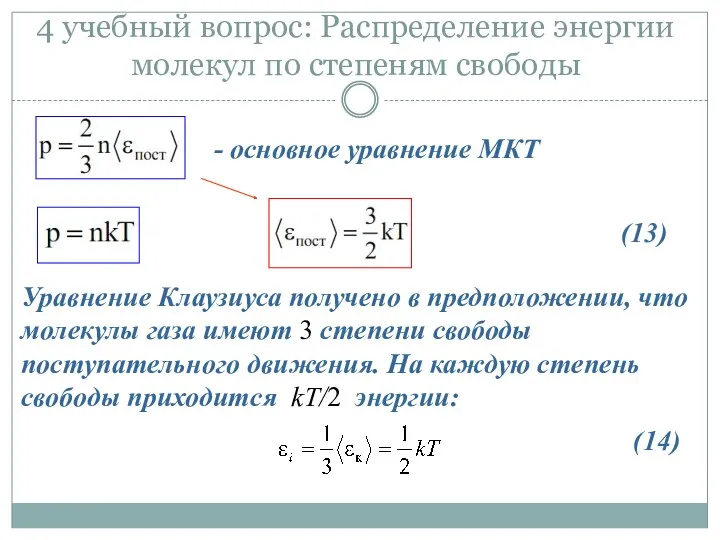
- 25. 4 учебный вопрос: Распределение энергии молекул по степеням свободы - основное уравнение МКТ Уравнение Клаузиуса получено
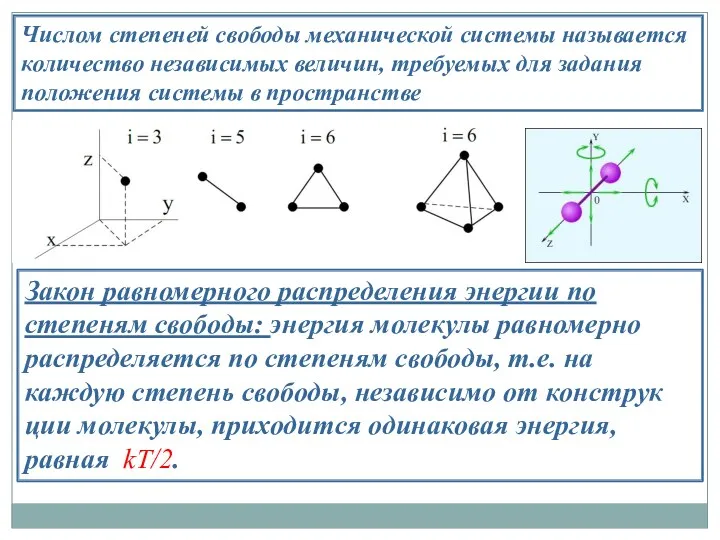
- 26. Числом степеней свободы механической системы называется количество независимых величин, требуемых для задания положения системы в пространстве
- 27. Энергия одной молекулы: Энергия одного киломоля: Энергия произвольной массы газа: (15) (16) (17)
- 28. 5 учебный вопрос: Распределение Максвелла для скорости молекул. Уравнение Клаузиуса Уравнение Менделеева – Клапейрона Для описания
- 29. Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон для распределения молекул идеального газа по
- 30. Вычисление скоростей молекул на основе функции распределения
- 31. Вычисление скоростей молекул на основе функции распределения
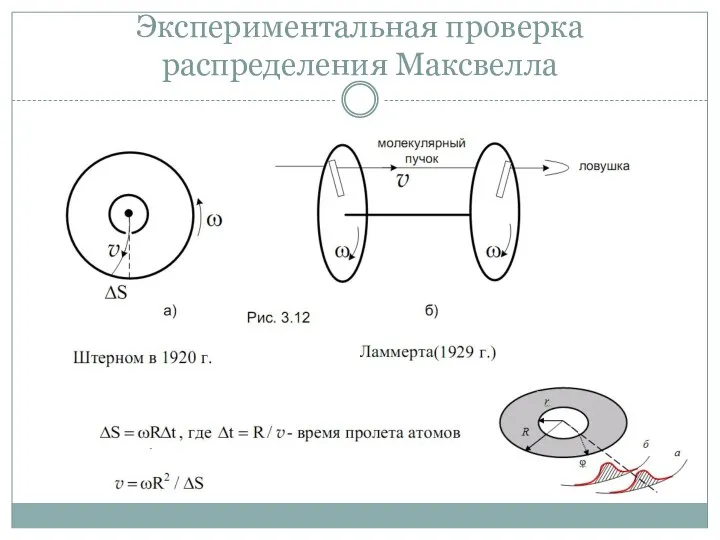
- 32. Экспериментальная проверка распределения Максвелла
- 33. 6 учебный вопрос: Распределение Больцмана и барометрическая формула Получим закон изменения давления с высотой. p –
- 34. (25) - Барометрическая формула
- 35. Определение высоты над уровнем моря - альтиметр Обобщение барометрической формулы:
- 36. − распределение Больцмана где n и n0 – концентрации молекул на высотах h ≠ 0 и
- 38. Скачать презентацию




























 Повторение курса физики. 8 класс
Повторение курса физики. 8 класс Устойчивость к скачкам потока. Лекция 8
Устойчивость к скачкам потока. Лекция 8 Электродинамика. Электрический заряд
Электродинамика. Электрический заряд презентация Давление.
презентация Давление. Механическое движение
Механическое движение Электростатика
Электростатика Оборудование машиностроительного производства и средства автоматизации. (Тема 2.2)
Оборудование машиностроительного производства и средства автоматизации. (Тема 2.2) презентация к уроку физики в 8 классе по теме Кипение, конденсация
презентация к уроку физики в 8 классе по теме Кипение, конденсация презентация решение задач по теме Простые механизмы
презентация решение задач по теме Простые механизмы Физический диктант Плотность вещества
Физический диктант Плотность вещества Расчет массы и объёма тела по его плотности
Расчет массы и объёма тела по его плотности Применение аккумуляторов
Применение аккумуляторов Теорія електромагнітного поля
Теорія електромагнітного поля Насыщенный пар
Насыщенный пар Диэлектрики в электростатическом поле
Диэлектрики в электростатическом поле Электрический ток
Электрический ток Полупроводники
Полупроводники Урок по теме Механическая работа 7 класс
Урок по теме Механическая работа 7 класс Презентация. Геометрическая оптика
Презентация. Геометрическая оптика Презентация темы по физике Механика. Кинематика твёрдого тела
Презентация темы по физике Механика. Кинематика твёрдого тела Температура. Связь температуры со скоростью теплового движения частиц
Температура. Связь температуры со скоростью теплового движения частиц Бесконтактные методы контроля температуры
Бесконтактные методы контроля температуры Датчик температуры охлаждающей жидкости
Датчик температуры охлаждающей жидкости Действие электрического тока на организм человека. (Лекция 6)
Действие электрического тока на организм человека. (Лекция 6) Өтпелі процестердің пайда болуы және коммутация заңдары. Өтпелі, еріксіз және еркін процестер
Өтпелі процестердің пайда болуы және коммутация заңдары. Өтпелі, еріксіз және еркін процестер Первичные измерительные преобразователи тока и напряжения
Первичные измерительные преобразователи тока и напряжения Открытый урок в 8 классе Действие тока
Открытый урок в 8 классе Действие тока Electricity
Electricity