Содержание
- 2. План 1. Люминесцентный анализ 1.1. Флуоресцентный анализ (флуориметрия) 1.2. Количественный флуоресцентный анализ 2. Эмиссионный спектральный анализ
- 3. 1. Люминесцентный анализ
- 4. Люминесцентный анализ - совокупность оптических методов анализа, основанных на явлении люминесценции. Люминесценция - свечение вещества, возникающее
- 5. Классификация видов люминисценции 1. По способу (источнику) возбуждения Фотолюминесценция - свечение вещ-ва, возникающее под воздействием излучения
- 6. Классификация видов люминисценции 2. По длительности послесвечения Флуоресценция (спонтанная люминесценция) - свечение, прекращающееся сразу после прекращения
- 7. 1.1. Флуоресцентный анализ (флуориметрия)
- 8. Флуориметрический метод анализа основан на возбуждении электронных спектров испускания молекул определяемого вещества при внешнем УФ-облучении и
- 9. Явление флуоресценции было впервые исследовано Гершелем в 1845 г. на растворе сернокислого хинина и названо им
- 10. Брюстер, исследовавший (1846—53) тот же самый раствор, заметил, что при достаточной силе освещения жидкости заметна флуоресценция
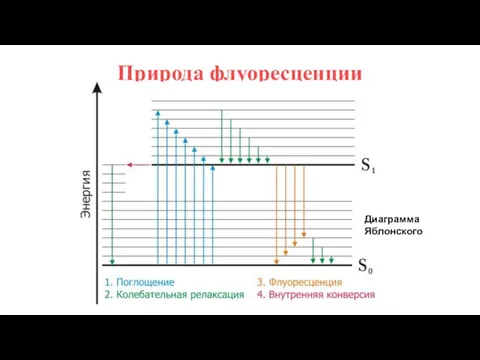
- 11. Природа флуоресценции Диаграмма Яблонского
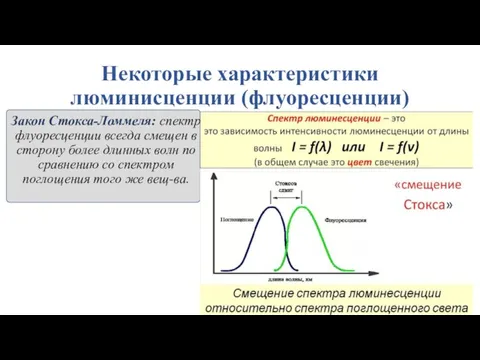
- 12. Некоторые характеристики люминисценции (флуоресценции) Закон Стокса-Ломмеля: спектр флуоресценции всегда смещен в сторону более длинных волн по
- 13. Некоторые характеристики люминисценции (флуоресценции) Квантовый выход φ люминесценции - это отношение числа излученных квантов люминисценции Nlm
- 14. Некоторые характеристики люминисценции (флуоресценции) Закон Вавилова : квантовый выход флуоресценции постоянен, если длина волны возбужденного света
- 15. 1.2. Количественный флуоресцентный анализ
- 16. Метод основан на использовании прямой пропорциональной зависимости между интенсивностью люминесценции (флуоресценции) и концентрацией с определяемого вещества
- 17. Оборудование для люминесцентного анализа
- 18. Условия проведения флуоресцентного анализа 1) В соответствии с законом Вавилова для того, чтобы квантовый выход был
- 19. Условия проведения флуоресцентного анализа 3)Посторонние примеси должны быть удалены. 4) Температура во время проведения флуориметрических измерений
- 20. Флуоресцентные соединения К флуоресценции способны многие органические вещества, как правило содержащие систему сопряжённых π-связей. Наиболее известными
- 21. Примеры люминесцентных реакций Для флуориметрического определения катионов Li+, Be2+, Mg2+, Al3+ проводят люминесцентные реакции этих катионов
- 22. Примеры люминесцентных реакций Катионы натрия Na+ можно определить люминесцентной реакцией с цинкуранилацетатом. Образующийся продукт реакции -
- 23. Примеры люминесцентных реакций Реакции образования кристаллофосфоров. Большинство вешеств в кристаллическом состоянии не обладает собственной люминесценцией. Введение
- 24. Применение флуориметрического анализа Метод широко применяется в фармакопейном анализе, например, при контроле качества фолиевой кислоты, этакридина
- 25. Применение флуориметрического анализа В производстве красок и окраске текстиля (краски, фломастеры). Флуоресцентные краски, в сочетании с
- 26. Применение флуориметрического анализа В технике: технические жидкости, например - антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск
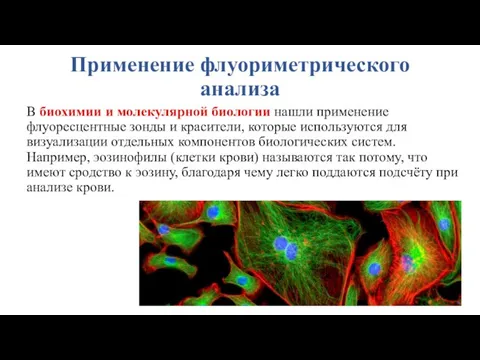
- 27. Применение флуориметрического анализа В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются
- 28. Применение флуориметрического анализа В криминалистике: отдельные флуоресцирующие вещества используются в оперативно-разыскной деятельности (для нанесения пометок на
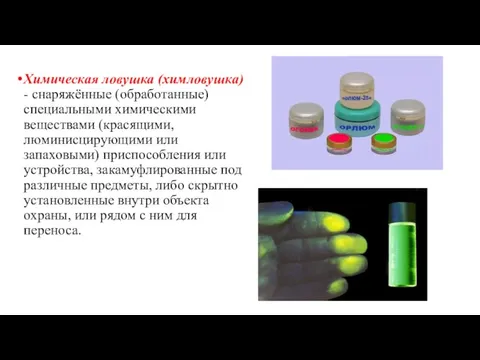
- 29. Химическая ловушка (химловушка) - снаряжённые (обработанные) специальными химическими веществами (красящими, люминисцирующими или запаховыми) приспособления или устройства,
- 30. В гидрологии и экологии: Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и
- 31. Титрование с применением флуоресцентных индикаторов Флуоресцентные индикаторы — такие органические соединения, которые при возбуждении лучами соответствующей
- 32. 2. Эмиссионный спектральный анализ
- 33. Атомно-эмиссионная спектроскопия основана на переводе внешних (валентных) электронов свободных атомов в возбужденное состояние и последующем самопроизвольном
- 35. Атомно-эмиссионный спектральный анализ (АЭСА) – это метод определения химического состава вещества по спектру излучения его атомов
- 36. Источник возбуждения должен обеспечивать необходимую яркость спектра по сравнению с фоном и должен быть достаточно стабильным,
- 37. Диспергирующий элемент Раскладывает излучение в спектр: призмы, дифракционные решетки, интерференционные устройства.
- 38. Приемники света 1. Фотопластинка 2. Фотоэлементы – это устройства, которые превращают световую энергию в электрическую.
- 40. Применение Исследование химического состава сплава при ведении плавки металла. Анализ готовых изделий с целью определения марки,
- 41. Экология Эмиссионные спектрометры - универсальные приборы, которые способны исследовать не только металлические, но и токонепроводящие пробы.
- 42. Геология Спектральный анализ дает возможность анализировать химический состав руд и минералов. С его помощью изучаются условия
- 43. Металлургия Определение марки стали. Анализ углерода, серы и фосфора в сплаве. Анализ неметаллических включений и примесей.
- 44. 3. Атомно-абсорбционный спектральный анализ
- 45. Историческая справка Окрашивание пламени солями щелочных металлов использовал в 1758 г. Маргграф для различения солей натрия
- 46. Историческая справка Позднее проводились систематические наблюдения за солнечным светом, приведшие в 1802 г. Уоллстоуна к открытию
- 47. Историческая справка В 1958 г. профессор Б. В. Львов из Ленинграда первый начал заниматься беспламенной атомно-абсорбционной
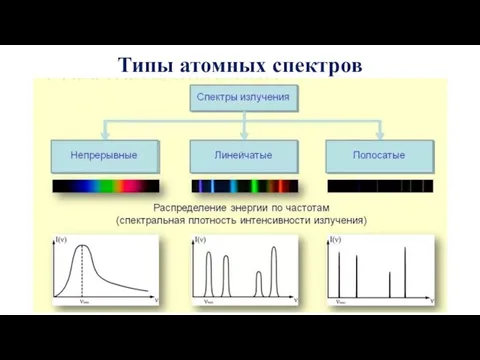
- 48. Типы атомных спектров
- 49. Типы атомных спектров При высокотемпературном воздействии на вещество возможно возникновение трех типов спектров: непрерывных полосатых и
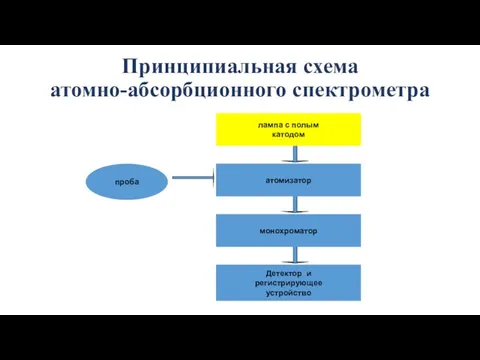
- 50. Принципиальная схема атомно-абсорбционного спектрометра
- 51. Этапы анализа 1. Проба в виде раствора подается на пламя горелки и испаряется. 2. Через пар
- 52. Атомизация в пламени Составы газовых смесей для пламенной ААС:
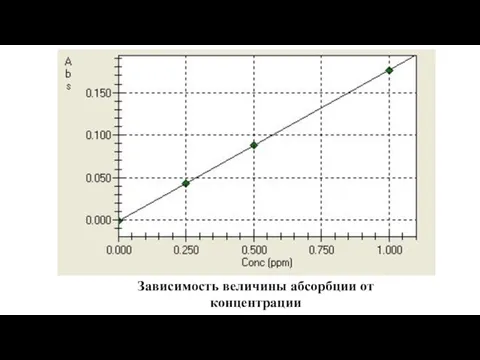
- 53. Зависимость величины абсорбции от концентрации
- 56. Скачать презентацию














































 Свободные и вынужденные колебания, колебательные системы
Свободные и вынужденные колебания, колебательные системы Игра по физике Как стать отличником для 7-8 классов
Игра по физике Как стать отличником для 7-8 классов Работа и мощность электрического тока
Работа и мощность электрического тока Основы аэродинамики
Основы аэродинамики Поляризация света
Поляризация света Расчет массы и объема тела по его плотности
Расчет массы и объема тела по его плотности Молекулярная теория строения вещества и её опытное обоснование
Молекулярная теория строения вещества и её опытное обоснование Свободное движение твердого тела. (Лекция 5, Кафедра теоретической механики)
Свободное движение твердого тела. (Лекция 5, Кафедра теоретической механики) Сұйықтың тұтқырлығын зерттеу әдістері
Сұйықтың тұтқырлығын зерттеу әдістері Механические передачи. Планетарные и волновые передачи. (Лекция 8)
Механические передачи. Планетарные и волновые передачи. (Лекция 8) Презентация урока по физике для 8 класса на тему Двигатель внутреннего сгорания
Презентация урока по физике для 8 класса на тему Двигатель внутреннего сгорания Электрохимические методы анализа. (Лекция 7)
Электрохимические методы анализа. (Лекция 7) Равновесие сил
Равновесие сил Предохранительный клапан
Предохранительный клапан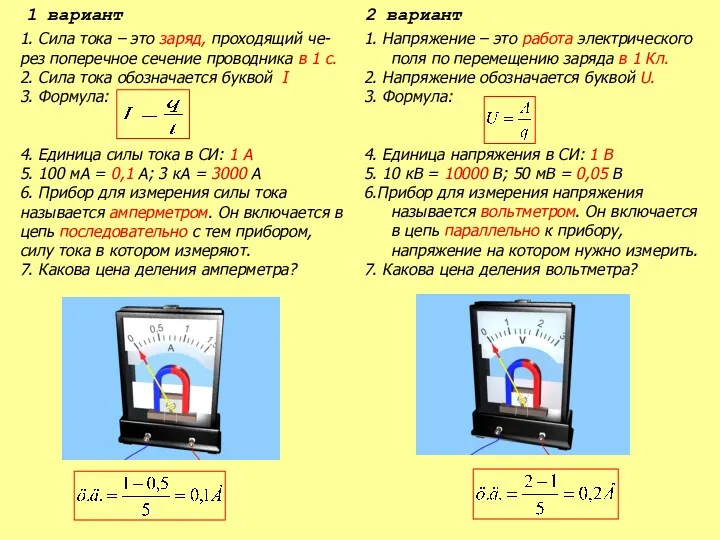 Зависимость силы тока от напряжения. Сопротивление проводника
Зависимость силы тока от напряжения. Сопротивление проводника Ішкi энергия. Ішкi энергияны өзгерту тәсiлдерi
Ішкi энергия. Ішкi энергияны өзгерту тәсiлдерi Реальные газы и пары. Общие свойства реальных газов
Реальные газы и пары. Общие свойства реальных газов Цепи синусоидального тока. (Лекция 3)
Цепи синусоидального тока. (Лекция 3)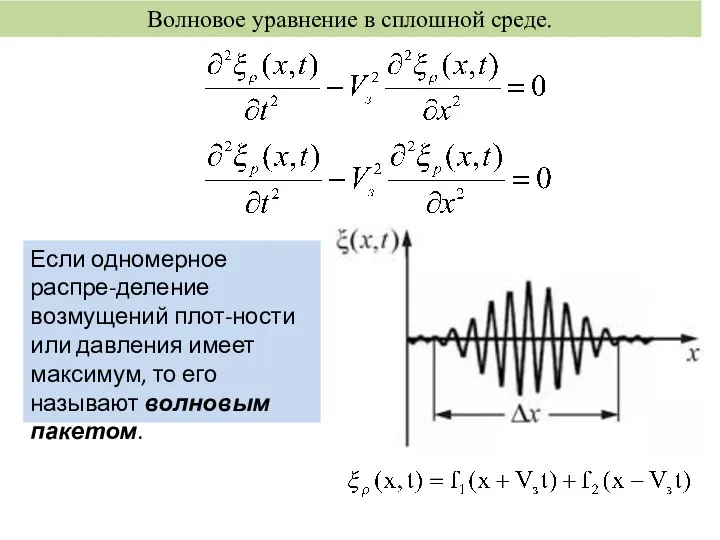 Волновое уравнение в сплошной среде
Волновое уравнение в сплошной среде Гидростатика и гидродинамика
Гидростатика и гидродинамика Строение атомного ядра. Ядерные силы
Строение атомного ядра. Ядерные силы Общая характеристика применяемых в самолетостроении соединений
Общая характеристика применяемых в самолетостроении соединений История создания барометра
История создания барометра Характеристики излучения лазеров
Характеристики излучения лазеров Световое загрязнение
Световое загрязнение Применение фотоэффекта
Применение фотоэффекта Физические величины. Измерение физических величин. Точность и погрешность измерений
Физические величины. Измерение физических величин. Точность и погрешность измерений Презентация по теме Ультрафиолетовое излучение
Презентация по теме Ультрафиолетовое излучение