Содержание
- 2. Гальванический элемент и электролитическая ячейка В гальваническом элементе самопроизвольно протекает химическая реакция, в результате чего он
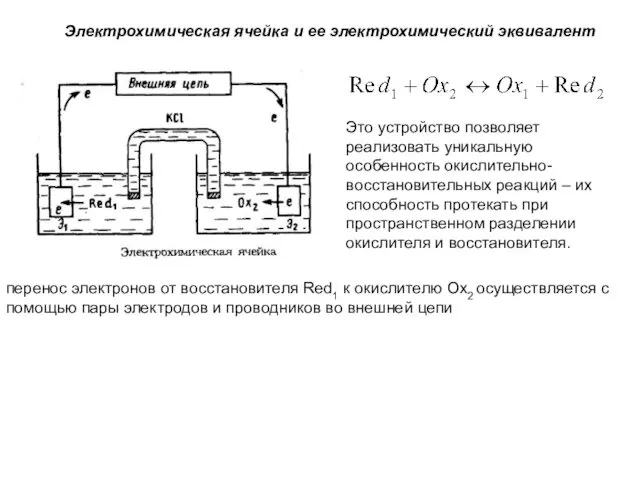
- 3. Электрохимическая ячейка и ее электрохимический эквивалент Это устройство позволяет реализовать уникальную особенность окислительно-восстановительных реакций – их
- 4. В металлических проводниках электричество переносят электроны, в растворе – ионы, а на поверхности электродов цепь замыкается
- 5. Индикаторный электрод и электрод сравнения по наличию (отсутствию) аналитического сигнала и его интенсивности судить о том,
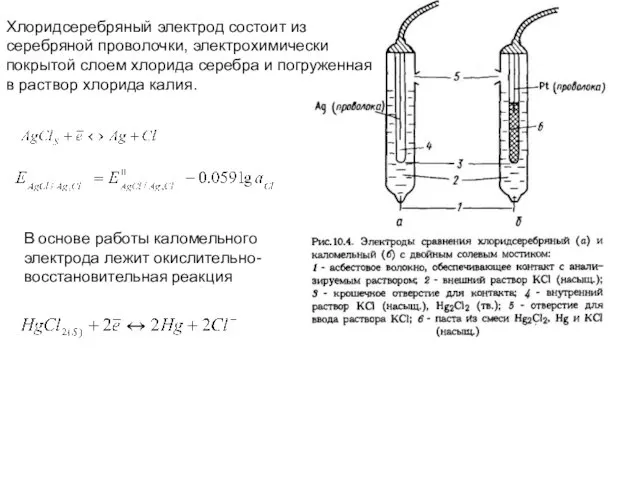
- 6. Хлоридсеребряный электрод состоит из серебряной проволочки, электрохимически покрытой слоем хлорида серебра и погруженная в раствор хлорида
- 7. Равновесные электрохимические системы В результате электрохимической реакции возникает фарадеевский ток. Индикаторный электрод в этих условиях приобретает
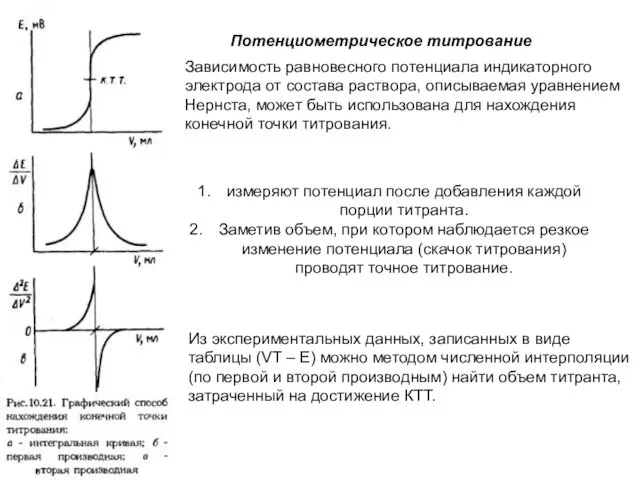
- 9. Потенциометрия В основе потенциометрических измерений лежит зависимость равновесного потенциала электрода от активности (концентрации) определяемого иона, описываемая
- 10. Индикаторные электроды в потенциометрии 1) Активный металлический электрод первого рода (например серебряный, медный, кадмиевый), 2) окислительно-восстановительный
- 11. 3) Мембранный (ионоселективный) электрод Зависимость потенциала ионоселективного электрода от состава раствора, в который он погружен, описывается
- 12. Чтобы измерить потенциал без особой погрешности можно было приравнять к равновесному, измерения необходимо проводить в условиях,
- 13. - вычислить потенциал индикаторного электрода в растворе данного состава; - рассчитать соотношение активностей(концентраций) окисленной и восстановленной
- 14. измеряют потенциал после добавления каждой порции титранта. Заметив объем, при котором наблюдается резкое изменение потенциала (скачок
- 16. Вольтамперометрические методы анализа основаны на расшифровке вольамперограмм – зависимостей силы тока от внешнего наложенного напряжения в
- 18. более точно, чем по S- образной полярограмме найти значение Е1/2; определить число электронов (n), участвующих в
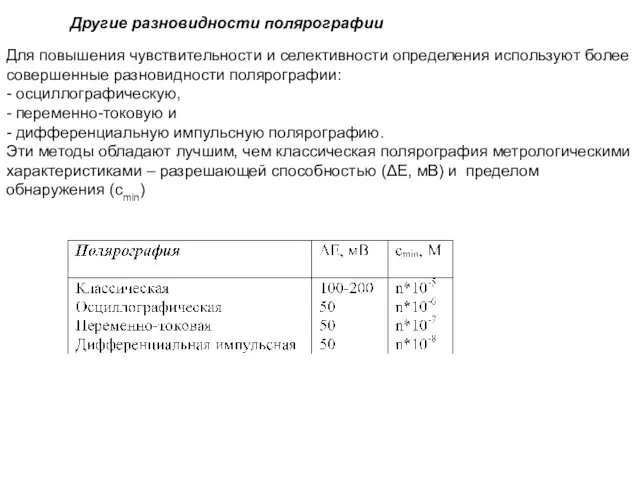
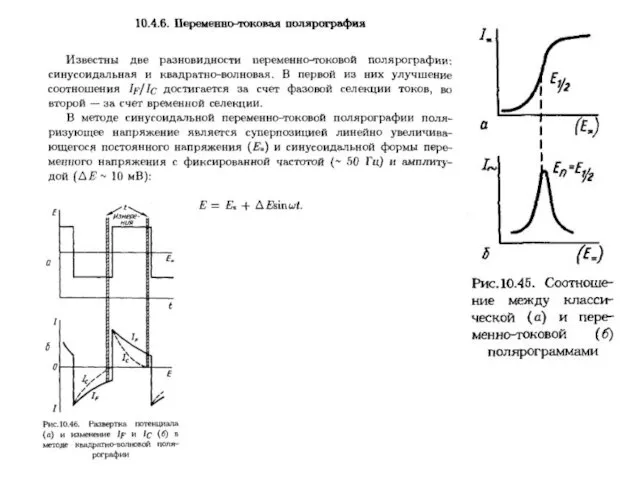
- 21. Для повышения чувствительности и селективности определения используют более совершенные разновидности полярографии: - осциллографическую, - переменно-токовую и
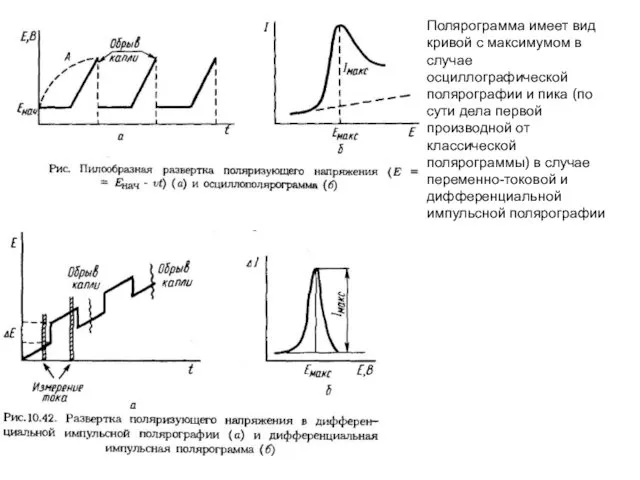
- 22. Полярограмма имеет вид кривой с максимумом в случае осциллографической полярографии и пика (по сути дела первой
- 23. в синусоидальной переменно-токовой и дифференциальной импульсной полярографии.
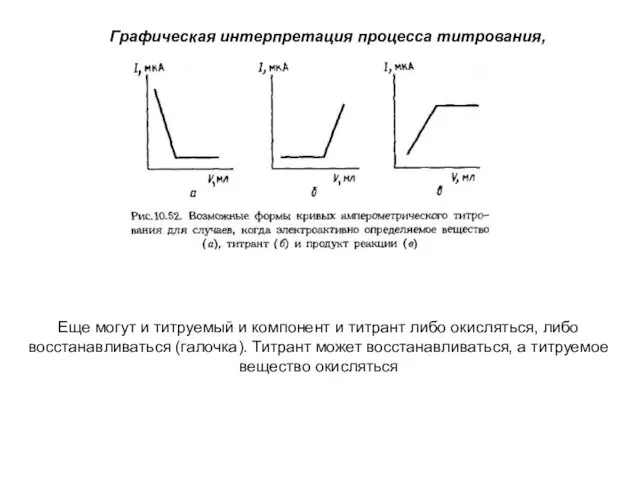
- 25. Амперометрическое титрование Метод основан на измерении объема титранта, израсходованного на достижение КТТ, фиксируемой по изменению тока
- 26. Графическая интерпретация процесса титрования, Еще могут и титруемый и компонент и титрант либо окисляться, либо восстанавливаться
- 27. Кондуктометрический анализ основан на измерении удельной электропроводности анализируемого раствора. Электропроводностью называют величину, обратную электрическому сопротивлению R.
- 28. Электропроводность разбавленных растворов зависит: от числа ионов в растворе (т.е. от концентрации), числа элементарных зарядов, переносимых
- 30. Скачать презентацию




















 Подшипники скольжения
Подшипники скольжения Сверхпроводимость
Сверхпроводимость Лабораторная работа Изучение явления отражения света
Лабораторная работа Изучение явления отражения света Коэффициент полезного действия механизма
Коэффициент полезного действия механизма Законы сохранения в механике
Законы сохранения в механике Қозғалтқыш жалпы түсінік. Қозғалтқыштың құрылысы. Асинхронды машинаның статоры және роторы
Қозғалтқыш жалпы түсінік. Қозғалтқыштың құрылысы. Асинхронды машинаның статоры және роторы Закон сохранения и превращения энергии
Закон сохранения и превращения энергии Презентация учебного проекта Учимся находить плотность вещества
Презентация учебного проекта Учимся находить плотность вещества Двигатели летательных аппаратов
Двигатели летательных аппаратов Аппратура_в1.4
Аппратура_в1.4 Работа сил электростатического поля
Работа сил электростатического поля Линзы. Ход лучей в линзах
Линзы. Ход лучей в линзах Вес тела
Вес тела Стартовая презентация к проекту Зрение и компьютер
Стартовая презентация к проекту Зрение и компьютер Lenses. Types of lenses. Main characteristics of the lenses
Lenses. Types of lenses. Main characteristics of the lenses Создание обучающей среды как важнейший фактор развития УУД на уроках физики. Диск
Создание обучающей среды как важнейший фактор развития УУД на уроках физики. Диск Порядок выбора объектов автоматизации
Порядок выбора объектов автоматизации Давление и сила давления
Давление и сила давления Электрический ток в металлах
Электрический ток в металлах Сложные электрические цепи
Сложные электрические цепи Резьбовые соединени
Резьбовые соединени Методы и средства электрических измерений
Методы и средства электрических измерений Свет и магнитные вещества: от эффекта Фарадея к сверхбыстрой оптомагнитной записи
Свет и магнитные вещества: от эффекта Фарадея к сверхбыстрой оптомагнитной записи Урок № 36 2 Промывочные жидкости
Урок № 36 2 Промывочные жидкости Основные измерения, проводимые для оценки качества холодильного оборудования
Основные измерения, проводимые для оценки качества холодильного оборудования Электрические и магнитные поля в таблицах и схемах.
Электрические и магнитные поля в таблицах и схемах. Теплотехника. Двигатели внутреннего сгорания. (Лекция 8)
Теплотехника. Двигатели внутреннего сгорания. (Лекция 8) Презентация к уроку физики Электрический ток. Источники тока
Презентация к уроку физики Электрический ток. Источники тока