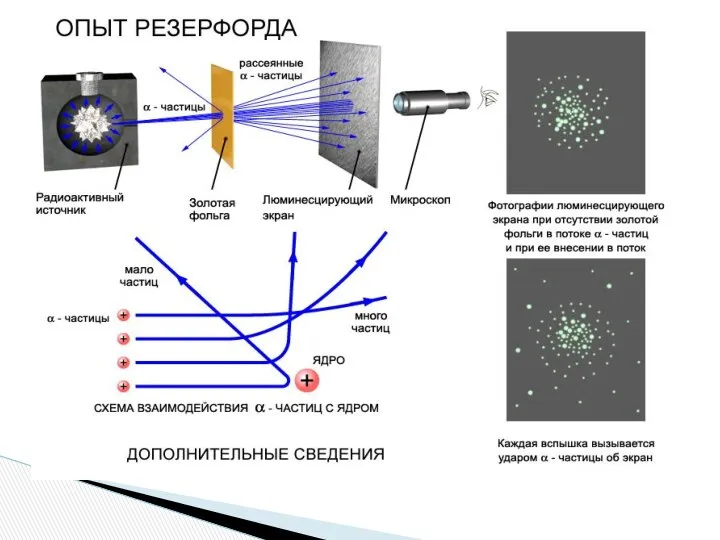
1897 г - Дж. Дж. Томсон доказал существование электрона, измерил его
заряд и массу.
1897 г - В. Вебер впервые высказал мысль об электронном строении атома ( электроны входят в состав атома).
1905 г - Ф. Линдеман утверждал, что атом кислорода имеет форму кольца, а атом серы- форму лепешки.
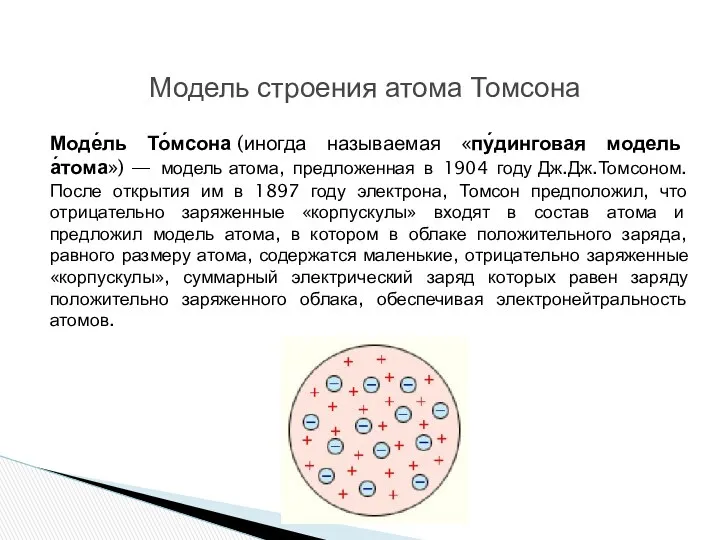
1903-1904 гг - Дж. Дж. Томсон предложил модель атома в виде положительно заряженного шара, в котором «плавают» электроны.
Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества.






 Урок. Решение задач - на расчет пути и времени равномерного движения
Урок. Решение задач - на расчет пути и времени равномерного движения Цікаві факти з життя науковців – дослідників електрики
Цікаві факти з життя науковців – дослідників електрики Intelligent energy storage
Intelligent energy storage Тепловые двигатели
Тепловые двигатели Игра В мире занимательной физики
Игра В мире занимательной физики Интерактивные методы обучения при подготовке учащихся к сдаче экзамена по физике в формате ОГЭ
Интерактивные методы обучения при подготовке учащихся к сдаче экзамена по физике в формате ОГЭ Общая электротехника и электроника. Цепи постоянного тока. Лекция 1
Общая электротехника и электроника. Цепи постоянного тока. Лекция 1 Ремонт трансмиссии автомобиля ВАЗ 2170
Ремонт трансмиссии автомобиля ВАЗ 2170 Турбина. Назначение турбин
Турбина. Назначение турбин Бүгінгі таңдағы физикалық жетістіктер. Өзінің қолтаңбасын қалдырған ғалым
Бүгінгі таңдағы физикалық жетістіктер. Өзінің қолтаңбасын қалдырған ғалым Сила давления жидкости на плоские и криволинейные стенки
Сила давления жидкости на плоские и криволинейные стенки Давление твёрдых тел, жидкостей и газов (решение задач). Физика, 7 класс
Давление твёрдых тел, жидкостей и газов (решение задач). Физика, 7 класс Презентация к уроку по теме: Делимость электрического заряда. 8 класс. Физика
Презентация к уроку по теме: Делимость электрического заряда. 8 класс. Физика Гетерогенный химический процесс система газ твердое
Гетерогенный химический процесс система газ твердое Коэффициенты аэродинамических сил. Лекции 25, 26
Коэффициенты аэродинамических сил. Лекции 25, 26 Молекулярная физика. Термодинамика
Молекулярная физика. Термодинамика Презентация Воздухоплавание
Презентация Воздухоплавание Применение правила равновесия рычага к блоку
Применение правила равновесия рычага к блоку Давление. Единицы давления
Давление. Единицы давления тест по физике 7 класс
тест по физике 7 класс Электрические цепи постоянного тока
Электрические цепи постоянного тока Исследовательская работа Посудомоечная машина
Исследовательская работа Посудомоечная машина Техническое обслуживание и ремонт комплексной системы автоматического управления двигателем автомобиля Lada Kalina
Техническое обслуживание и ремонт комплексной системы автоматического управления двигателем автомобиля Lada Kalina Сила тока. Плотность тока. Закон Ома. Электрическое сопротивление. Электродвижущая сила
Сила тока. Плотность тока. Закон Ома. Электрическое сопротивление. Электродвижущая сила Шлифование металла
Шлифование металла Intake and exhaust manifold, design. (Part 1)
Intake and exhaust manifold, design. (Part 1)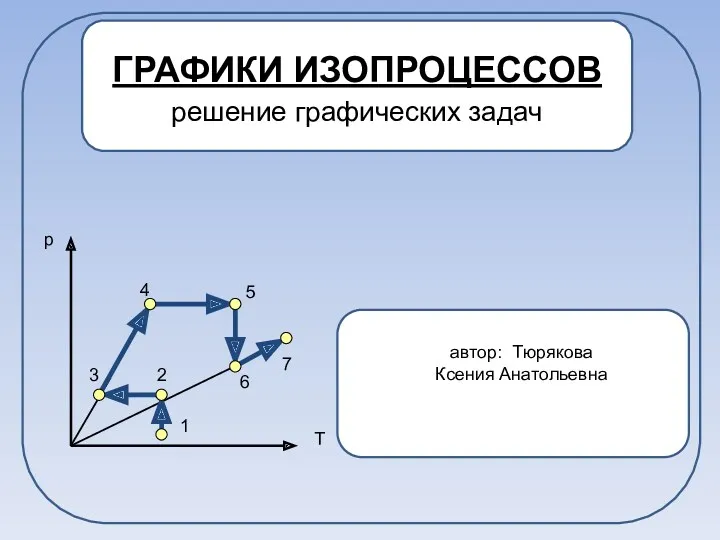 Графики изопроцессов. Решение графических задач
Графики изопроцессов. Решение графических задач Циклы паросиловых установок
Циклы паросиловых установок