Содержание
- 2. Условия процесса – состояние каждой из фаз и параметры их взаимодействия. Скорость превращения в гетерогенном химическом
- 3. Процессы «газ (жидкость) – твердое»: 1. Производство металлов обжигом сульфидных руд: 2ZnS(тв) +3O2 (г) = 2ZnO(тв)
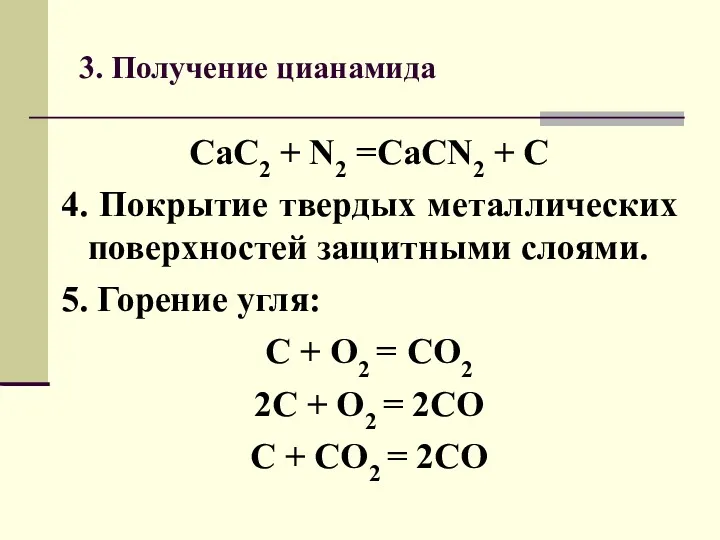
- 4. 3. Получение цианамида CaC2 + N2 =CaCN2 + C 4. Покрытие твердых металлических поверхностей защитными слоями.
- 5. 6. Производство сероуглерода при 750-1000оС: С(тв) + 2S(ж) = CS2(г) 7. Производство тиосульфата натрия из серы:
- 6. Процесс с изменением размера твердой частицы (“сжимающаяся сфера”) Aг + Bт = Rг происходит уменьшение размера
- 7. Структура процесса В твердой фазе: II Реакция В с газообразным компонентом А поверхности III Изменение (уменьшение)
- 8. Математическая модель WI = WII WI = -βSr(C0 - CП) WII = -k(CП)Sr , где β
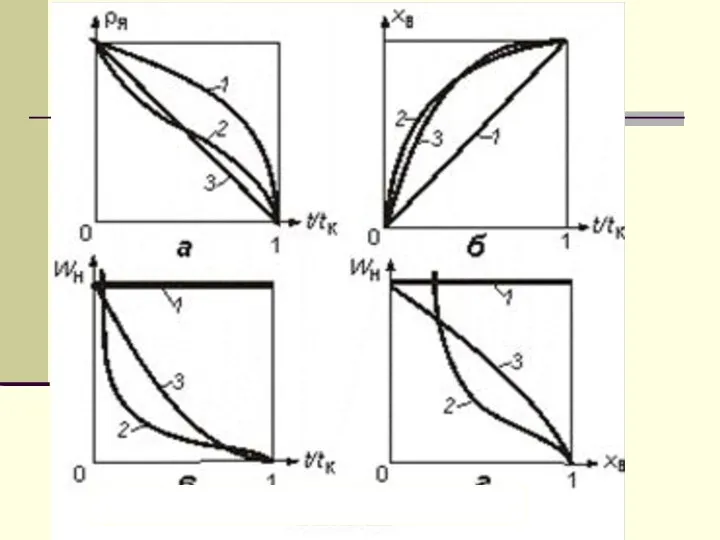
- 9. Изменение во времени t безразмерного радиуса частицы ρ (а), степени превращения твердого реагента xВ (б) и
- 10. Лимитирующие стадии и режимы процесса Если k CП~ C0, Wн=-kС0 кинетический режим; реакция – лимитирующая стадия
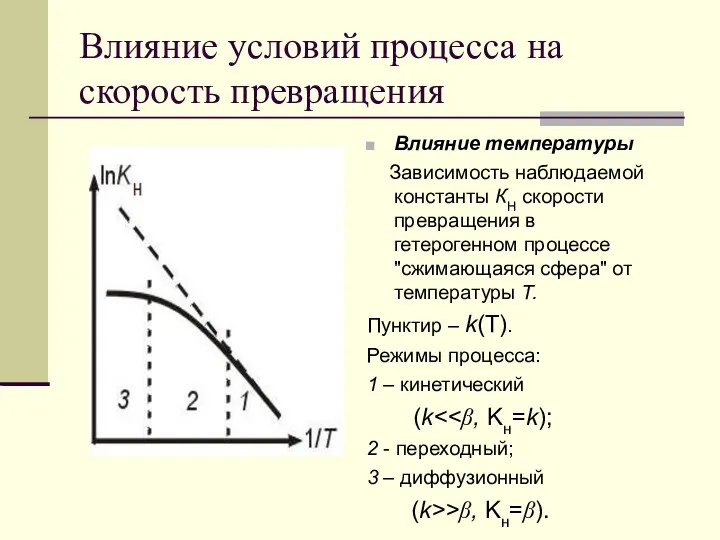
- 11. Влияние условий процесса на скорость превращения Влияние температуры Зависимость наблюдаемой константы КН скорости превращения в гетерогенном
- 12. Влияние скорости потока Зависимость наблюдаемой константы скорости от скорости обтекания частицы u. Режимы процесса: 1 –
- 13. Интенсификация процесса Пути уменьшения tк и, следовательно, интенсификации процесса: увеличение концентрации компонента в газе C0; дробление
- 14. Система «газ(жидкость)−твердое» «сжимающееся ядро» Aг + Bт = Rг + Sт Sт − твердый продукт реакции,
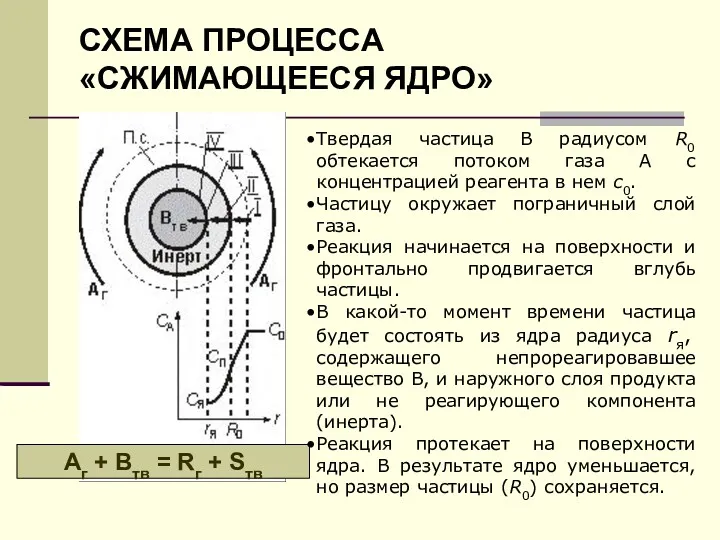
- 15. СХЕМА ПРОЦЕССА «СЖИМАЮЩЕЕСЯ ЯДРО» Аг + Втв = Rг + Sтв Твердая частица В радиусом R0
- 16. Структура процесса В газовой фазе: I Перенос компонента А из потока к поверхности частицы через пограничный
- 17. МАТЕМАТИЧЕСКАЯ МОДЕЛЬ Газообразный компонент. сП, сЯ − концентрации А у наружной поверхности частицы и у поверхности
- 18. Поскольку А переносится через слой инерта без изменений, то WII = сonst при любом r, так
- 19. Введем безразмерный радиус ρ = r/R0. После интегрирования и подстановок: WII = −4πR0D ρя/(1 − ρя).(сП
- 20. равенство есть система двух уравнений, из которой можно найти «не наблюдаемые» концентрации сП и сЯ и
- 21. Твердый компонент Изменение размера ядра dNВ/dt = WB 4πrя2. Количество твердого dNВ, превращаемого за время dt
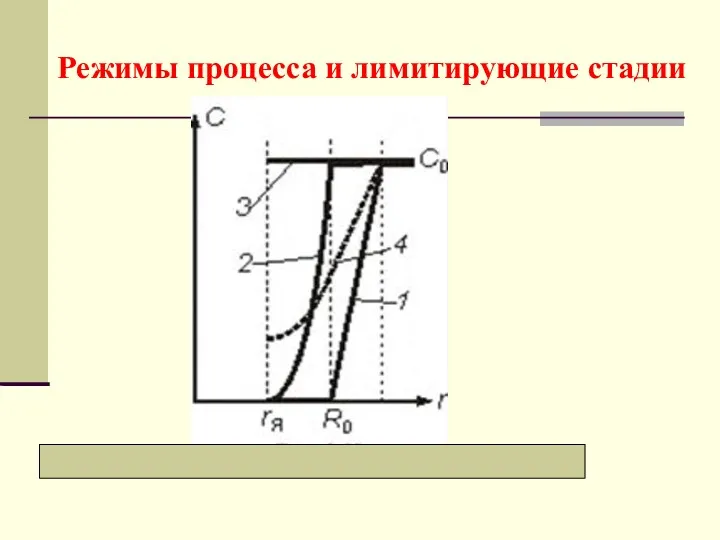
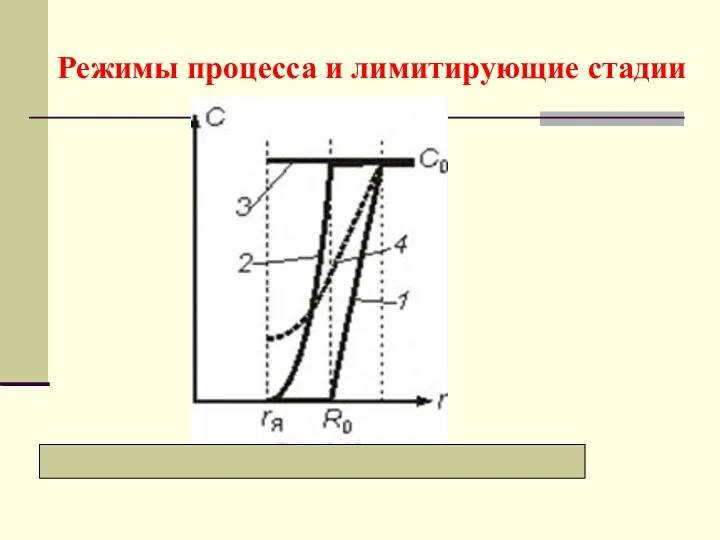
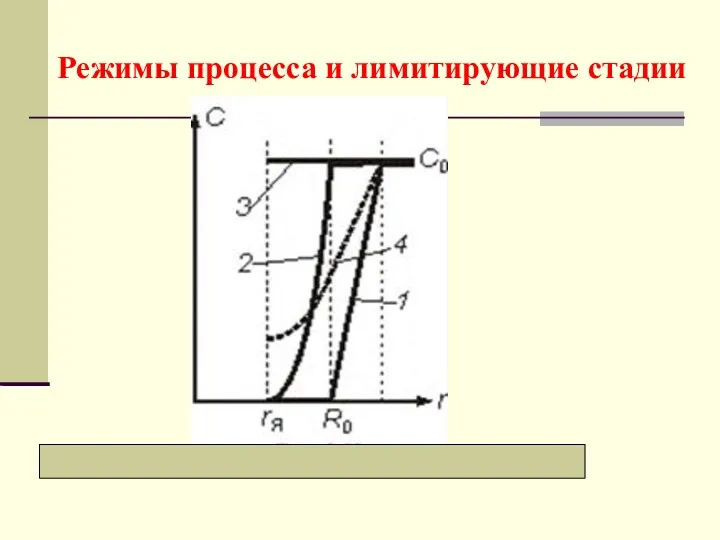
- 22. Режимы процесса и лимитирующие стадии
- 23. а) Внешнедиффузионный режим Лимитирующая стадия − перенос компонента через внешний пограничный слой газа, у которого максимальная
- 25. б) Внутридиффузионный режим Графически все зависимости представлены кривыми 2 Лимитирующая стадия − диффузионный перенос внутри частицы
- 26. Режимы процесса и лимитирующие стадии
- 28. в) Кинетический режим Графически соответствующие зависимости представлены линиями 3 Лимитирующая стадия − химическая реакция, у которой
- 29. Режимы процесса и лимитирующие стадии
- 32. Скачать презентацию






















 Розв’язування задач з теми Закон збереження імпульсу
Розв’язування задач з теми Закон збереження імпульсу Subjects: forces in mechanics. Dynamics. Newton’s laws
Subjects: forces in mechanics. Dynamics. Newton’s laws Световые кванты
Световые кванты Резьбы, резьбовые изделия и соединения. Разъемные соединения. Неразъемные соединения
Резьбы, резьбовые изделия и соединения. Разъемные соединения. Неразъемные соединения Системы смазки и охлаждения двигателя
Системы смазки и охлаждения двигателя Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости DSI M78 6-Speed A/T. Overseas service team
DSI M78 6-Speed A/T. Overseas service team Геометрическая оптика
Геометрическая оптика Электромагнитное поле
Электромагнитное поле Отдельные электроприемники в однофазной цепи переменного тока
Отдельные электроприемники в однофазной цепи переменного тока Центрифугирование
Центрифугирование Өз құрылымы мен құрамы болмайтын бөлшекті
Өз құрылымы мен құрамы болмайтын бөлшекті Движение заряженной частицы в электрическом и магнитном полях. Лекция 6
Движение заряженной частицы в электрическом и магнитном полях. Лекция 6 Правило буравчика, правило правой руки
Правило буравчика, правило правой руки Кузнечно-сварочная практика. Специальность 190604 Техническое обслуживание и ремонт автомобильного транспорта
Кузнечно-сварочная практика. Специальность 190604 Техническое обслуживание и ремонт автомобильного транспорта Двигатель внутреннего сгорания. Устройство. Схема. Применение
Двигатель внутреннего сгорания. Устройство. Схема. Применение Движение тела под действием силы трения
Движение тела под действием силы трения Устройство токарного станка для обработки древесины. (Технический труд. 6 класс)
Устройство токарного станка для обработки древесины. (Технический труд. 6 класс) Вещества и явления в окружающем мире
Вещества и явления в окружающем мире Дизельный двигатель
Дизельный двигатель Физика в стихах
Физика в стихах Урок Оптические приборы, физика11 класс
Урок Оптические приборы, физика11 класс Отчет об исследовательской работе
Отчет об исследовательской работе Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Идеальные газы тождественных частиц. Распределение Ферми-Дирака и Бозе-Эйнштейна
Идеальные газы тождественных частиц. Распределение Ферми-Дирака и Бозе-Эйнштейна Схема сверхзвукового обтекания затупленного тела
Схема сверхзвукового обтекания затупленного тела Оптические методы и приборы контроля качества продукции
Оптические методы и приборы контроля качества продукции Равновесные и неравновесные носители зарядов
Равновесные и неравновесные носители зарядов