Содержание
- 2. Введение Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные
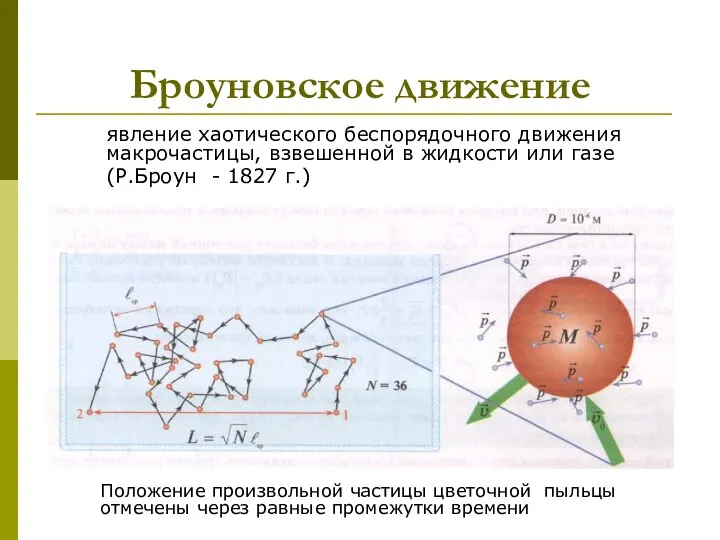
- 3. Броуновское движение явление хаотического беспорядочного движения макрочастицы, взвешенной в жидкости или газе (Р.Броун - 1827 г.)
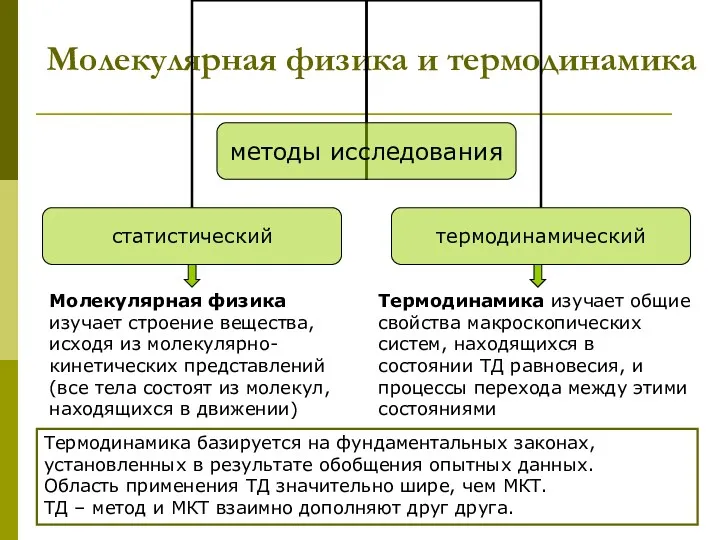
- 4. Молекулярная физика и термодинамика Термодинамика базируется на фундаментальных законах, установленных в результате обобщения опытных данных. Область
- 5. Термодинамическая система ТД - система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между
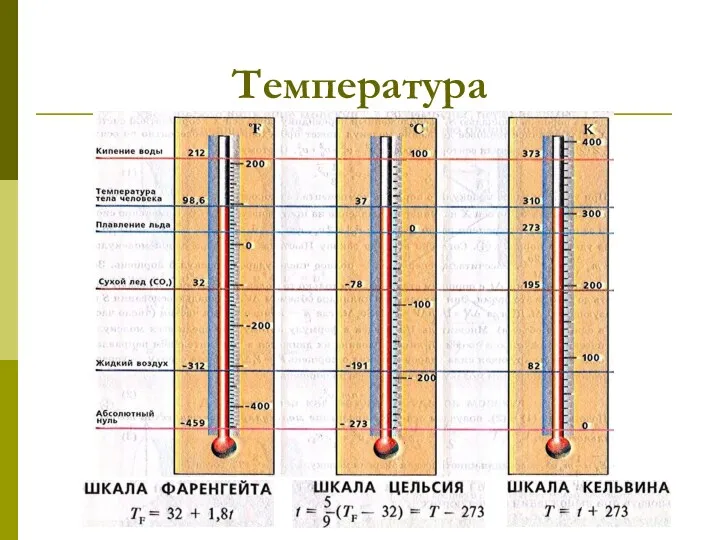
- 6. Температура
- 7. Единицы измерения количества вещества Молярная масса – масса одного моля вещества 1 моль – количество вещества,
- 8. Модель идеального газа Собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда Между молекулами отсутствуют
- 9. Изопроцессы Изопроцессы – термодинамические процессы, происходящие при одном постоянном термодинамическом параметре и неизменной массе газа Изотермический
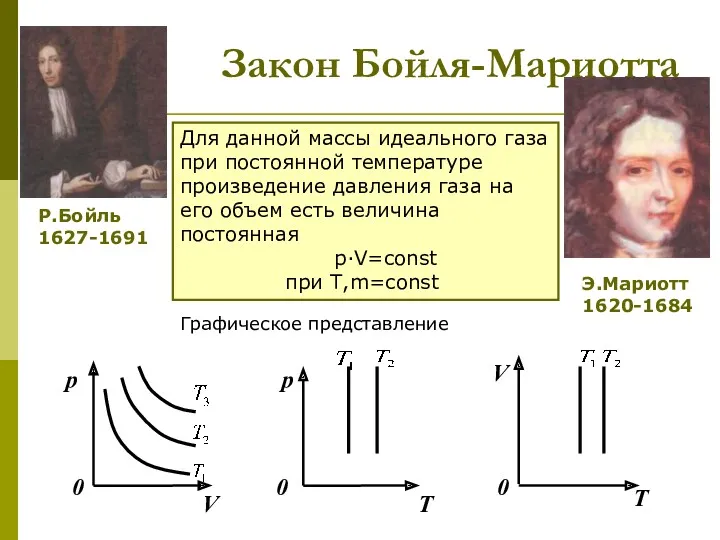
- 10. Закон Бойля-Мариотта Для данной массы идеального газа при постоянной температуре произведение давления газа на его объем
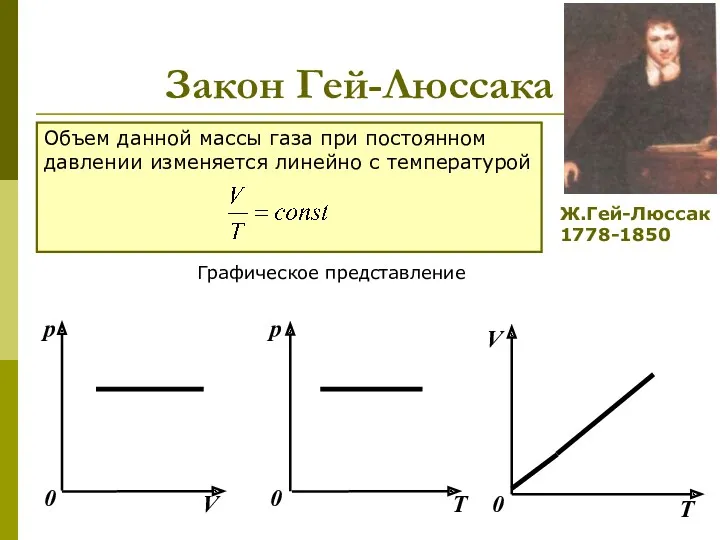
- 11. Закон Гей-Люссака Объем данной массы газа при постоянном давлении изменяется линейно с температурой Графическое представление
- 12. Закон Шарля Давление данной массы газа при постоянном объеме изменяется линейно с температурой Графическое представление
- 13. Уравнение Клапейрона-Менделеева Уравнение состояния – уравнение, связывающее термодинамические параметры, однозначно описывающие состояние термодинамической системы в любой
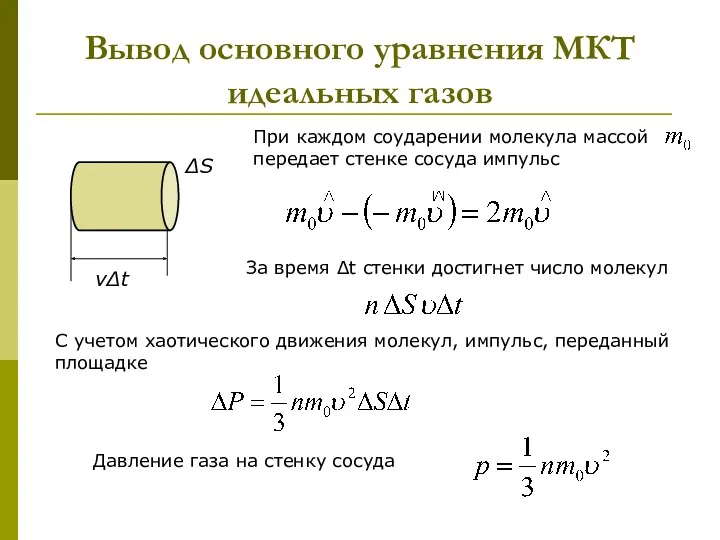
- 14. Вывод основного уравнения МКТ идеальных газов При каждом соударении молекула массой передает стенке сосуда импульс За
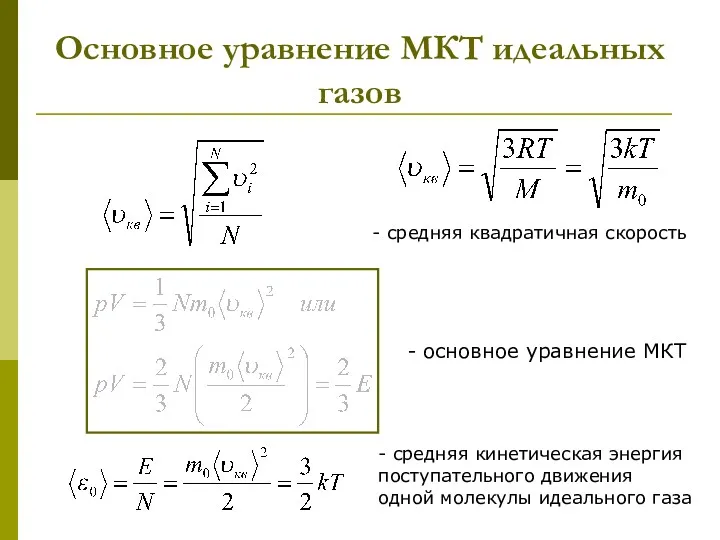
- 15. Основное уравнение МКТ идеальных газов - средняя квадратичная скорость - основное уравнение МКТ - средняя кинетическая
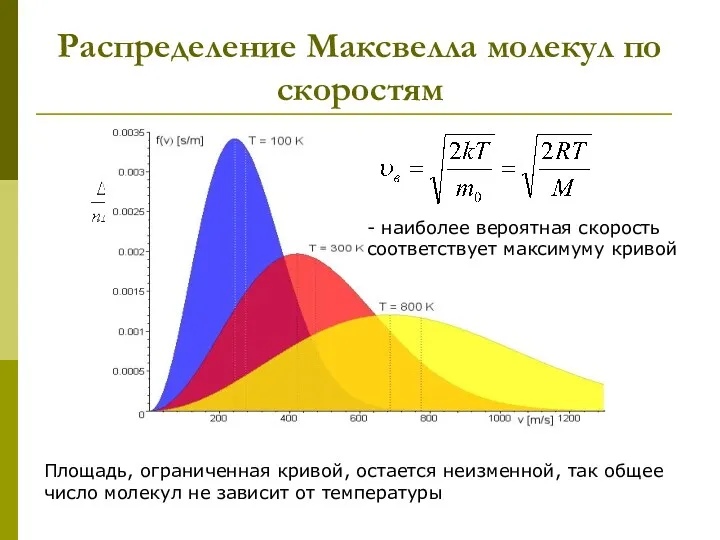
- 16. Распределение Максвелла молекул по скоростям Площадь, ограниченная кривой, остается неизменной, так общее число молекул не зависит
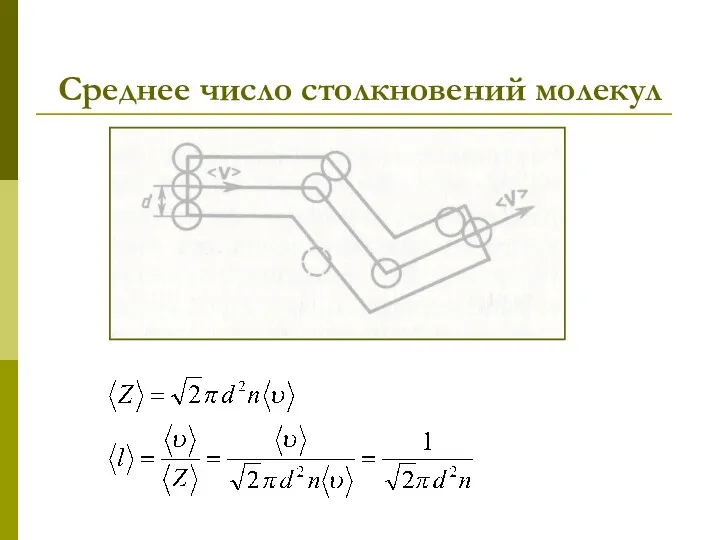
- 17. Среднее число столкновений и средняя длина свободного пробега молекул - средняя длина свободного пробега молекул –
- 18. Среднее число столкновений молекул
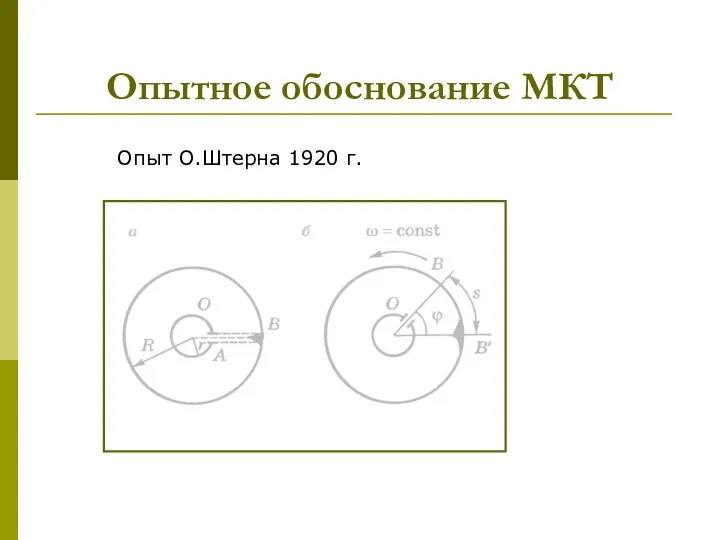
- 19. Опытное обоснование МКТ Опыт О.Штерна 1920 г.
- 21. Скачать презентацию








 Устройство велосипеда
Устройство велосипеда Типы оптических спектров. Спектральный анализ
Типы оптических спектров. Спектральный анализ Основные законы и теоремы электродинамики. Лекция 2
Основные законы и теоремы электродинамики. Лекция 2 Поперечность световых волн
Поперечность световых волн урок - презентация на тему Вес воздуха. Атмосфера
урок - презентация на тему Вес воздуха. Атмосфера Содержание авиационной техники, ее получение, учет и списание
Содержание авиационной техники, ее получение, учет и списание Основы теории управления
Основы теории управления сращивание ... проводов
сращивание ... проводов Молекулярная физика и термодинамика. Молекулярная физика
Молекулярная физика и термодинамика. Молекулярная физика Урок узагальнення та систематизації знань з теми Теплові явища. Розв’язування задач. 8 клас
Урок узагальнення та систематизації знань з теми Теплові явища. Розв’язування задач. 8 клас Экзамен по дисциплинам Электропривод
Экзамен по дисциплинам Электропривод Разработка урока по теме Закон Кулона
Разработка урока по теме Закон Кулона Оптика і квантова фізика
Оптика і квантова фізика Обобщающий урок-сказка по теме Первоначальные сведения о строении вещества
Обобщающий урок-сказка по теме Первоначальные сведения о строении вещества Проекционный аппарат
Проекционный аппарат Тормозные системы
Тормозные системы Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой
Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой Акустика. Слух и его свойства
Акустика. Слух и его свойства Ремонт почвообрабатывающих, посевных и посадочных машин
Ремонт почвообрабатывающих, посевных и посадочных машин Основные параметры метода контроля
Основные параметры метода контроля Дене импульсі. Импульстің сақталу заңы. Реактивті қозғалыс
Дене импульсі. Импульстің сақталу заңы. Реактивті қозғалыс Сплошная среда
Сплошная среда Холодильники
Холодильники Механические испытания материалов
Механические испытания материалов Тест по теме Элементарные частицы 11 класс
Тест по теме Элементарные частицы 11 класс Создание изделий из текстильных и поделочных материалов
Создание изделий из текстильных и поделочных материалов Презентация к уроку Сила тока. Измерение силы тока
Презентация к уроку Сила тока. Измерение силы тока Законы сохранения в механике
Законы сохранения в механике