Содержание
- 2. 7) Кратность вырождения уровней энергии Электрон при движении "размазан" по всему объему, образуя электронное облако, плотность
- 3. 8) Спин электрона. Опыты Штерна и Герлаха. Спиновое квантовое число Электрон обладает собственным неуничтожимым механическим моментом
- 4. 9) Эксперименты, связанные с квантовой механикой: Дж. Томсона Опыты - подтверждение гипотезы де Бройля: так же
- 5. 9) Эксперименты, связанные с квантовой механикой: дифракция электронного пучка на двух щелях Ответ: электрон пролетает через
- 6. 10) Соотношения неопределенностей Гейзенберга Двойственная корпускулярно-волновая природа микрочастиц определяет еще одно свойство микрообъектов — соотношение неопределенностей
- 7. 11) Квантовые статистические распределения микрочастиц: функции распределения Ферми-Дирака и Бозе-Эйнштейна Функция распределения Ферми-Дирака – распределение частиц
- 8. 12) Принцип Паули Частицы, имеющие одинаковые физические свойства (массу, электрический заряд, спин и т.д.) - тождественные.
- 9. 12) Принцип Паули Первая формулировка принципа Паули: Системы электронов (фермионов) встречаются в природе только в состояниях,
- 10. 13) Стpоение многоэлектpонных атомов 3 пpинципа строения атомов: - Пpинцип дискpетности энеpгетических уpовней атомов; - Пpинцип
- 11. 13) Стpоение многоэлектpонных атомов. Пеpиодический закон Менделеева Максимальное число электронов, находящихся в состояниях, определяемых главным квантовым
- 13. Скачать презентацию
7) Кратность вырождения уровней энергии
Электрон при движении "размазан" по всему объему,
7) Кратность вырождения уровней энергии
Электрон при движении "размазан" по всему объему,
Уровень энергии - g –кратно вырожденный, если система в различных квантовых состояниях с Ψnlm имеет одинаковую энергию En.
Кратность вырождения gn =
Полярные диаграммы плотностей вероятности для s -, p -, d - и f -электронов
Состояние электрона, характеризующееся квантовым числом l = 0, называется s −состоянием (1s, 2s, ..., ns, ...), электрон в этом состоянии − s -электрон, l =1 — p -состояние,
l = 2 — d -состояние и т.д.
8) Спин электрона. Опыты Штерна и Герлаха. Спиновое квантовое число
Электрон обладает
8) Спин электрона. Опыты Штерна и Герлаха. Спиновое квантовое число
Электрон обладает
Спин электрона (и всех других микрочастиц) — внутреннее неотъемлемое квантовое свойство микрочастицы.
Pmsz = gsLsz , Lsz = ± ħ/2, gs = e/m
Спин Ls квантуется по закону:
где s - спиновое квантовое число
Из опыта → 2S + 1 = 2 → S = ½ → Lsz =
Проекция Lsz = ħ ms , где ms— магнитное спиновое квантовое число, которое может иметь значения: ms= ±½
↓
кратность вырождения:
gn = 2 n2
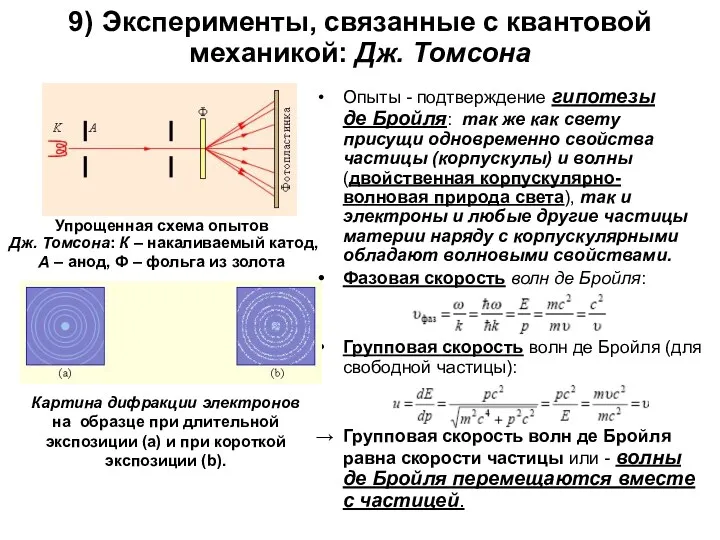
9) Эксперименты, связанные с квантовой механикой: Дж. Томсона
Опыты - подтверждение гипотезы
9) Эксперименты, связанные с квантовой механикой: Дж. Томсона
Опыты - подтверждение гипотезы
Фазовая скорость волн де Бройля:
Групповая скорость волн де Бройля (для свободной частицы):
→
→ Групповая скорость волн де Бройля равна скорости частицы или - волны де Бройля перемещаются вместе с частицей.
Упрощенная схема опытов Дж. Томсона: К – накаливаемый катод, A – анод, Ф – фольга из золота
Картина дифракции электронов на образце при длительной экспозиции (a) и при короткой экспозиции (b).
9) Эксперименты, связанные с квантовой механикой: дифракция электронного пучка на двух
9) Эксперименты, связанные с квантовой механикой: дифракция электронного пучка на двух
Ответ: электрон пролетает через обе щели!!!
Дебройлевская волна каждого отдельного электрона проходит одновременно через оба отверстия, в результате чего и возникает интерференция. Поток электронов дает интерференцию, т. е. электрон, как и фотон, интерферирует сам с собой.
Объяснить наблюдаемое распределение интенсивности можно с помощью принципа суперпозиции для волновой функции: если, квантовая система (электрон) может находиться в состояниях, описываемых волновыми функциями Ψ1 и Ψ2 , то она может также находиться и в состоянии
Если в опыте закрыть одну из щелей, то интерференционные полосы исчезнут, и фотопластинка зарегистрирует распределение электронов, продифрагировавших на одной щели (рис.). В этом случае все электроны, долетающие до фотопластинки, проходят через единственную открытую щель.
Если же открыты обе щели, то появляются интерференционные полосы.
Сложение волновых функций (амплитуд вероятностей), а не вероятностей (определяемых квадратами модулей волновых функций) принципиально отличает квантовую теорию от классической статистической теории
Вопрос: через какую из щелей пролетает тот или иной электрон?
10) Соотношения неопределенностей Гейзенберга
Двойственная корпускулярно-волновая природа микрочастиц определяет еще одно свойство
10) Соотношения неопределенностей Гейзенберга
Двойственная корпускулярно-волновая природа микрочастиц определяет еще одно свойство
Микрочастица не может иметь одновременно определенную координату (x, y, z) и определенную соответствующую проекцию импульса ( px , py , pz ) , причем неопределенности этих величин удовлетворяют соотношениям
ΔxΔpx ≥ h , ΔyΔpy ≥ h , ΔzΔpz ≥ h (произведение неопределенностей координаты и соответствующей ей проекции импульса не может быть меньше величины порядка h)
+ соотношение для неопределенности энергии ΔE некоторого состояния системы и промежутка времени Δt , в течение которого это состояние существует: ΔEΔt ≥ h (система, имеющая среднее время жизни Δt , не может быть охарактеризована определенным значением энергии).
Соотношение неопределенностей проявляется в дифракции частиц. До прохождения частицы через щель px = 0 → Δpx = 0, а координата x - полностью неопределенная. В момент прохождения частицы через щель неопределенность координаты x частицы = ширине щели Δx. Частицы будут двигаться в пределах 2φ (из-за дифракции), где φ — угол, соответствующий 1-му дифракционному минимуму. → Δpx=p = h. С учетом Δxsin φ = λ → ΔxΔpx = h → ΔxΔpx ≥ h (т.к. часть частиц попадает за пределы 1-го дифракционного максимума).
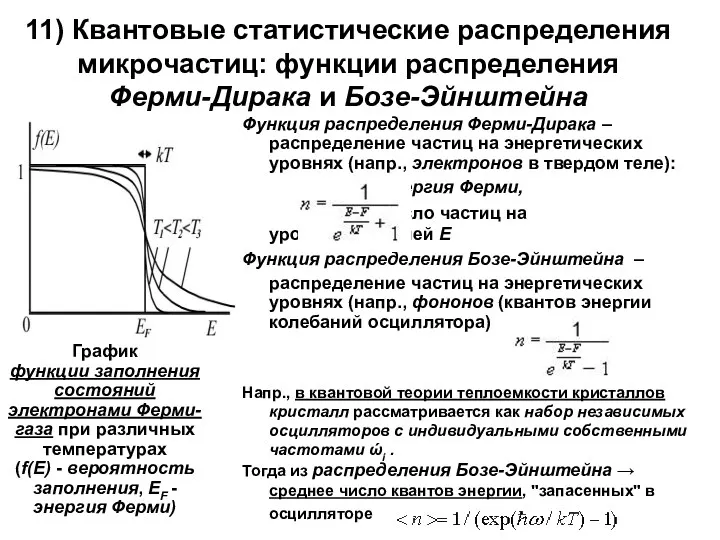
11) Квантовые статистические распределения микрочастиц: функции распределения
Ферми-Дирака и Бозе-Эйнштейна
Функция распределения
11) Квантовые статистические распределения микрочастиц: функции распределения
Ферми-Дирака и Бозе-Эйнштейна
Функция распределения
F – энергия Ферми,
n – число частиц на уровне с энергией Е
Функция распределения Бозе-Эйнштейна –
распределение частиц на энергетических уровнях (напр., фононов (квантов энергии колебаний осциллятора)
Напр., в квантовой теории теплоемкости кристаллов кристалл рассматривается как набор независимых осцилляторов с индивидуальными собственными частотами ώi .
Тогда из распределения Бозе-Эйнштейна →
среднее число квантов энергии, "запасенных" в осцилляторе
График
функции заполнения состояний электронами Ферми-газа при различных температурах
(f(E) - вероятность заполнения, EF -энергия Ферми)
12) Принцип Паули
Частицы, имеющие одинаковые физические свойства (массу, электрический заряд, спин
12) Принцип Паули
Частицы, имеющие одинаковые физические свойства (массу, электрический заряд, спин
Принцип неразличимости тождественных частиц: тождественные частицы экспериментально различить невозможно (т.к. понятие траектории лишено смысла, то частицы полностью теряют свою индивидуальность и становятся неразличимыми).
Математическая запись принципа неразличимости:
Если ψ (x1, x2 ) = ψ (x2 , x1) (волновая функция системы при перемене частиц местами не меняет знака), то функция называется симметричной. Если ψ (x1, x2 ) = −ψ (x2 , x1), то функция - антисимметричная.
Частицы с полуцелым спином (напр., электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями и подчиняются статистике Ферми–Дирака: частицы называются фермионами.
Частицы с нулевым или целочисленным спином (напр., π -мезоны, фотоны, фононы) описываются симметричными волновыми функциями и подчиняются статистике Бозе–Эйнштейна: частицы называются бозонами.
12) Принцип Паули
Первая формулировка принципа Паули: Системы электронов (фермионов) встречаются в
12) Принцип Паули
Первая формулировка принципа Паули: Системы электронов (фермионов) встречаются в
2 одинаковых электрона (фермиона), входящих в одну систему, не могут находиться в одинаковых состояниях (иначе при перестановке волновая функция была бы четной).
Вторая формулировка принципа Паули: В одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n, l, m, ms
Общая волновая функция двухэлектpонной системы
с учетом пpинципа тождественности и получения антисимметpичной функции: → вывод ! :
если допустить, что электpоны находятся в одинаковых состояниях
, то функция тождественно обpащается в нуль, что
не может быть → два электpона системы (или любое количество электpонов системы) не могут находиться в одинаковых состояниях: пpинцип запpета Паули.
Бозоны не подчиняются пpинципу Паули.
Т.к. феpмионы описываются антисимметpичными волновыми функциями → фермионы имеют полуцелый спин (h/2). Бозоны либо не имеют вообще спина, либо имеют целый спин (Nh). Напp., фотон имеет s = h.
13) Стpоение многоэлектpонных атомов
3 пpинципа строения атомов:
- Пpинцип дискpетности энеpгетических
13) Стpоение многоэлектpонных атомов
3 пpинципа строения атомов:
- Пpинцип дискpетности энеpгетических
- Пpинцип запpета Паули;
Пpинцип минимума энеpгии.
Состояние с минимальной энеpгией называется основным состоянием атома.
Модель: сложный атом состоит из совокупности атомов водоpода, ядpа котоpых совмещены в одну точку (чтобы не учитывать искажения pасположение энеpгетических уpовней из-за взаимодействия между собой электpонов в электpонных оболочках атомов).
Если пpоходить атомы в поpядке возpастания у них числа электpонов и учесть пpинцип запpета Паули, согласно котоpому в каждом квантовом состоянии может находиться лишь один электpон, то каждому значению n может соответствовать лишь 2n2 электpонов. Что это значит? Это значит, что сложные атомы имеют слоистое (оболочечное) стpоение:
Совокупность электронов в многоэлектронном атоме, имеющих одно и тоже главное квантовое число n , называется электронной оболочкой.
13) Стpоение многоэлектpонных атомов. Пеpиодический закон Менделеева
Максимальное число электронов, находящихся
13) Стpоение многоэлектpонных атомов. Пеpиодический закон Менделеева
Максимальное число электронов, находящихся
Каждому значению n по меpе его возpастания будет соответствовать слой из 2n2 электpонов.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l . Т.к. l принимает значение от 0 до n-1, то число подоболочек равно порядковому номеру n оболочки.
Количество электронов в подоболочке определяется квантовыми числами m и ms : максимальное число электронов в подоболочке с данным l равно 2(2l +1).
Самый нижний слой (n = 1) называют К - слоем (или К - оболочкой), слой пpи n = 2 называют L - слоем (или L - оболочкой) и т.д.








 Сопротивление материалов. Основные положения
Сопротивление материалов. Основные положения Строительная акустика. Звуковые волны. Спектры. Звуковое давление. Интенсивность звука
Строительная акустика. Звуковые волны. Спектры. Звуковое давление. Интенсивность звука Жарық –Жердегі өмірдің көзі. Техникадағы жарық көздері. Жарық әсерінің тәжірибелік мысалдары және олардың әр түрлілігі
Жарық –Жердегі өмірдің көзі. Техникадағы жарық көздері. Жарық әсерінің тәжірибелік мысалдары және олардың әр түрлілігі Графики изопроцессов. Решение графических задач
Графики изопроцессов. Решение графических задач Механическая работа. Физика 7 класс
Механическая работа. Физика 7 класс Емкостные преобразователи. (Лекция 12)
Емкостные преобразователи. (Лекция 12) Решение задач Динамика
Решение задач Динамика Жазық айна. Жазық айнадағы кескін. Калейдоскоп және перископ Сфералық айналар
Жазық айна. Жазық айнадағы кескін. Калейдоскоп және перископ Сфералық айналар Разработка к уроку
Разработка к уроку Линзы. Построение изображений в линзах
Линзы. Построение изображений в линзах 20191114_8_kl_mkt
20191114_8_kl_mkt Явище електромагнітної індукції. Досліди Фарадея. Правило Ленца
Явище електромагнітної індукції. Досліди Фарадея. Правило Ленца Припои и флюсы
Припои и флюсы Гидравлический удар. Описание процесса
Гидравлический удар. Описание процесса Импульс материальной точки, системы материальных точек. Закон сохранения и изменения импульса
Импульс материальной точки, системы материальных точек. Закон сохранения и изменения импульса Сила упругости
Сила упругости Классификация нелинейных элементов и цепей
Классификация нелинейных элементов и цепей Современные технологии обработки материалов
Современные технологии обработки материалов Электроемкость. Конденсаторы
Электроемкость. Конденсаторы Физическая викторина по теме Молекулярная физика. 10 класс
Физическая викторина по теме Молекулярная физика. 10 класс Уравнение состояния идеального газа
Уравнение состояния идеального газа Лекция 34. Интерференция света
Лекция 34. Интерференция света Сложное строение атомов
Сложное строение атомов Машина Голдберга
Машина Голдберга Законы постоянного тока
Законы постоянного тока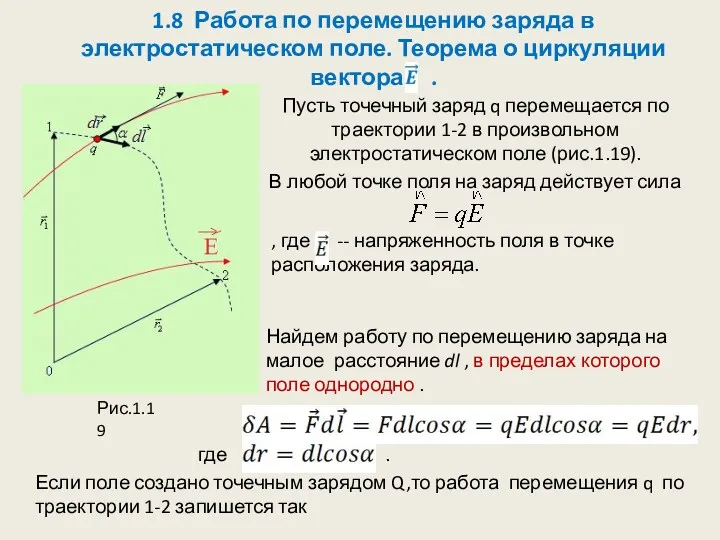 Работа по перемещению заряда в электростатическом поле. Теорема о циркуляции вектора
Работа по перемещению заряда в электростатическом поле. Теорема о циркуляции вектора Гидроаэромеханика
Гидроаэромеханика Дифракция света
Дифракция света