Содержание
- 2. ПРОВЕРКА РЕШЕНИЯ ЗАДАЧ
- 3. ВОПРОСЫ Что называется идеальным газом? Назовите макроскопические параметры Как температуру выразить в кельвинах? Почему не может
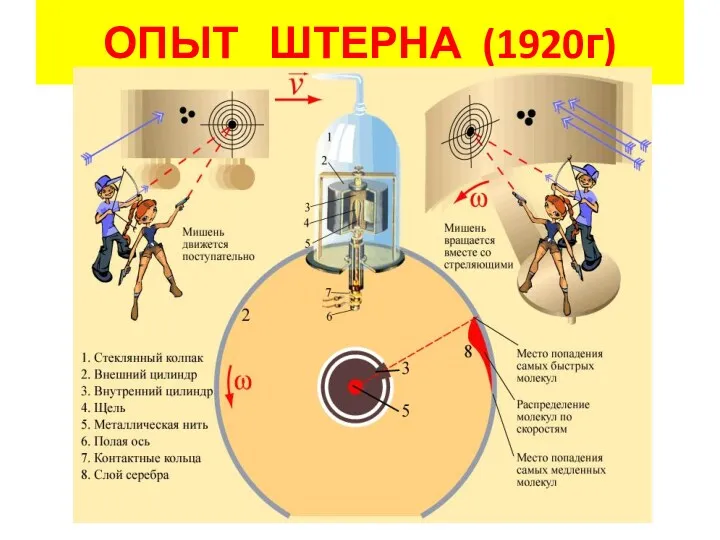
- 4. ОПЫТ ШТЕРНА (1920г)
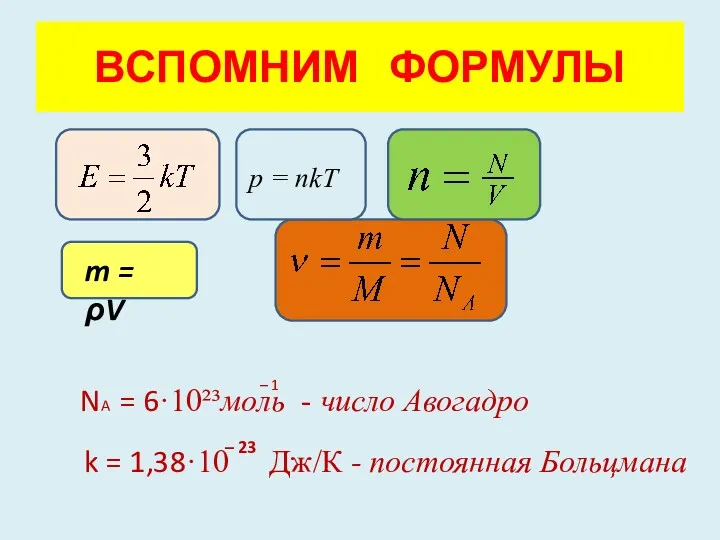
- 5. ВСПОМНИМ ФОРМУЛЫ р = nkT m = ρV NA = 6·10²³моль - число Авогадро k =
- 6. ОБЪЕДИНИМ ПАРАМЕТРЫ p, V, T Объединим три формулы: 1) 2) 3) Получим: заменим R = kNA
- 7. Уравнение Менделеева – Клайперона
- 8. Еще две полезные формулы pV = νRT где ν – количество вещества (моль) ρ – плотность
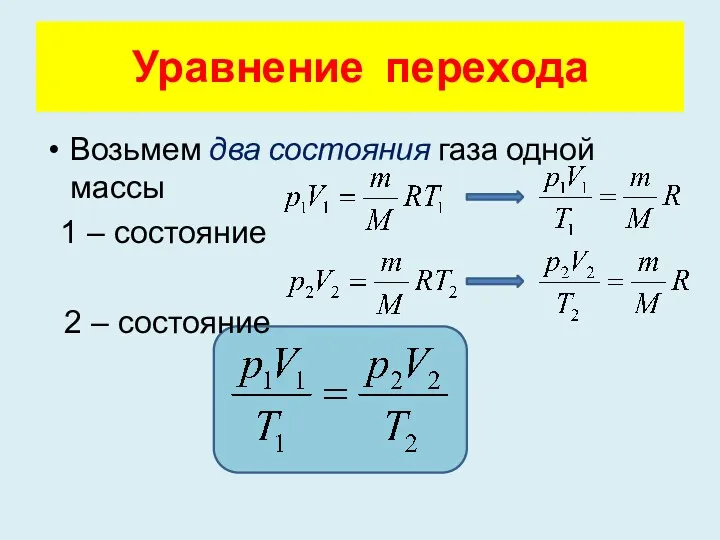
- 9. Уравнение перехода Возьмем два состояния газа одной массы 1 – состояние 2 – состояние
- 10. НОРМАЛЬНЫЕ УСЛОВИЯ 1. Давление равно атмосферному р=1атм= 1,013·10 Па ≈10 Па 2. Температура равна 0ºС Т
- 11. ЗАДАЧА Дано: Решение ν = 1моль р = 100000Па Т = 273К V - ?
- 12. ЗАДАЧА Дано: Решение ν = 1моль р = 100000Па Т = 273К V - ? pV
- 13. ЗАДАЧА Дано: Решение ν = 1моль р = 100000Па Т = 273К V - ? Ответ:
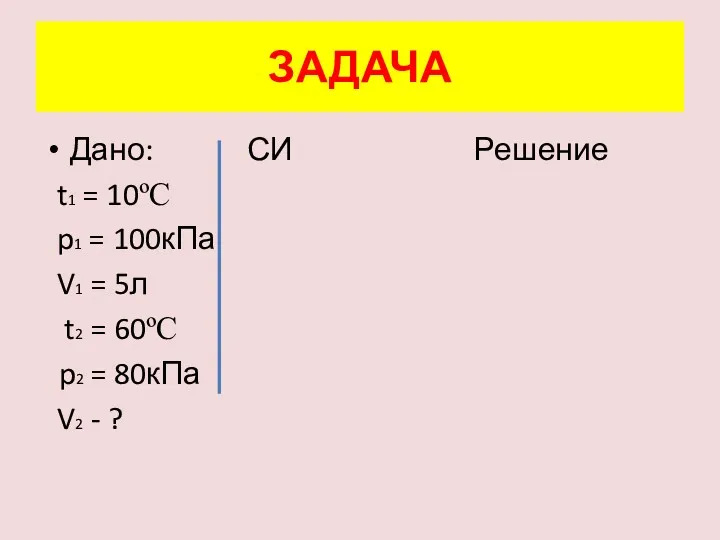
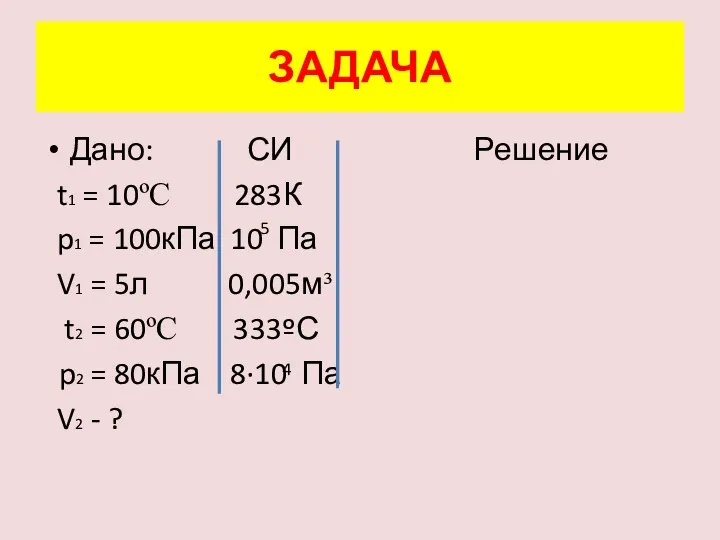
- 14. ЗАДАЧА При температуре 10ºС и давлении 100 кПа воздух занимает объём 5л. Каким будет объём данной
- 15. Дано: СИ Решение t1 = 10ºC p1 = 100кПа V1 = 5л t2 = 60ºC p2
- 16. Дано: СИ Решение t1 = 10ºC 283К p1 = 100кПа 10 Па V1 = 5л 0,005м³
- 17. Дано: СИ Решение t1 = 10ºC 283К p1 = 100кПа 10 Па V1 = 5л 0,005м³
- 18. Дано: СИ Решение t1 = 10ºC 283К p1 = 100кПа 10 Па V1 = 5л 0,005м³
- 20. Скачать презентацию












 Удивительные физические свойства воды
Удивительные физические свойства воды Зависимость силы Архимеда от различных параметров
Зависимость силы Архимеда от различных параметров Выбор режимов при ручной дуговой сварке
Выбор режимов при ручной дуговой сварке Все что надо знать об ОГЭ по физике
Все что надо знать об ОГЭ по физике Экологические проблемы тепловых двигателей
Экологические проблемы тепловых двигателей Способы герметизации клепаных швов и изделий
Способы герметизации клепаных швов и изделий презентацияЗакон сохранения энергии.
презентацияЗакон сохранения энергии. Пластическая деформация
Пластическая деформация Закон Кулона. Единица электрического заряда
Закон Кулона. Единица электрического заряда Реактивний рух в природі
Реактивний рух в природі Урок решения задач по теме: Средняя скорость (7 класс)
Урок решения задач по теме: Средняя скорость (7 класс) Тест для подготовки к ГИА по физике
Тест для подготовки к ГИА по физике Типы оптических спектров. Спектральный анализ
Типы оптических спектров. Спектральный анализ Гидродинамика Солнца. (Лекция 6)
Гидродинамика Солнца. (Лекция 6) Атомның энергетикалық деңгейлері
Атомның энергетикалық деңгейлері Глобальная экология. Энергетическая проблема. Традиционные энергоносители
Глобальная экология. Энергетическая проблема. Традиционные энергоносители Охлаждение воды. Опыты
Охлаждение воды. Опыты Молекулярная физика и электродинамика, обобщение темы
Молекулярная физика и электродинамика, обобщение темы Конденсатори
Конденсатори Интерференция при отражении от тонких пластинок
Интерференция при отражении от тонких пластинок Постулаты Бора. Модель атома водорода по Бору
Постулаты Бора. Модель атома водорода по Бору Вакуумные винтовые сухие безмасляные насосы LGB
Вакуумные винтовые сухие безмасляные насосы LGB Спектры. Виды спектров. Спектральный анализ
Спектры. Виды спектров. Спектральный анализ Действие магнитного поля на проводник с током и движущуюся заряженную частицу
Действие магнитного поля на проводник с током и движущуюся заряженную частицу Равновесие тел. Решение задач
Равновесие тел. Решение задач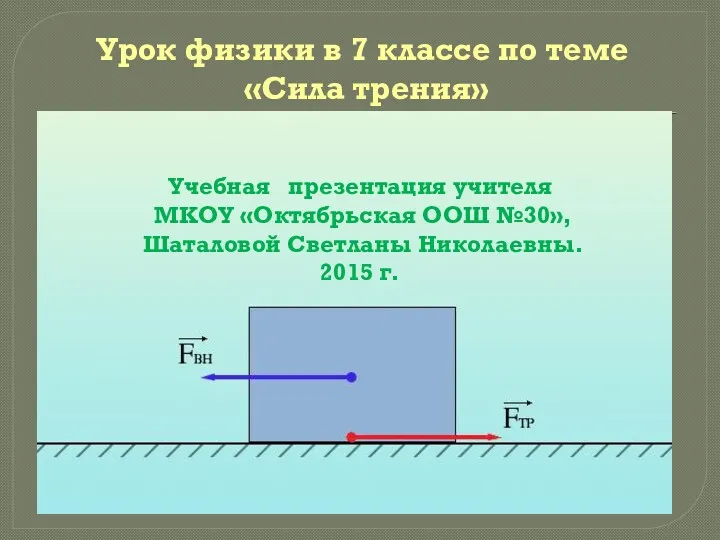 Сила трения
Сила трения Электрический ток в полупроводниках
Электрический ток в полупроводниках Расчет массы и объема тела по его плотности
Расчет массы и объема тела по его плотности