Содержание
- 2. В 1775 годуВ 1775 году Парижская академия наукВ 1775 году Парижская академия наук приняла решение не
- 3. Термодинамические процессы идеального газа
- 4. К основным процессам относятся: Изохорный (при постоянном объеме); Изобарный (при постоянном давлении); Изотермический (при постоянной температуре);
- 5. Политропный процесс Постоянство теплоемкости определяет закономерность изменения параметров в политропном процессе. Изохорный, изобарный, изотермический и адиабатный
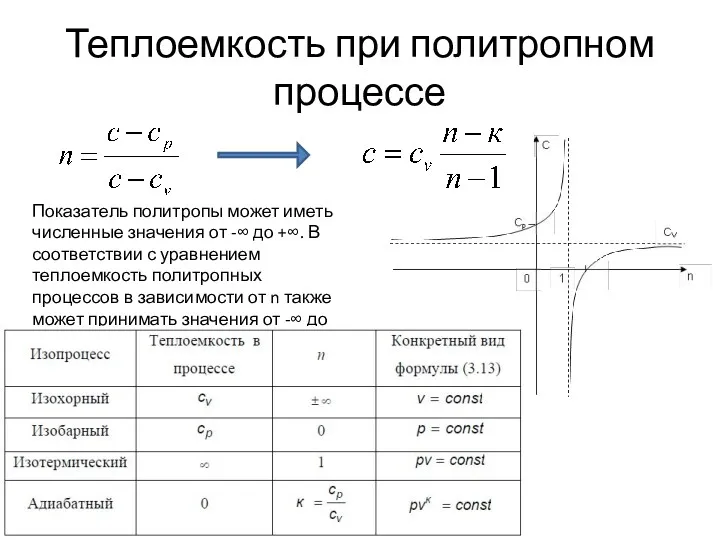
- 6. Показатель политропы Первый закон термодинамики: ∂q=cdT=dh-vdp=cpdT-vdp; ∂q=cdT=du+pdv=cvdT+pdv. (c-cp)dT = - vdp, (c-cv)dT = pdv . pvn
- 7. Взаимосвязь основных параметров
- 8. Теплоемкость при политропном процессе Показатель политропы может иметь численные значения от -∞ до +∞. В соответствии
- 9. Изменение основных параметров . u2 - u1 = cv(T2 - T1) h2 - h1 = cp(T2
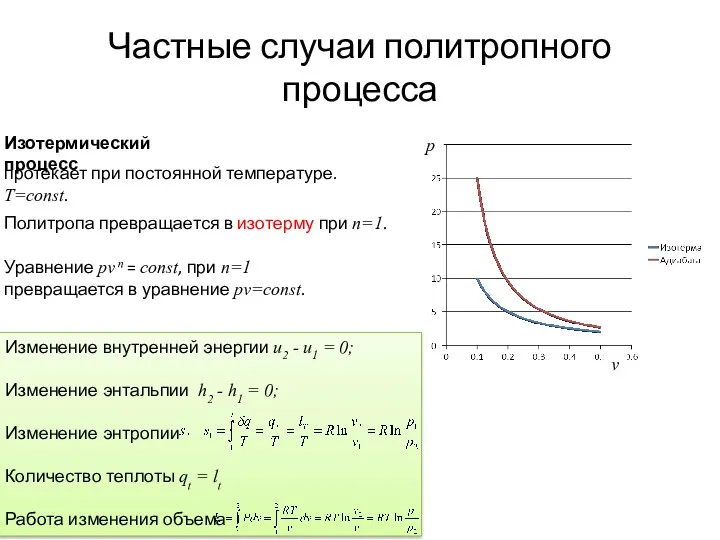
- 10. Изменение внутренней энергии u2 - u1 = cv(T2 - T1); Изменение энтальпии h2 - h1 =
- 11. Изменение внутренней энергии u2 - u1 = cv(T2 - T1); Изменение энтальпии h2 - h1 =
- 12. Изменение внутренней энергии u2 - u1 = 0; Изменение энтальпии h2 - h1 = 0; Изменение
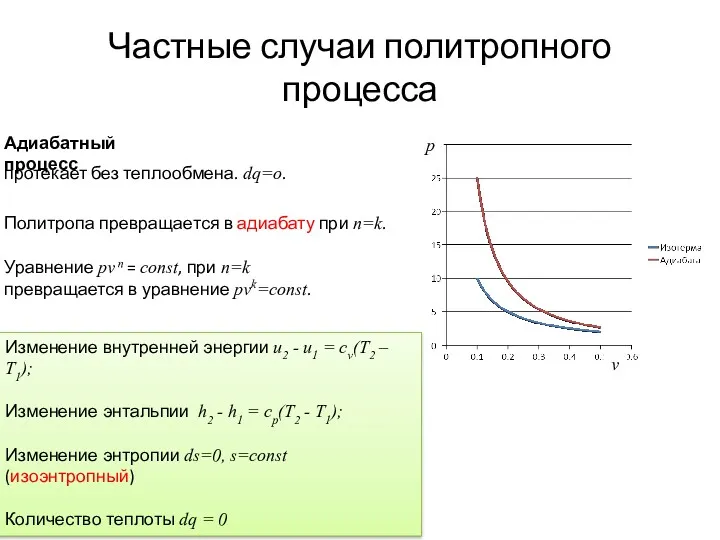
- 13. Изменение внутренней энергии u2 - u1 = cv(T2 – T1); Изменение энтальпии h2 - h1 =
- 16. - 0,014 0,515 0,515 - 0,014
- 17. Изобарный Изохорный Изотермический Изменение внутренней энергии u2 - u1 = cv(T2 – T1); Изменение энтальпии h2
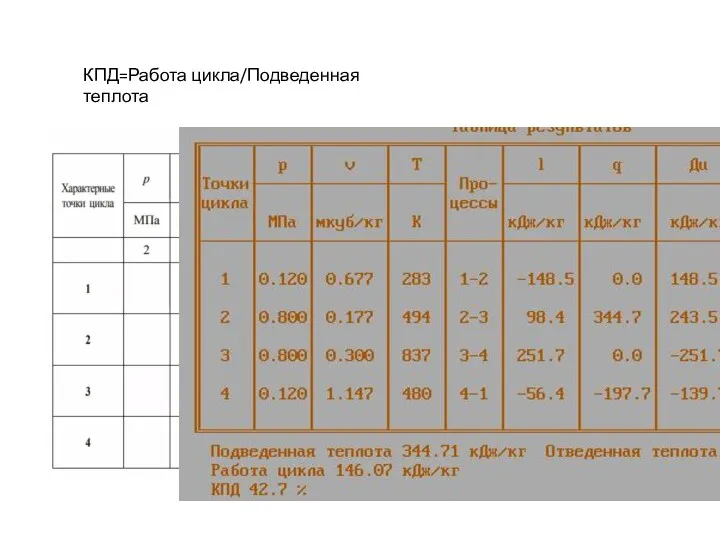
- 19. КПД=Работа цикла/Подведенная теплота
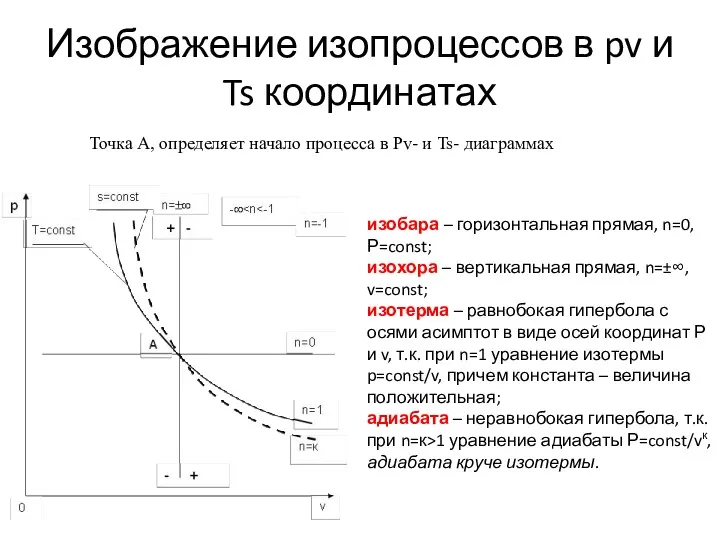
- 20. Изображение изопроцессов в pv и Ts координатах изобара – горизонтальная прямая, n=0, Р=const; изохора – вертикальная
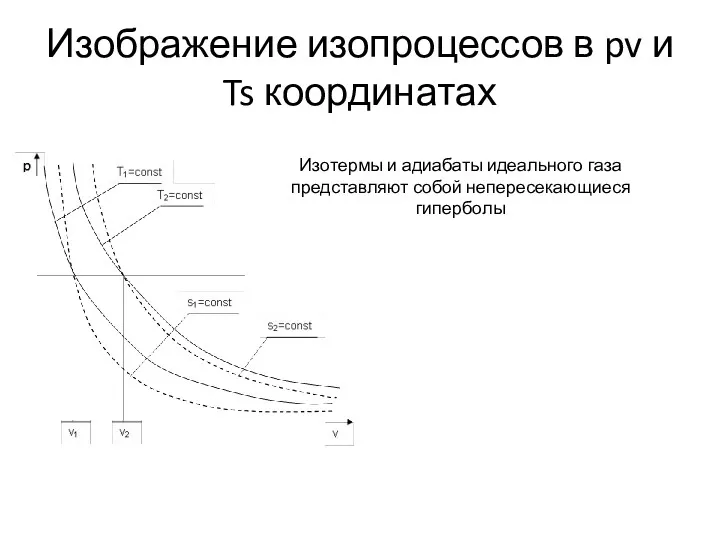
- 21. Изображение изопроцессов в pv и Ts координатах Изотермы и адиабаты идеального газа представляют собой непересекающиеся гиперболы
- 22. Изображение изопроцессов в pv и Ts координатах Политропа в координатах Ts – логарифмическая кривая Чем больше
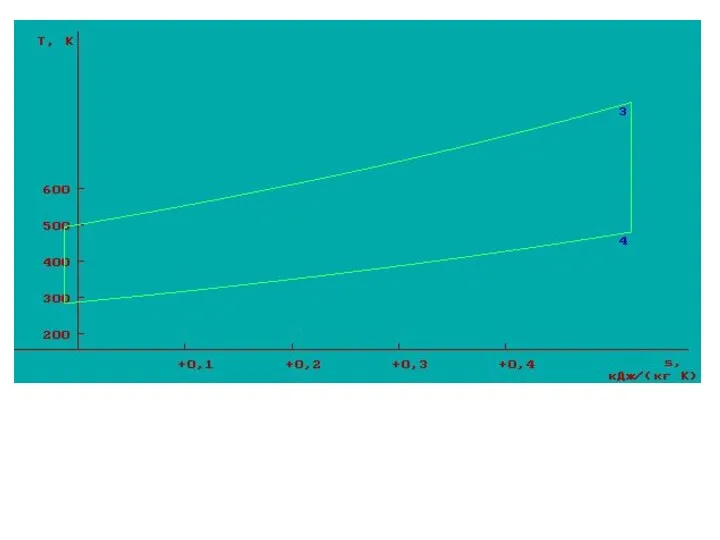
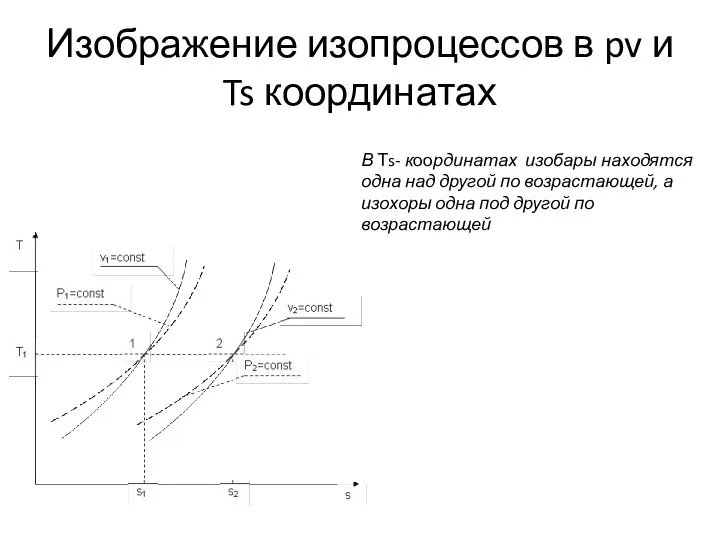
- 23. Изображение изопроцессов в pv и Ts координатах В Тs- координатах изобары находятся одна над другой по
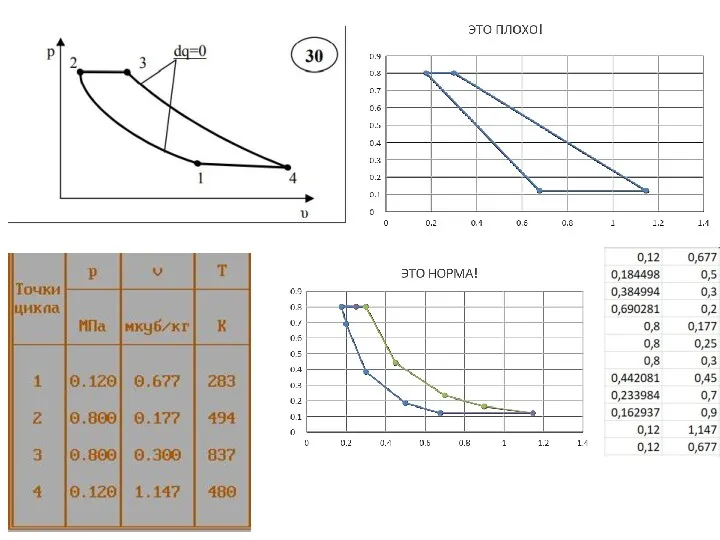
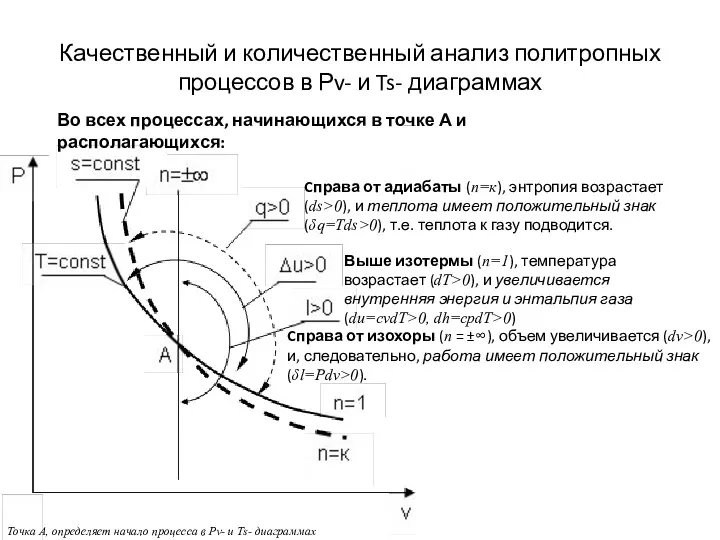
- 24. Качественный и количественный анализ политропных процессов в Рv- и Ts- диаграммах Точка А, определяет начало процесса
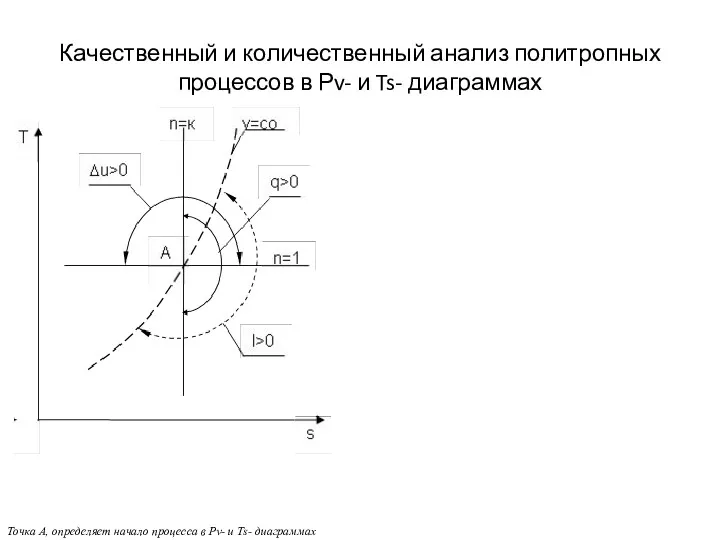
- 25. Качественный и количественный анализ политропных процессов в Рv- и Ts- диаграммах Точка А, определяет начало процесса
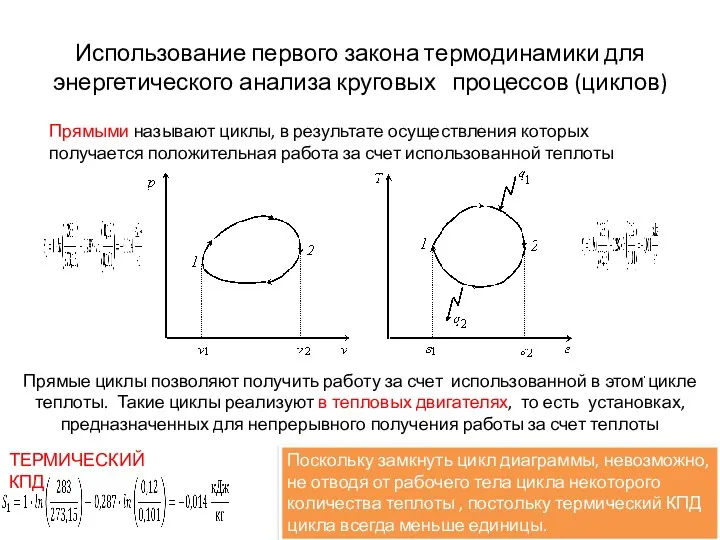
- 26. Использование первого закона термодинамики для энергетического анализа круговых процессов (циклов) Уравнение первого закона термодинамики для циклов
- 27. Прямыми называют циклы, в результате осуществления которых получается положительная работа за счет использованной теплоты Использование первого
- 29. Скачать презентацию













 Электромагниттік сәуле шығару
Электромагниттік сәуле шығару Особенности заданий ЕГЭ. Колебания и волны
Особенности заданий ЕГЭ. Колебания и волны Линзы. Построение изображения в собирающей линзе
Линзы. Построение изображения в собирающей линзе Остов, кривошипно-шатунний та газорозподільний механізми ДВЗ. (Лекція 3.1)
Остов, кривошипно-шатунний та газорозподільний механізми ДВЗ. (Лекція 3.1) Структура и принципы интеграции МС
Структура и принципы интеграции МС Диэлектрики в электрическом поле
Диэлектрики в электрическом поле Перемещение при прямолинейном равномерном движении
Перемещение при прямолинейном равномерном движении Основные положения молекулярно-кинетической теории и их опытные подтверждения
Основные положения молекулярно-кинетической теории и их опытные подтверждения Электронная проводимость металлов. Электрический ток и его характеристики
Электронная проводимость металлов. Электрический ток и его характеристики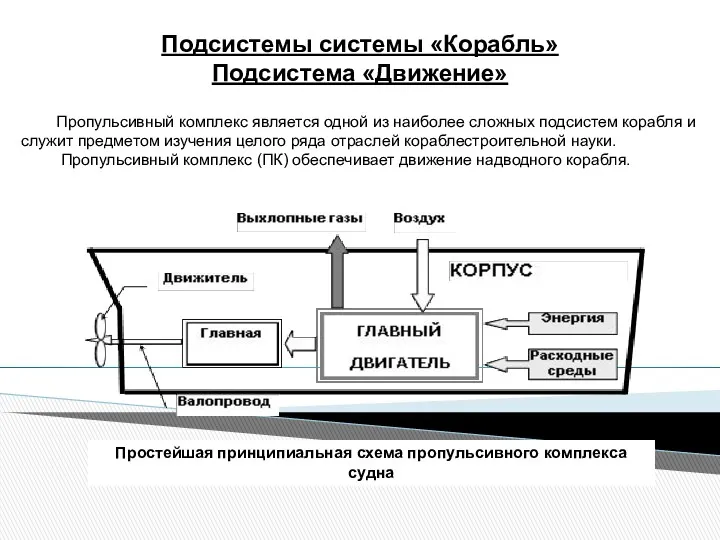 Подсистемы системы Корабль. Подсистема Движение
Подсистемы системы Корабль. Подсистема Движение Известные физики
Известные физики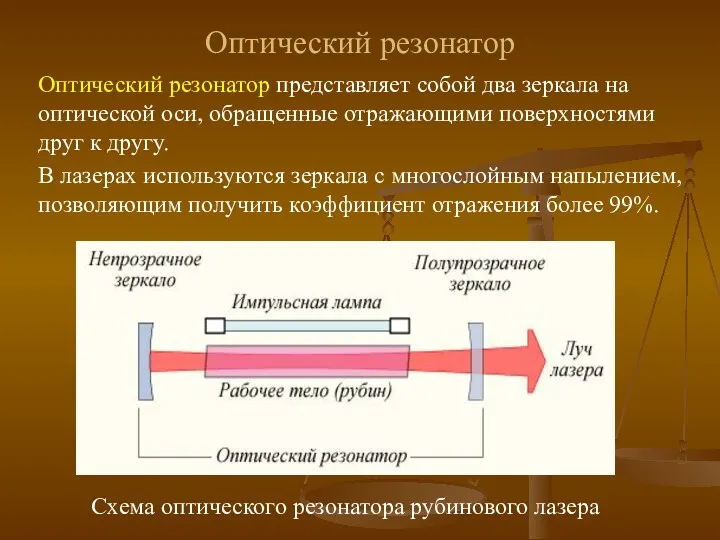 Оптический резонатор
Оптический резонатор Презентация 10 класса Газовые законы
Презентация 10 класса Газовые законы Специальная теория относительности
Специальная теория относительности Презентация Интерференция света
Презентация Интерференция света Презентация доклада системнодеятельностного подхода на уроках физики
Презентация доклада системнодеятельностного подхода на уроках физики Уравнения Максвелла
Уравнения Максвелла Движение по окружности
Движение по окружности Занятие № 1 Методы повышения эффективности усвоения понятийпри изучении темы:Кинематика
Занятие № 1 Методы повышения эффективности усвоения понятийпри изучении темы:Кинематика Детекторы нейтронов
Детекторы нейтронов Презентация 8 класс. Количество теплоты. Едельная теплоемкость
Презентация 8 класс. Количество теплоты. Едельная теплоемкость Водородная бомба
Водородная бомба Решение физических задач с применением производной функции
Решение физических задач с применением производной функции Презентация Броуновское движение. Диффузия. Взаимодействие молекул
Презентация Броуновское движение. Диффузия. Взаимодействие молекул Сила трения. Особенности сил трения
Сила трения. Особенности сил трения Способы герметизации клепаных швов и изделий
Способы герметизации клепаных швов и изделий Урок и презентация по теме Плавание тел 7 класс
Урок и презентация по теме Плавание тел 7 класс Биологическое действие радиации. Закон радиоактивного распада
Биологическое действие радиации. Закон радиоактивного распада