Содержание
- 2. Квантовое число j – полуцелое и положительное, при l = 0, j = s = ½.
- 3. В случае l = 0, квантовое число полного момента j имеет только одно значение: j =
- 4. Уровни (или термы) имеют символическое обозначение: νLj где L – символ состояния, определяемого квантовым числом l,
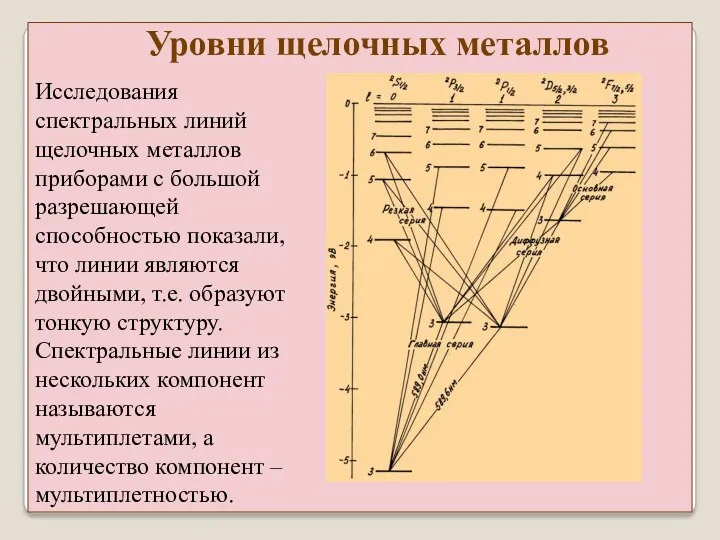
- 5. Исследования спектральных линий щелочных металлов приборами с большой разрешающей способностью показали, что линии являются двойными, т.е.
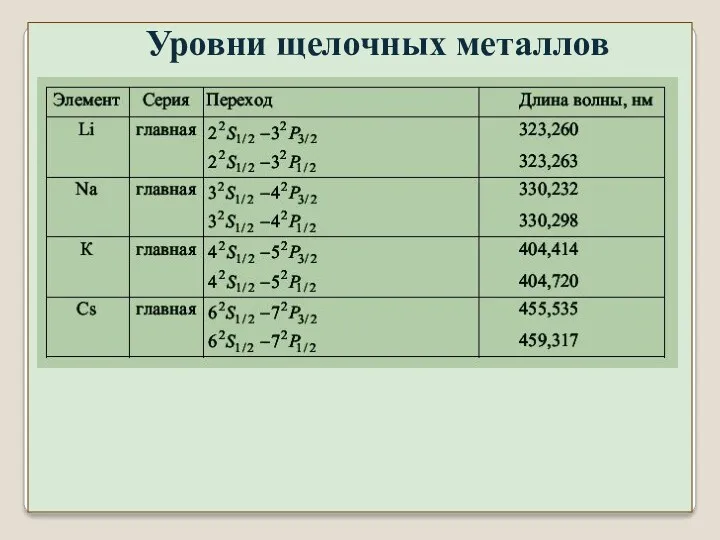
- 6. Уровни щелочных металлов
- 7. Для щелочных металлов расщепление энергетических уровней мало по сравнению с расстоянием между основными уровнями. Тонкая структура
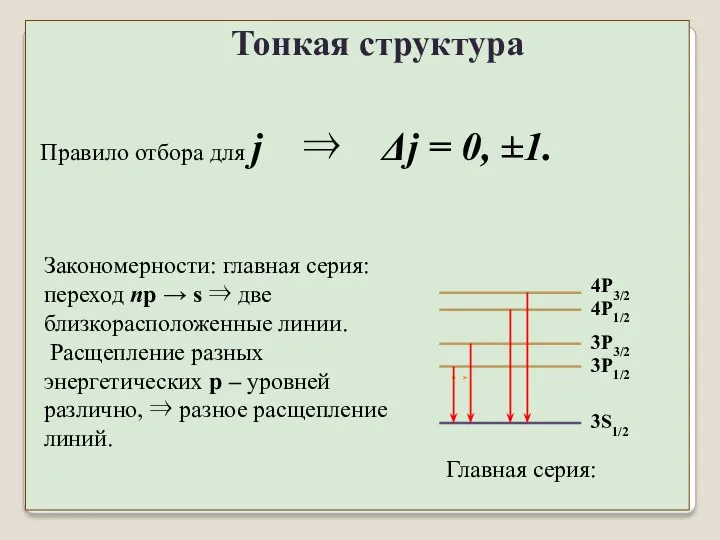
- 8. Правило отбора для j ⇒ Δj = 0, ±1. Закономерности: главная серия: переход np → s
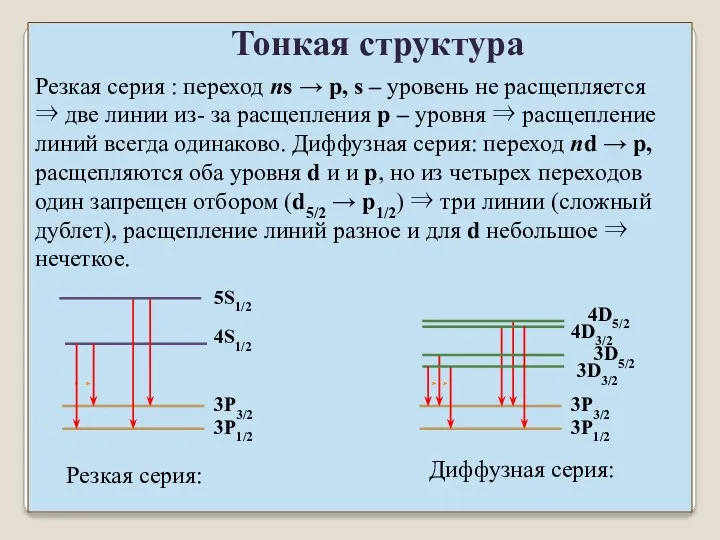
- 9. Резкая серия : переход ns → p, s – уровень не расщепляется ⇒ две линии из-
- 10. Многоэлектронные атомы Каждый электрон в атоме обладает орбитальным и собственным моментами. ⇒ соответствующие магнитные моменты, ⇒
- 11. Орбитальные моменты взаимодействуют между собой сильнее чем со спинами, аналогично спины тоже сильнее взаимодействуют между собой,
- 12. Многоэлектронные атомы
- 13. Многоэлектронные атомы
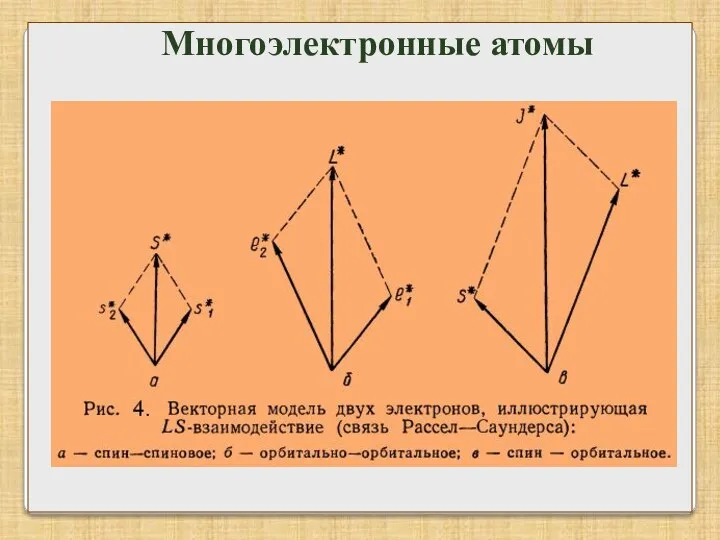
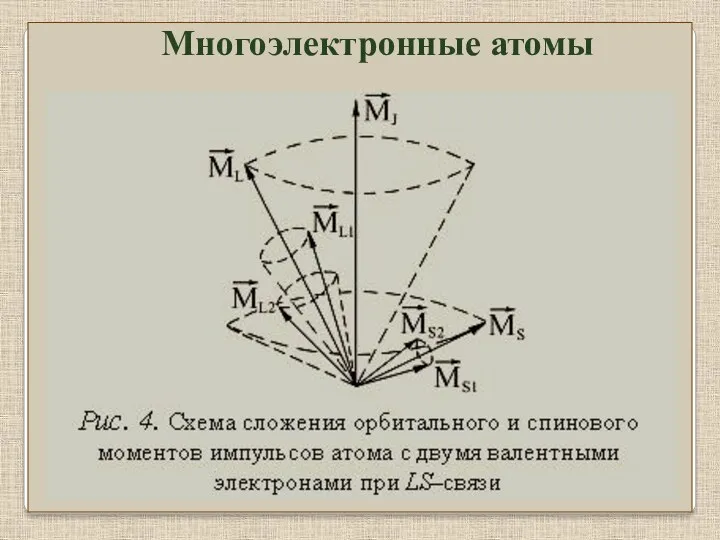
- 14. Второй случай: орбитальный момент и спин каждого электрона складываются в полный момент а затем моменты всех
- 15. Сложение моментов происходит по квантовым законам. Процедура: Сложение двух моментов: квантовое число L = l1 +
- 16. Многоэлектронные атомы
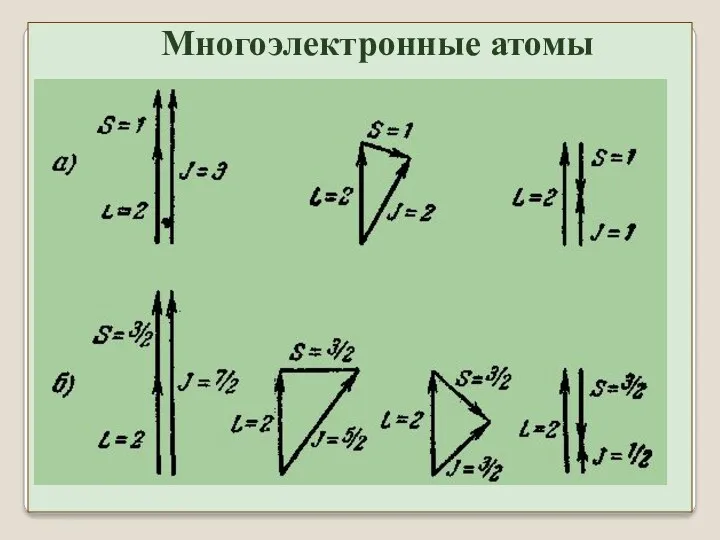
- 17. При данных L и S квантовое число результирующего момента J будет целым или полуцелым, в зависимости
- 18. Энергия атома зависит от взаимной ориентации всех моментов , и суммарных между собой. Правила отбора: ΔL
- 19. Магнитный момент атома Определенное экспериментально гиромагнитное соотношение для орбитального момента совпадает с классическим. Гиромагнитное соотношение для
- 20. Фактор Ланде: Если S = 0, то J = L и g = 1, если L
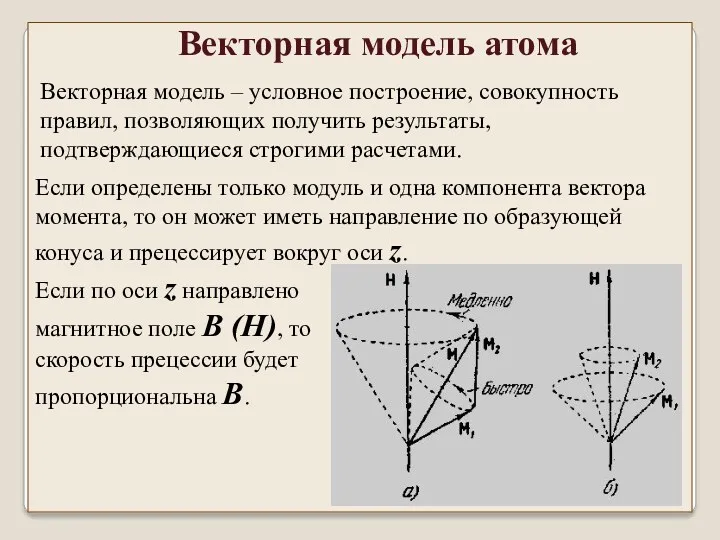
- 21. Векторная модель атома Векторная модель – условное построение, совокупность правил, позволяющих получить результаты, подтверждающиеся строгими расчетами.
- 22. По правилам векторной модели складываемые моменты L1 и L2 прецессируют вокруг направления результирующего момента. Через магнитные
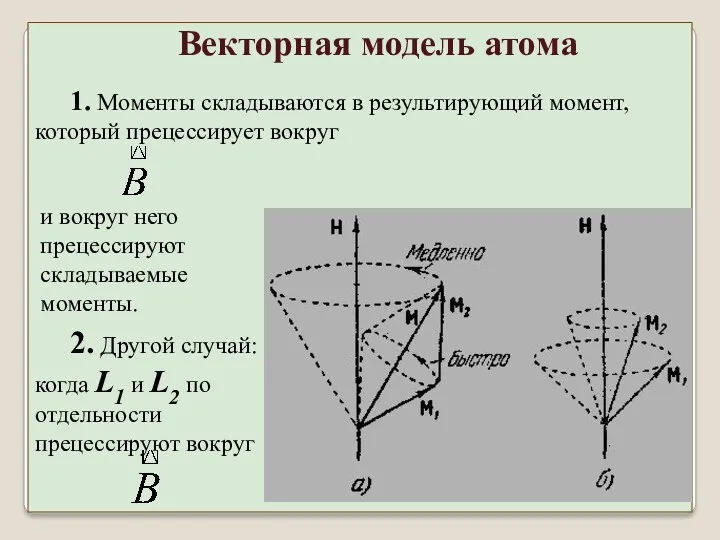
- 23. 1. Моменты складываются в результирующий момент, который прецессирует вокруг и вокруг него прецессируют складываемые моменты. 2.
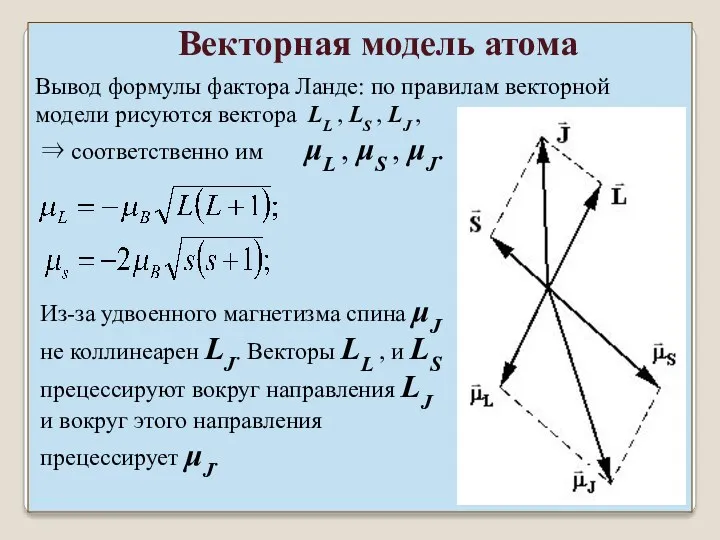
- 24. Вывод формулы фактора Ланде: по правилам векторной модели рисуются вектора LL , LS , LJ ,
- 25. Среднее значение: направлено по линии LJ. Его и нужно найти. Векторная модель атома ⇒
- 26. Аналогично ⇒ Векторная модель атома
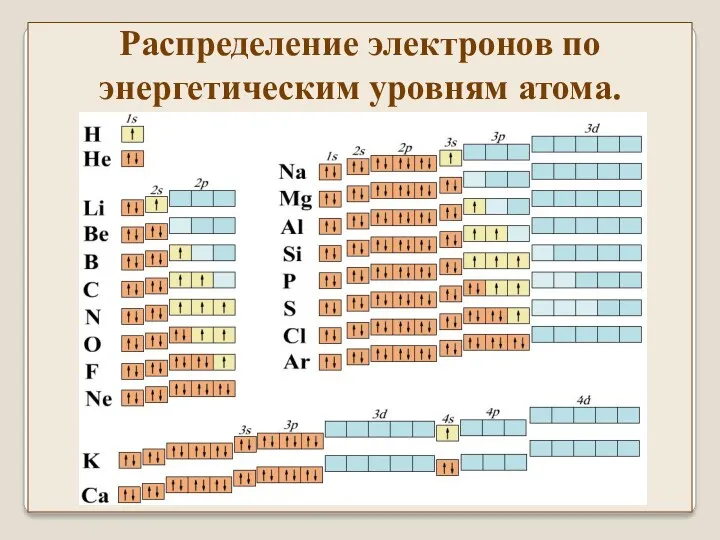
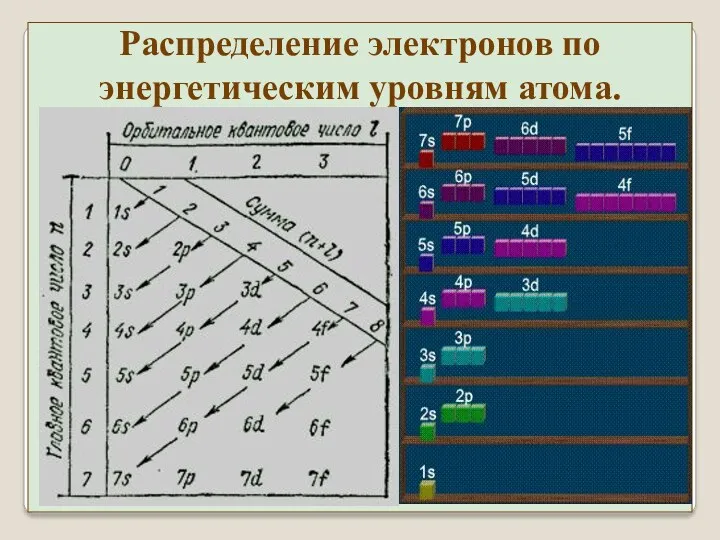
- 27. Распределение электронов по энергетическим уровням атома. В основном (невозбужденном) состоянии атома электроны должны располагаться на самых
- 28. Совокупность электронов с одинаковым n образуют оболочку. Разделяется на подоболочки, отличающиеся числом l. На оболочке могут
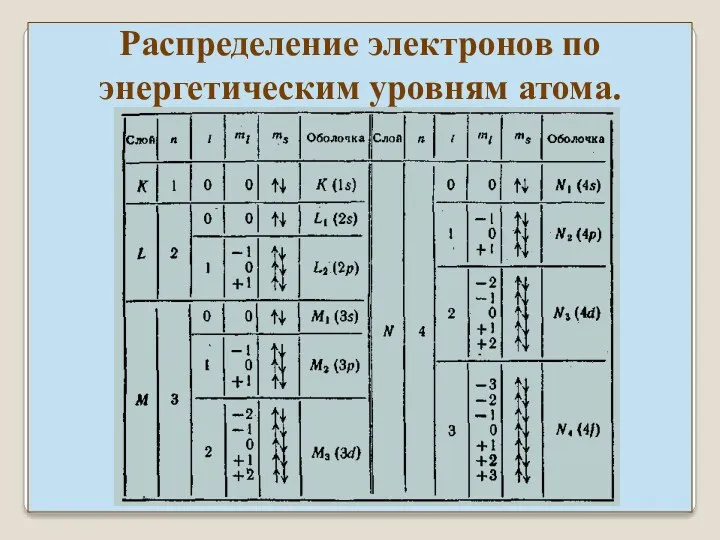
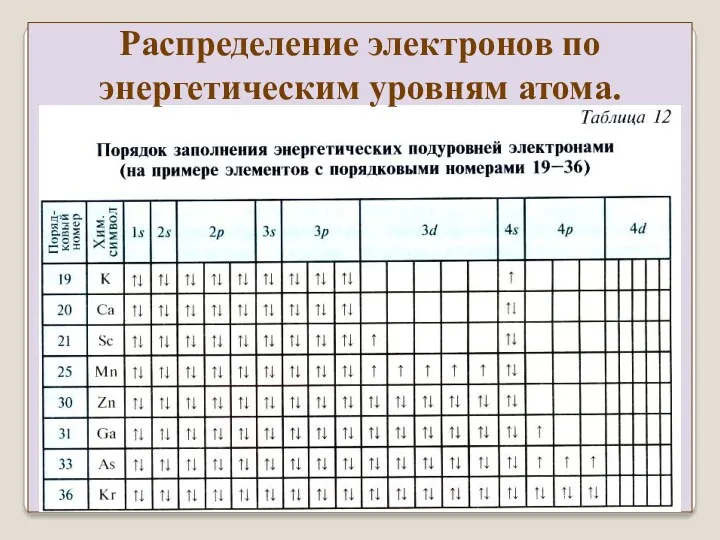
- 29. Распределение электронов по энергетическим уровням атома.
- 30. Распределение электронов по энергетическим уровням атома.
- 31. Для полностью заполненной оболочки характерно равенство нулю суммарных моментов: и спинового и орбитального (L = 0,
- 32. Распределение электронов по энергетическим уровням атома. При заполнении подоболочек с l ≥ 1 используется два эмпирические
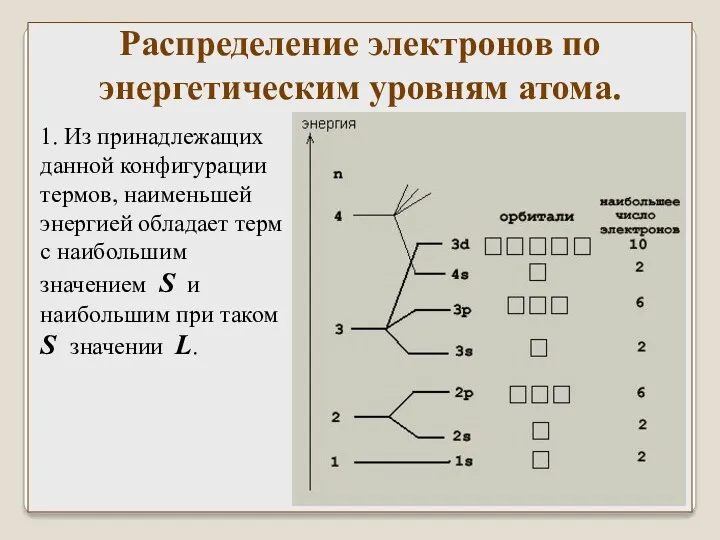
- 33. Распределение электронов по энергетическим уровням атома. 1. Из принадлежащих данной конфигурации термов, наименьшей энергией обладает терм
- 34. 2. Если заполнено не более половины подоболочки то J = |L – S|, в остальных случаях
- 35. Распределение электронов по энергетическим уровням атома.
- 36. Распределение электронов по энергетическим уровням атома.
- 37. Распределение электронов по энергетическим уровням атома.
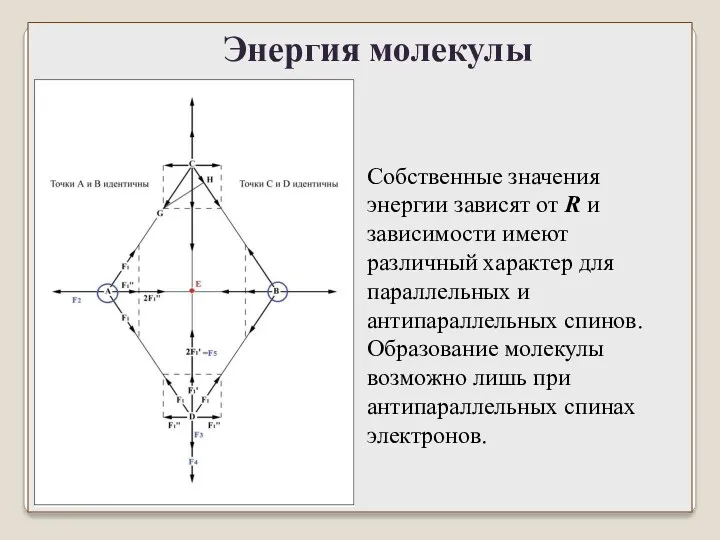
- 38. Энергия молекулы Силы, удерживающие атомы в молекуле, вызваны действием внешних электронов. Электроны внутренних оболочек при объединении
- 39. Для молекулы водорода: Потенциальная энергия Оператор Лапласа записывается для каждого электрона. ⇒ уравнение Шредингера для молекулы
- 40. Собственные значения энергии зависят от R и зависимости имеют различный характер для параллельных и антипараллельных спинов.
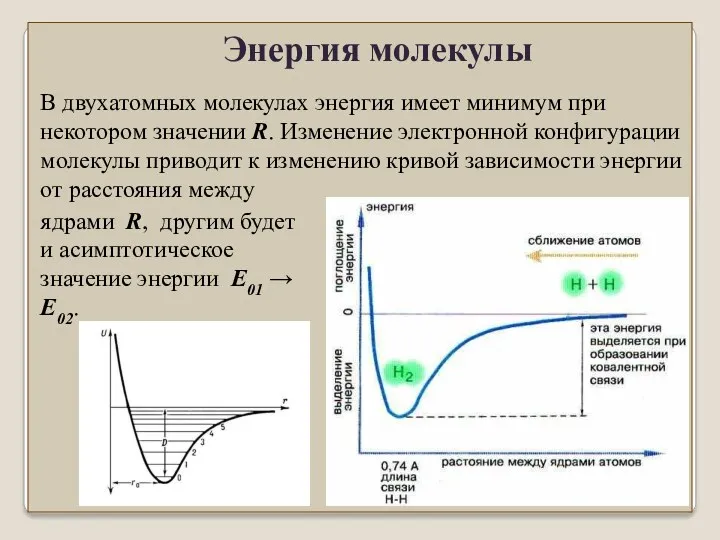
- 41. В двухатомных молекулах энергия имеет минимум при некотором значении R. Изменение электронной конфигурации молекулы приводит к
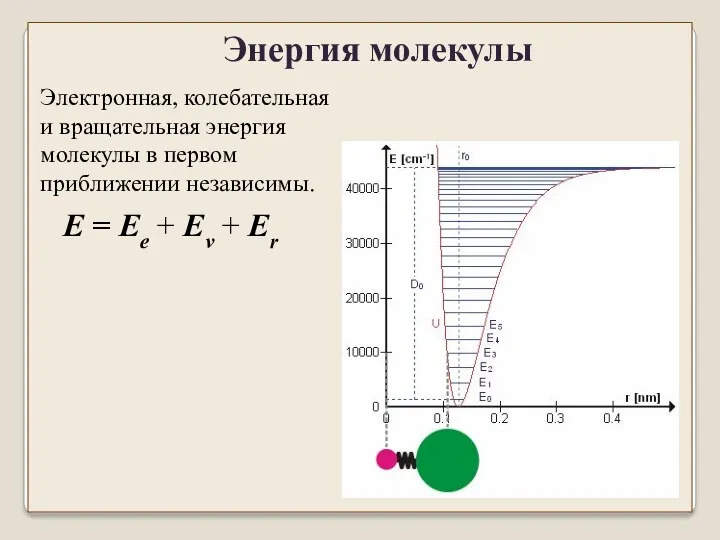
- 42. Электронная, колебательная и вращательная энергия молекулы в первом приближении независимы. E = Ee + Eν +
- 44. Скачать презентацию























 Другий закон термодинамiки
Другий закон термодинамiки Свойства воды
Свойства воды Классификация измерений. Классификация погрешностей
Классификация измерений. Классификация погрешностей Возможности ЛТЛС
Возможности ЛТЛС Мир электричества
Мир электричества Атом, атомное ядро, атомная энергия
Атом, атомное ядро, атомная энергия Фрезерные станки. (Тема 6)
Фрезерные станки. (Тема 6) Общие сведения о направляющих системах
Общие сведения о направляющих системах Лазерное излучение
Лазерное излучение Электрический ток в газах
Электрический ток в газах Тормозные механизмы легковых и грузовых автомобилей и автобусов. Тема 4.11
Тормозные механизмы легковых и грузовых автомобилей и автобусов. Тема 4.11 Методические разработки
Методические разработки Колебания-1. Гармоническое колебание и его характеристики. Модель гармонического осциллятора
Колебания-1. Гармоническое колебание и его характеристики. Модель гармонического осциллятора Физика и познание мира
Физика и познание мира Назначение, конструкция, технические характеристики, принцип действия, основные неисправности тележки
Назначение, конструкция, технические характеристики, принцип действия, основные неисправности тележки Техническое обслуживание и ремонт рулевого управления автомобиля КамАЗ-5320
Техническое обслуживание и ремонт рулевого управления автомобиля КамАЗ-5320 ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ
ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ Фотоника. Прикладная оптика
Фотоника. Прикладная оптика Спектры. Качественные задачи
Спектры. Качественные задачи Снегоуборочники
Снегоуборочники Электрические явления в природе и технике
Электрические явления в природе и технике Физика волн. (Лекция 12)
Физика волн. (Лекция 12) Общие сведения об организации ТО и ремонта автомобиля
Общие сведения об организации ТО и ремонта автомобиля Характеристика жидкого состояния вещества
Характеристика жидкого состояния вещества Protein Structures: Thermodynamic aspects
Protein Structures: Thermodynamic aspects Магнитное поле. Применение правил Кирхгофа
Магнитное поле. Применение правил Кирхгофа Сравнительные характеристики источников света. Аудиторная индивидуальная работа
Сравнительные характеристики источников света. Аудиторная индивидуальная работа Техническая термодинамика. Теплопроводность при стационарном режиме. (Лекция 9)
Техническая термодинамика. Теплопроводность при стационарном режиме. (Лекция 9)