Содержание
- 2. Планетарная модель атома Резерфорда Планетарная модель атома калия В 1911 году в Кембридже, близ Лондона, английский
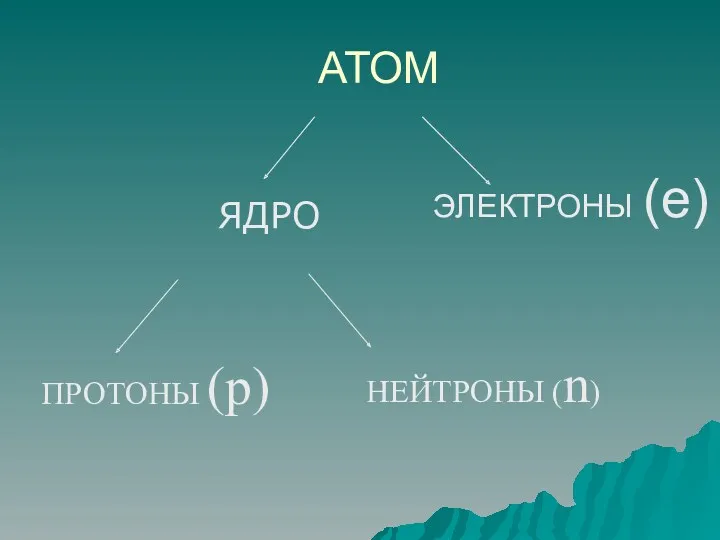
- 3. АТОМ ЯДРО ЭЛЕКТРОНЫ (e) ПРОТОНЫ (p) НЕЙТРОНЫ (n)
- 4. ПОРЯДКОВЫЙ НОМЕР ПОКАЗЫВАЕТ ЧИСЛО ПРОТОНОВ И ЭЛЕКТРОНОВ - ЧИСЛО ПРОТОНОВ-19 39 АТОМНАЯ МАССА ЧИСЛО НЕЙТРОНОВ-20 e=19
- 5. АТОМ В ЦЕЛОМ ЗАРЯДА НЕ ИМЕЕТ
- 6. ИОНЫ
- 7. Задание 1. По периодической системе химических элементов найдите число электронов атомов Al, P, С, N, O.
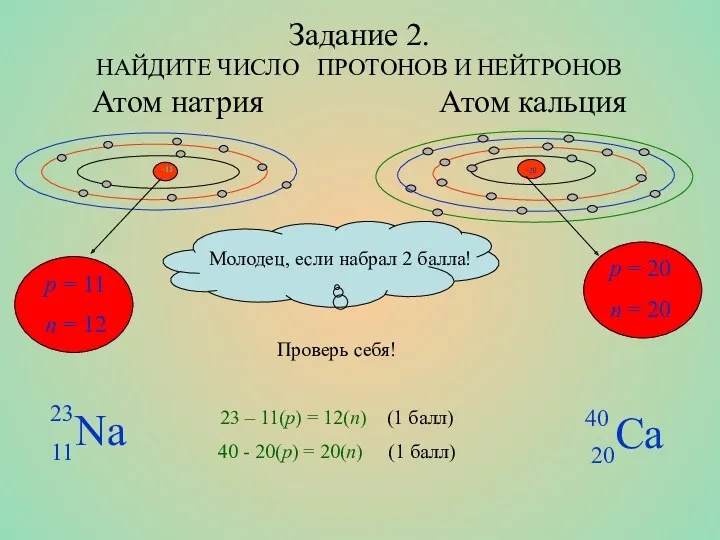
- 8. Задание 2. НАЙДИТЕ ЧИСЛО ПРОТОНОВ И НЕЙТРОНОВ Атом натрия Атом кальция p = 11 n =
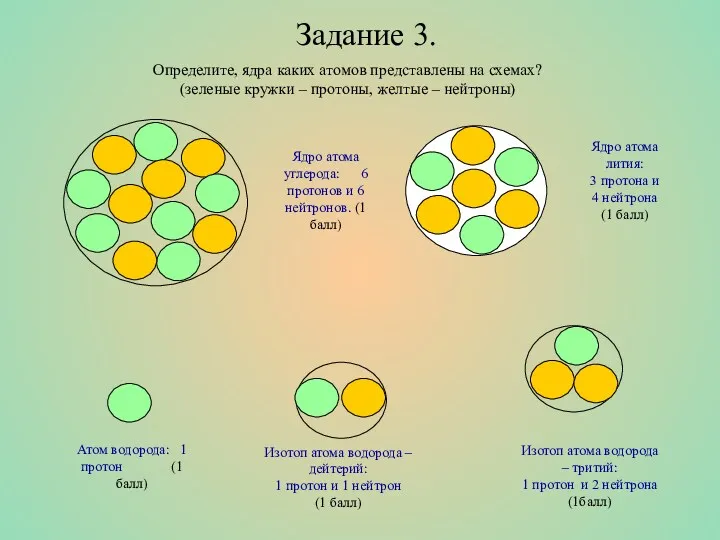
- 9. Задание 3. Определите, ядра каких атомов представлены на схемах? (зеленые кружки – протоны, желтые – нейтроны)
- 11. Скачать презентацию





 Открытие протона и нейтрона. 9 класс
Открытие протона и нейтрона. 9 класс Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Передаточные функции и частотные характеристики АС
Передаточные функции и частотные характеристики АС Особенности распространения радиоволн коротковолнового диапазона
Особенности распространения радиоволн коротковолнового диапазона Силы сопротивления при движении твердых тел в жидкостях и газах
Силы сопротивления при движении твердых тел в жидкостях и газах Метод контурных токов
Метод контурных токов Электрические явления
Электрические явления Закон Ома для полной цепи
Закон Ома для полной цепи Елементи спеціальної теорії відносності
Елементи спеціальної теорії відносності Физика и техника (7 класс)
Физика и техника (7 класс) Прохождение частицы через потенциальный барьер. Уравнение Шредингера для водородоподобного атома. Квантовые числа
Прохождение частицы через потенциальный барьер. Уравнение Шредингера для водородоподобного атома. Квантовые числа Электромагнитные колебания. Колебательный контур
Электромагнитные колебания. Колебательный контур Простые механизмы
Простые механизмы Что такое энергия
Что такое энергия Элементы машиноведения. Составные части машин
Элементы машиноведения. Составные части машин Презентация к уроку Значение влажности
Презентация к уроку Значение влажности ГАЗ 31029: Механика, технические характеристики, комплектация
ГАЗ 31029: Механика, технические характеристики, комплектация Энергетические уровни. Спонтанное и вынужденное излучения. Лекция 2
Энергетические уровни. Спонтанное и вынужденное излучения. Лекция 2 Скорость света
Скорость света Радиоактивность. (9 класс)
Радиоактивность. (9 класс) презентация к уроку физики 11 класс
презентация к уроку физики 11 класс Сила Лоренца
Сила Лоренца Математические модели установившегося режима и методы решения. Общие сведения о схемах замещения
Математические модели установившегося режима и методы решения. Общие сведения о схемах замещения Экзамен ПМ 01. Билет № 3. Методы производства такелажных работ
Экзамен ПМ 01. Билет № 3. Методы производства такелажных работ Розв’язування задач з теми Механічна робота. Потужність
Розв’язування задач з теми Механічна робота. Потужність Генерирование электрического тока. Трансформатор
Генерирование электрического тока. Трансформатор Физика и познание мира
Физика и познание мира Колебания и волны. Квантовая физика
Колебания и волны. Квантовая физика