Прохождение частицы через потенциальный барьер. Уравнение Шредингера для водородоподобного атома. Квантовые числа презентация
Содержание
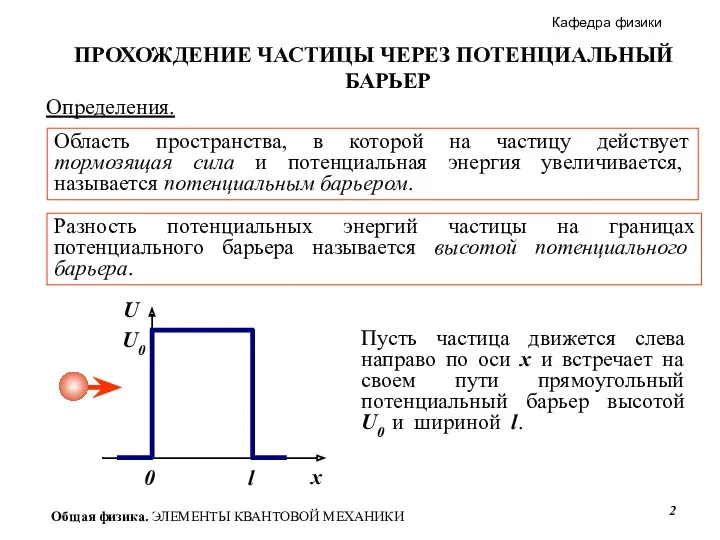
- 2. U Определения. Область пространства, в которой на частицу действует тормозящая сила и потенциальная энергия увеличивается, называется
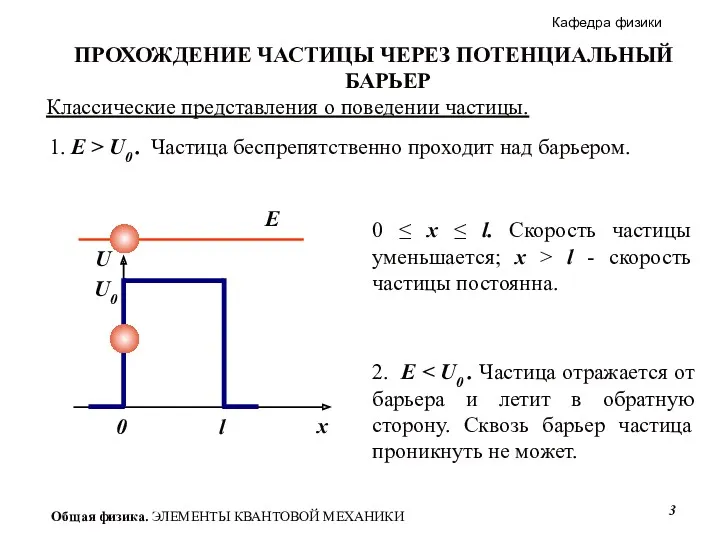
- 3. Классические представления о поведении частицы. 1. E > U0 . Частица беспрепятственно проходит над барьером. ПРОХОЖДЕНИЕ
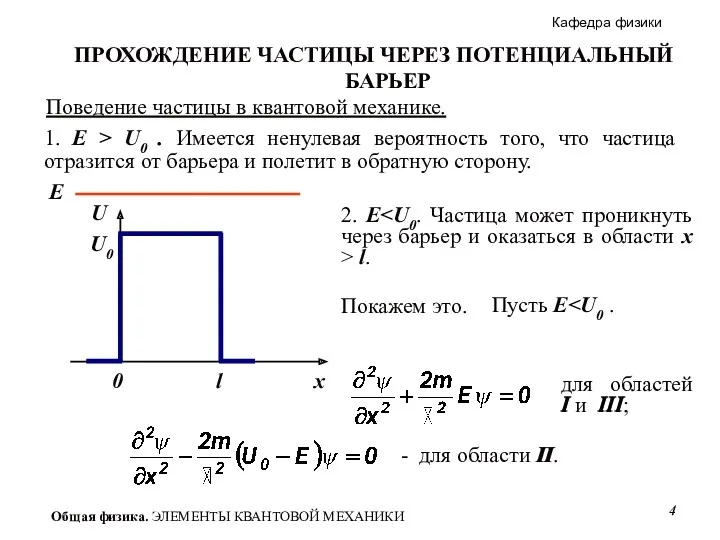
- 4. для областей I и III; Поведение частицы в квантовой механике. 1. E > U0 . Имеется
- 5. Введем обозначения: С учетом этих обозначений: ПРОХОЖДЕНИЕ ЧАСТИЦЫ ЧЕРЕЗ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР
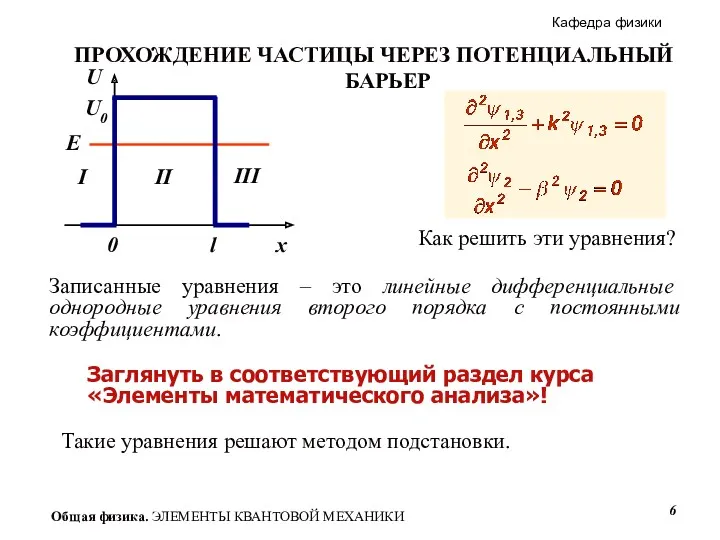
- 6. Как решить эти уравнения? Записанные уравнения – это линейные дифференциальные однородные уравнения второго порядка с постоянными
- 7. ПРОХОЖДЕНИЕ ЧАСТИЦЫ ЧЕРЕЗ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР Итог - решения уравнений для трех выделенных областей : Нужно найти
- 8. ПРОХОЖДЕНИЕ ЧАСТИЦЫ ЧЕРЕЗ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР Константы определяются «сшиванием» уравнений на границах областей с помощью граничных условий:
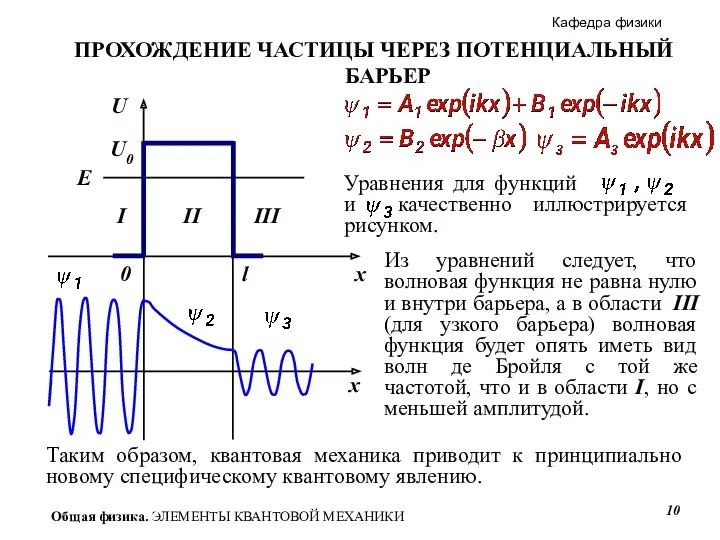
- 9. ПРОХОЖДЕНИЕ ЧАСТИЦЫ ЧЕРЕЗ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР В области III - за барьером – есть только проходящая волна.
- 10. ПРОХОЖДЕНИЕ ЧАСТИЦЫ ЧЕРЕЗ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР Из уравнений следует, что волновая функция не равна нулю и внутри
- 11. ПРОХОЖДЕНИЕ ЧАСТИЦЫ ЧЕРЕЗ ПОТЕНЦИАЛЬНЫЙ БАРЬЕР При преодолении потенциального барьера частица как бы пробивает «туннель» в барьере.
- 12. Модель атома. В центре атома неподвижный точечный заряд (ядро), создающий вокруг себя стационарное электростатическое поле. В
- 13. В результате возмущения электрон перескакивает на возбужденный уровень. Возбужденное состояние электрона неустойчиво. Через некоторое время электрон
- 14. Одномерное уравнение Шредингера для водородоподобного атома. Квантование энергии Выберем систему координат, начало которой совмещено с центром
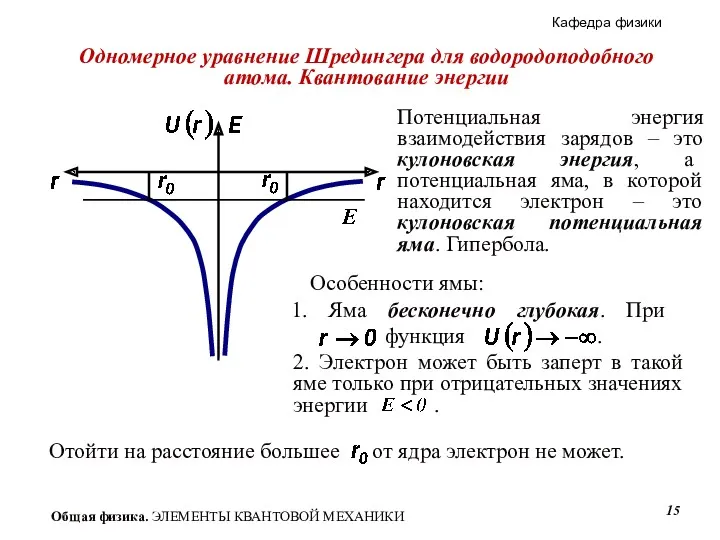
- 15. Одномерное уравнение Шредингера для водородоподобного атома. Квантование энергии Особенности ямы: Потенциальная энергия взаимодействия зарядов – это
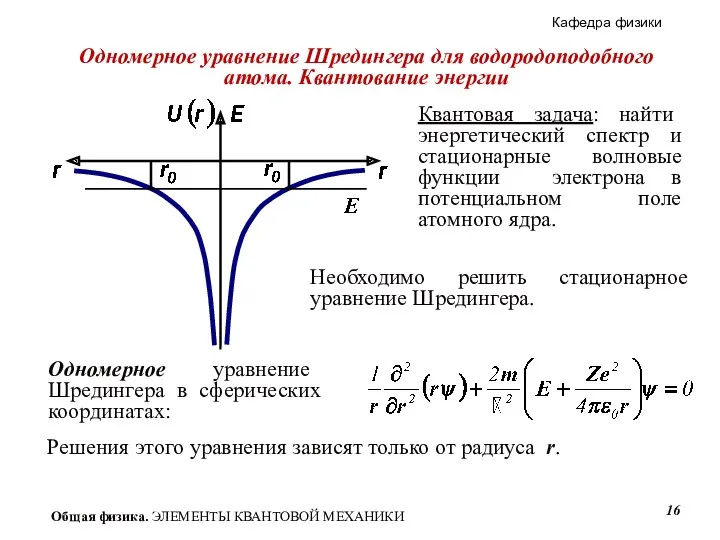
- 16. Квантовая задача: найти энергетический спектр и стационарные волновые функции электрона в потенциальном поле атомного ядра. Необходимо
- 17. Из теории дифференциальных уравнений: решения, удовлетворяющие условиям однозначности, конечности и непрерывности волновой функции, получаются только при
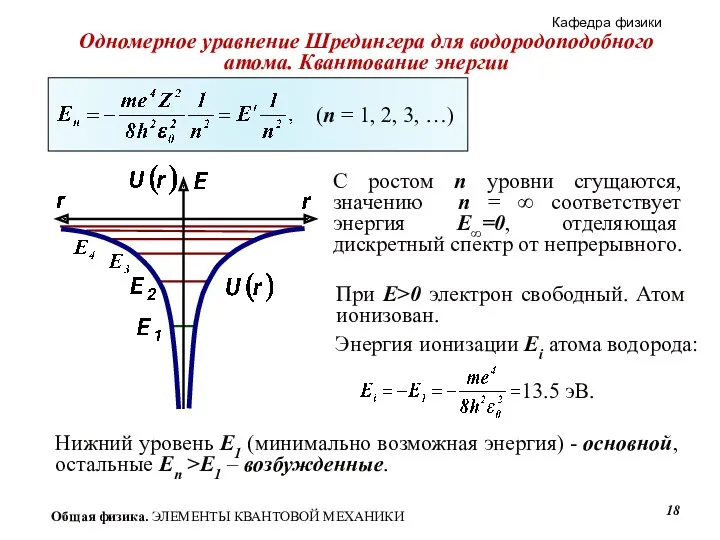
- 18. С ростом n уровни сгущаются, значению n = ∞ соответствует энергия E∞=0, отделяющая дискретный спектр от
- 19. Общее решение уравнения Шредингера для водородоподобного атома. Квантовые числа. Но: теперь имеющие физический смысл решения уравнения
- 20. Общее решение уравнения Шредингера для водородоподобного атома. Квантовые числа. Энергия. Возможные значения энергии электрона En в
- 21. Общее решение уравнения Шредингера для водородоподобного атома. Квантовые числа. В квантовой механике вводятся четыре параметра, связанных
- 22. Общее решение уравнения Шредингера для водородоподобного атома. Квантовые числа. где l – орбитальное квантовое число, которое
- 23. Общее решение уравнения Шредингера для водородоподобного атома. Квантовые числа. m – магнитное квантовое число. m =
- 25. Скачать презентацию














 Влажность воздуха
Влажность воздуха Взаимодействие тел. Второй закон Ньютона
Взаимодействие тел. Второй закон Ньютона Интерференция света
Интерференция света Аэрогель – материал удивительный
Аэрогель – материал удивительный Тема: Фотоэффект. Теория фотоэффекта
Тема: Фотоэффект. Теория фотоэффекта Закон Архимеда
Закон Архимеда Сұйықтық және газ механикасы пәні
Сұйықтық және газ механикасы пәні Биофизическое воздействие переменного электрического поля
Биофизическое воздействие переменного электрического поля Тонкослойная хроматография
Тонкослойная хроматография Температура и тепловое равновесие
Температура и тепловое равновесие Линейный компрессор. Сервисное руководство
Линейный компрессор. Сервисное руководство Ракеты. Какой принцип действия ракет военного назначения?
Ракеты. Какой принцип действия ракет военного назначения? Расчёт статически неопределимой рамы методом перемещений. Пример 2
Расчёт статически неопределимой рамы методом перемещений. Пример 2 Полный момент импульса электрона
Полный момент импульса электрона Диэлектриктердегі электр өрісі үшін
Диэлектриктердегі электр өрісі үшін Конспект урока физики в 7 классе по теме Скорость. Единицы скорости
Конспект урока физики в 7 классе по теме Скорость. Единицы скорости Характеристики магнитного поля
Характеристики магнитного поля Может ли магнит потерять свою силу
Может ли магнит потерять свою силу Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) Основы теории управления
Основы теории управления Углекислотные лазеры высокого и низкого давления
Углекислотные лазеры высокого и низкого давления Виды передач в робототехнике
Виды передач в робототехнике Траектория, путь и перемещение. Скалярные и векторные величины
Траектория, путь и перемещение. Скалярные и векторные величины Современные типы космических двигателей
Современные типы космических двигателей Процессы теплопереноса
Процессы теплопереноса Презентация к уроку по физике на тему Физические величины. Измерение физических величин.
Презентация к уроку по физике на тему Физические величины. Измерение физических величин. Уравнение Шредингера
Уравнение Шредингера Геометрическая оптика
Геометрическая оптика