Содержание
- 2. Явления, свидетельствующие о сложной структуре атома. Слово «атом» означает «неделимый». В течение длительного времени атом считался
- 3. Модель атома Томсона В 1903г. Английский физик Джозеф Джон Томсон предложил одну из первых моделей строения
- 4. Опыт Э. Резерфорда по рассеянию альфа – частиц В1911г. Английский ученый Э.Резерфорд провел ряд опытов по
- 5. Результаты опытов Большинство альфа-частиц прошли через тонкую фольгу, почти не изменив своего направления. Небольшое количество альфа-
- 6. Выводы: То, что некоторые альфа-частицы отскакивали от фольги назад, противоречило модели Томсона. Известно, что альфа-частицы имеют
- 7. Ядерная (планетарная) модель атома Резерфода Атом имеет в центре ядро, размеры которого во много раз меньше
- 8. Объяснение результатов опыта Резерфорда на основе ядерной модели атома. Так как большую часть атома составляет пустота,
- 9. Лирическое отступление Вы никогда не думали, что может быть «космос внутри нас»? …а человек в основном
- 10. Домашнее задание для 9 класса: 56 Ответить письменно на вопросы к параграфу.
- 11. Чего не сумел объяснить Резерфорд Резерфорд доказал, что электроны обращаются вокруг ядра по круговым орбитам. Но
- 12. Первый постулат Бора Выход из создавшегося противоречия между теоретическими расчетами и практикой был найден в 1913г.
- 13. Нильс Бор ( 1885 – 1962 ) Нильс Бор - датский физик. Создал теорию атома, в
- 14. Второй постулат Бора Электрон может переходить с одной стационарной орбиты на другую. При переходе из стационарного
- 15. Модель атома водорода по Бору. Свои постулаты Бор применил для построения теории простейшей атомной системы –
- 16. Все частоты излучений атома водорода составляют ряд серий, каждая из которых образуется при переходах атома в
- 17. Поглощение света Поглощение света – процесс, обратный излучению. Атом, излучая свет, переходит из низших энергетических состояний
- 18. Трудности теории Бора Теория Бора не была логически последовательной. На ее основе не удалось построить количественную
- 19. Значение теории Бора Теория Бора – это первая квантовая теория строения атома, которая послужила толчком к
- 21. Скачать презентацию


















 Методы и средства измерения частоты, временных интервалов и фазового сдвига
Методы и средства измерения частоты, временных интервалов и фазового сдвига Простые механизмы
Простые механизмы Самостоятельная робота на уроках физики
Самостоятельная робота на уроках физики Imitation of low voltage DC arc
Imitation of low voltage DC arc Оборудование для заземления нейтрали в сетях 6-35 кВ
Оборудование для заземления нейтрали в сетях 6-35 кВ Вес тела. Единицы силы. Связь между силой тяжести и массой тела. Физика. 7 класс
Вес тела. Единицы силы. Связь между силой тяжести и массой тела. Физика. 7 класс Портфолио учителя физики Бушмакиной Е. С.
Портфолио учителя физики Бушмакиной Е. С. Разработка урока по теме Изучение колебаний математического маятника
Разработка урока по теме Изучение колебаний математического маятника Устройство и принцип работы воздухораспределителя 483
Устройство и принцип работы воздухораспределителя 483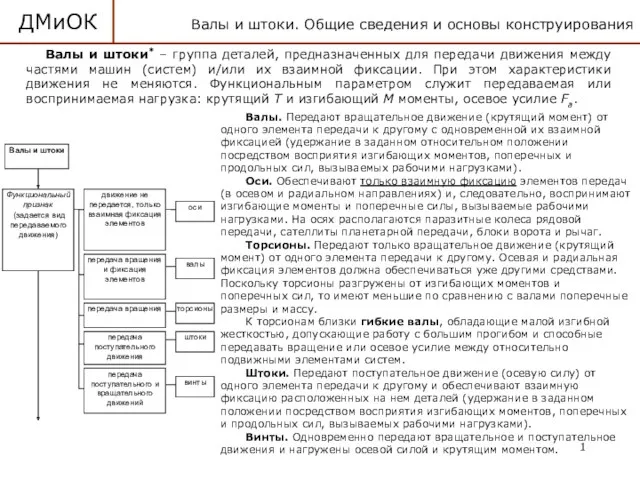 Детали машин и основы конструирования. Валы и штоки. (Лекция 11)
Детали машин и основы конструирования. Валы и штоки. (Лекция 11) Плотность вещества
Плотность вещества Тепловое излучение. Глава 5
Тепловое излучение. Глава 5 Реактивное движение
Реактивное движение Корабельные гироскопические системы. (Тема 2)
Корабельные гироскопические системы. (Тема 2) Температура
Температура Умови плавання тіл
Умови плавання тіл Углекислотные лазеры высокого и низкого давления
Углекислотные лазеры высокого и низкого давления Лекція №5. Закон збереження імпульсу
Лекція №5. Закон збереження імпульсу Взаємодія тіл. Імпульс. Закон збереження імпульсу
Взаємодія тіл. Імпульс. Закон збереження імпульсу Магнитное поле. Действие магнитного поля на движущийся электрический заряд
Магнитное поле. Действие магнитного поля на движущийся электрический заряд Современные приборы измерения температуры
Современные приборы измерения температуры Измерение активного сопротивления обмоток постоянному току
Измерение активного сопротивления обмоток постоянному току Законы отражения
Законы отражения Newton’s Laws of Motion
Newton’s Laws of Motion Технологический процесс проведения опрессовки форсунок судового двигателя
Технологический процесс проведения опрессовки форсунок судового двигателя Гамма-излучение
Гамма-излучение Спектрально-люминесцентные свойства кристаллов стабилизированного диоксида циркония, активированных ионами
Спектрально-люминесцентные свойства кристаллов стабилизированного диоксида циркония, активированных ионами Оптическое явление атмосферы гало
Оптическое явление атмосферы гало