Содержание
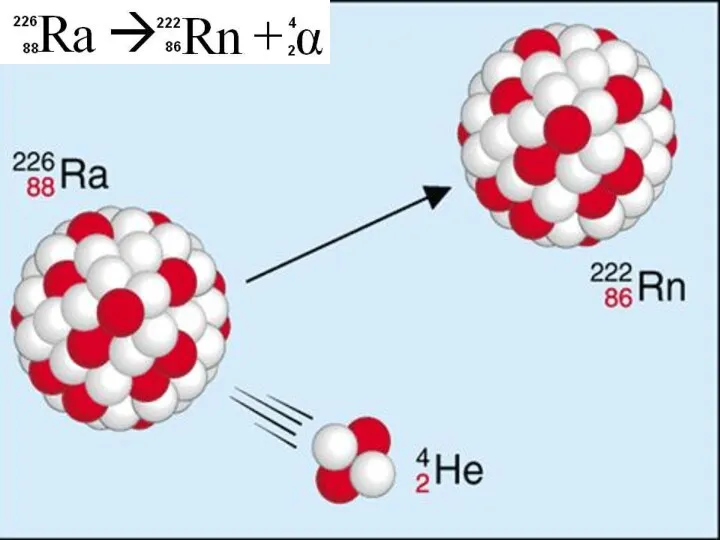
- 2. Фредерик Содди 1877 - 1956 Эрнест Резерфорд 1871–1937 В 1903 г. обнаружили, что радий самопроизвольно превращается
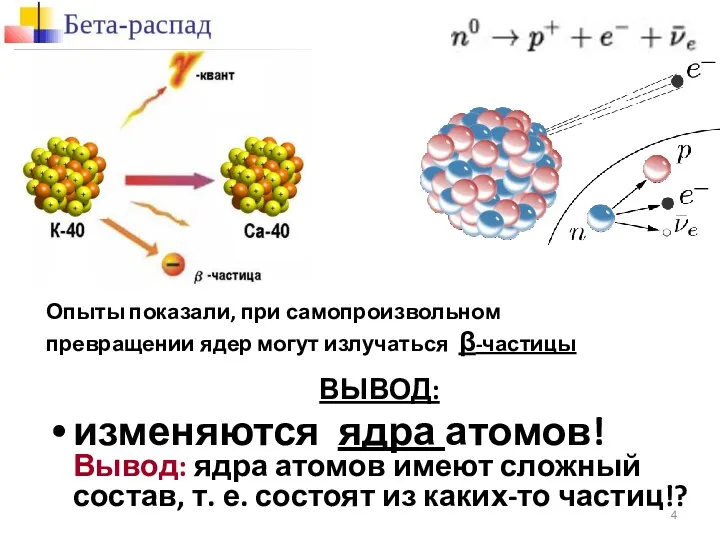
- 4. Опыты показали, при самопроизвольном превращении ядер могут излучаться β-частицы ВЫВОД: изменяются ядра атомов! Вывод: ядра атомов
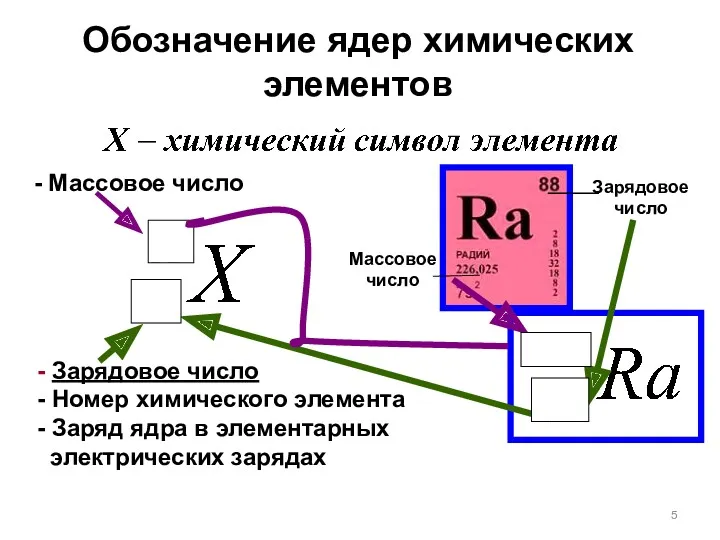
- 5. Обозначение ядер химических элементов - Зарядовое число - Номер химического элемента - Заряд ядра в элементарных
- 6. ЗАРЯДОВОЕ ЧИСЛО Z - физическая величина равно числу протонов в атомном ядре числу электронов в нейтральном
- 7. Массовое число А = атомной массе с точностью до целых чисел совпадает с только для углерода-12
- 8. ИЗОТОПЫ Группы элементов, неразличимые химически, но разные по массе. были названы "изотопами" ("занимающими одно место в
- 9. Обозначение ядер химических элементов и частиц Ядра химических элементов: Частицы: α- частица
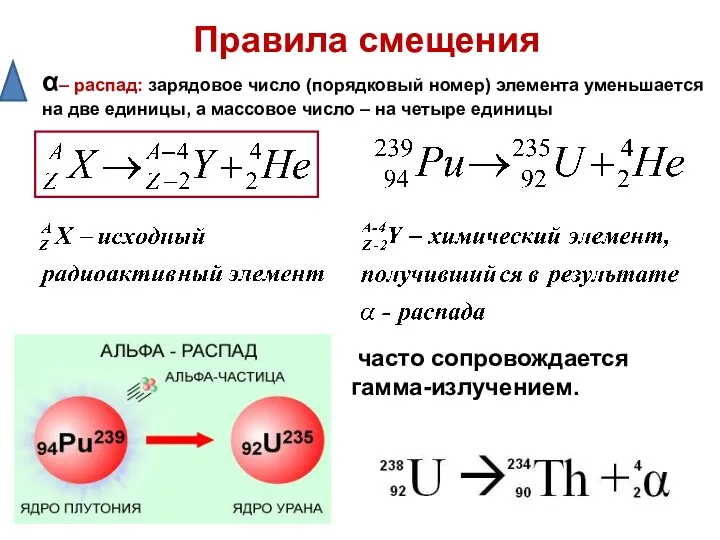
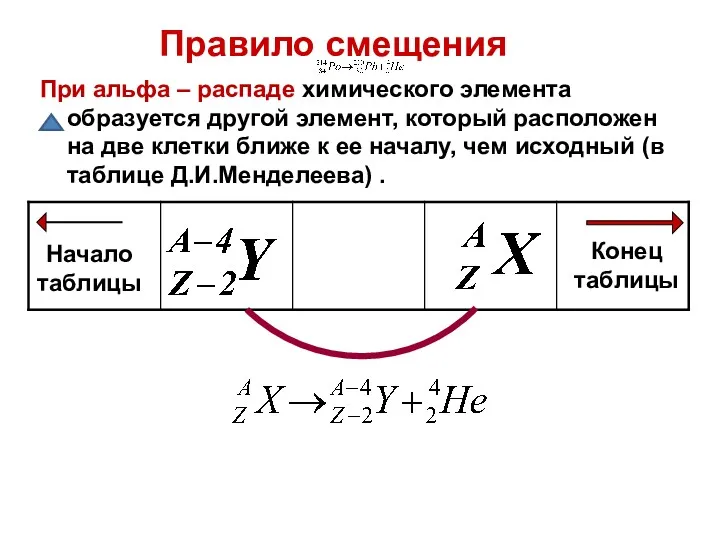
- 11. Правила смещения α– распад: зарядовое число (порядковый номер) элемента уменьшается на две единицы, а массовое число
- 12. При альфа – распаде химического элемента образуется другой элемент, который расположен на две клетки ближе к
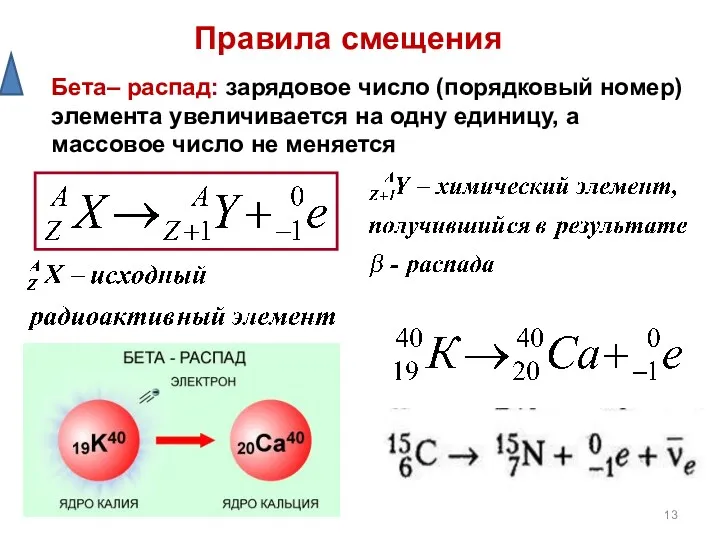
- 13. Правила смещения Бета– распад: зарядовое число (порядковый номер) элемента увеличивается на одну единицу, а массовое число
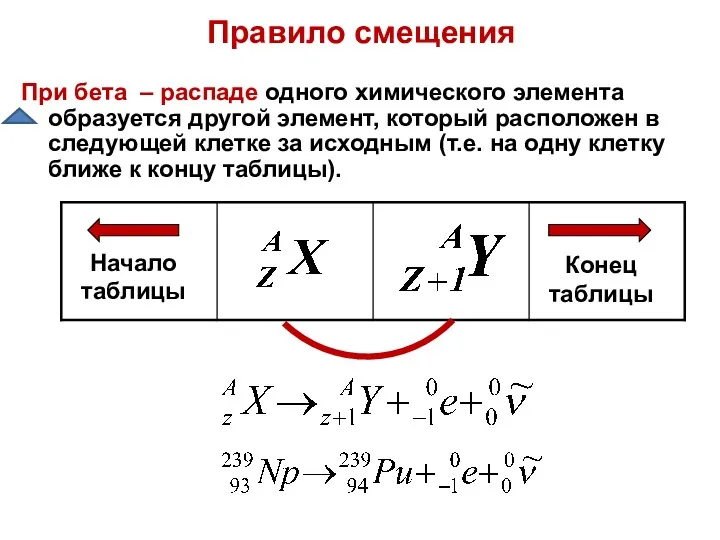
- 14. Правило смещения При бета – распаде одного химического элемента образуется другой элемент, который расположен в следующей
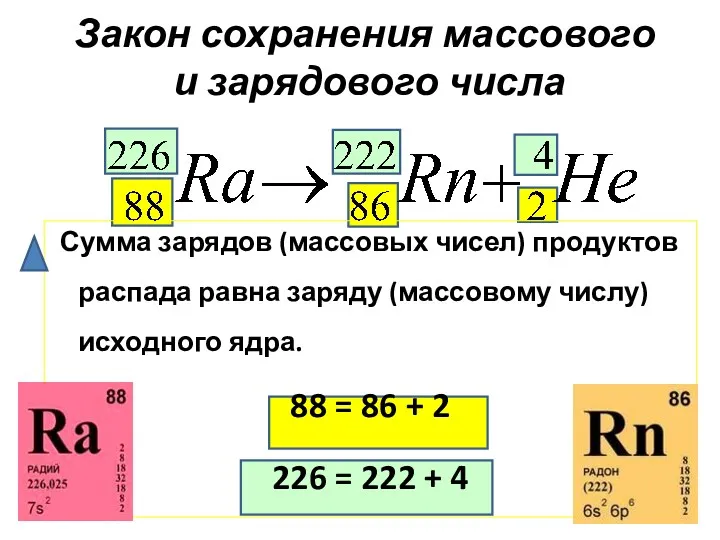
- 15. Закон сохранения массового и зарядового числа Сумма зарядов (массовых чисел) продуктов распада равна заряду (массовому числу)
- 16. Фредерик Содди 1877 - 1956 Эрнест Резерфорд 1871–1937 Открытие радиоактивных превращений атомных ядер Вывод: ядра атомов
- 17. Д.з. 1. Выписать в тетрадь элементарные частицы и их обозначение. 2. Записать правила смешения для альфа-
- 18. Упражнения 1) Пользуясь законами сохранения массового числа и заряда, определить массовое число и зарядовое число химического
- 19. Упражнения 2. В результате какого радиоактивного распада натрий-22 превращается в магний – 22?
- 20. 3. Кобальт-60 используется в медицине для лечения и терапии злокачественных образований и воспалительных процессов. Кобальт-60 бета-радиоактивен.
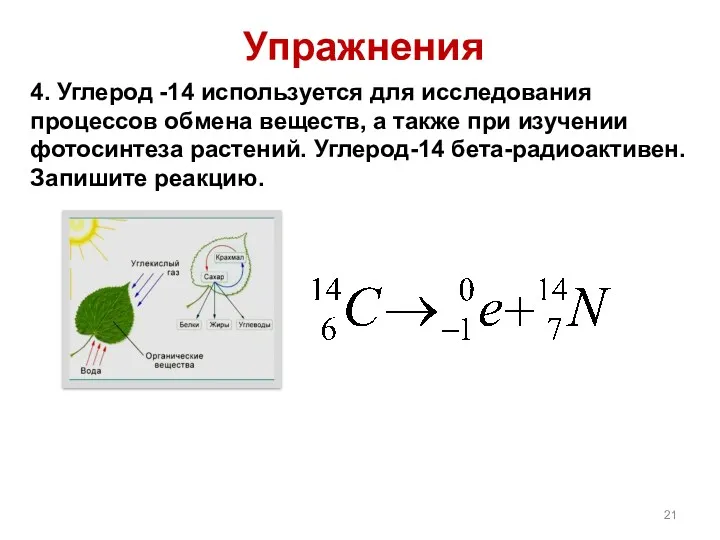
- 21. 4. Углерод -14 используется для исследования процессов обмена веществ, а также при изучении фотосинтеза растений. Углерод-14
- 22. 5. Какие заряд Z и массовое число А будет иметь ядро элемента, получившегося из ядра изотопа
- 24. Скачать презентацию











 Презентация . Электромагнитное поле
Презентация . Электромагнитное поле Расчет массы и объёма тела по его плотности
Расчет массы и объёма тела по его плотности Электрический ток. Источники электрического тока. Электрическая цепь.
Электрический ток. Источники электрического тока. Электрическая цепь. Подготовка к ЕГЭ по физике
Подготовка к ЕГЭ по физике Устройство, управление и техническое обслуживание крана
Устройство, управление и техническое обслуживание крана Расчёт основных характеристик цепей переменного тока
Расчёт основных характеристик цепей переменного тока Сила тока. Плотность тока. Закон Ома. Электрическое сопротивление. Электродвижущая сила
Сила тока. Плотность тока. Закон Ома. Электрическое сопротивление. Электродвижущая сила Первый и второй законы Ньютона
Первый и второй законы Ньютона Электрический ток в различных средах
Электрический ток в различных средах лк 3
лк 3 Электростатика. Лекция № 10
Электростатика. Лекция № 10 Термиялық өңдеу. Термиялық өңдеудің түрлері. Термиялық өңдеудің фазалық өзгерістері. Болаттын термиялық өңдеу
Термиялық өңдеу. Термиялық өңдеудің түрлері. Термиялық өңдеудің фазалық өзгерістері. Болаттын термиялық өңдеу Плазма. Часть 2. Земная природная плазма
Плазма. Часть 2. Земная природная плазма Законы постоянного тока
Законы постоянного тока Физические основы акустического метода
Физические основы акустического метода Плавление и отвердевание кристаллических тел. 8 класс
Плавление и отвердевание кристаллических тел. 8 класс Курс лекций по молекулярной физике и термодинамике
Курс лекций по молекулярной физике и термодинамике Корпус. Требования к корпусам
Корпус. Требования к корпусам Методическая разработка урока физики 8 класс. Лабораторная работа № 13 Исследование зависимости угла преломления от угла падения света.
Методическая разработка урока физики 8 класс. Лабораторная работа № 13 Исследование зависимости угла преломления от угла падения света. Полупроводниковые выпрямители. Лекция15
Полупроводниковые выпрямители. Лекция15 Массоперенос между фазами и в пределах фазы. (Темы 5.1 - 5.2)
Массоперенос между фазами и в пределах фазы. (Темы 5.1 - 5.2) Электромагнитные переходные процессы в электроэнергетических системах
Электромагнитные переходные процессы в электроэнергетических системах Новые технологические процессы
Новые технологические процессы Нанотехнологии и нанонаука
Нанотехнологии и нанонаука Индикаторные и эффективные показатели ДВС. Тема 8
Индикаторные и эффективные показатели ДВС. Тема 8 Механическая работа. Мощность
Механическая работа. Мощность Физика. Разделы физики
Физика. Разделы физики Lektsia_3
Lektsia_3