Содержание
- 2. Распределение Максвелла не учитывает тот факт, что на каждую молекулу действует сила тяготения. Если бы не
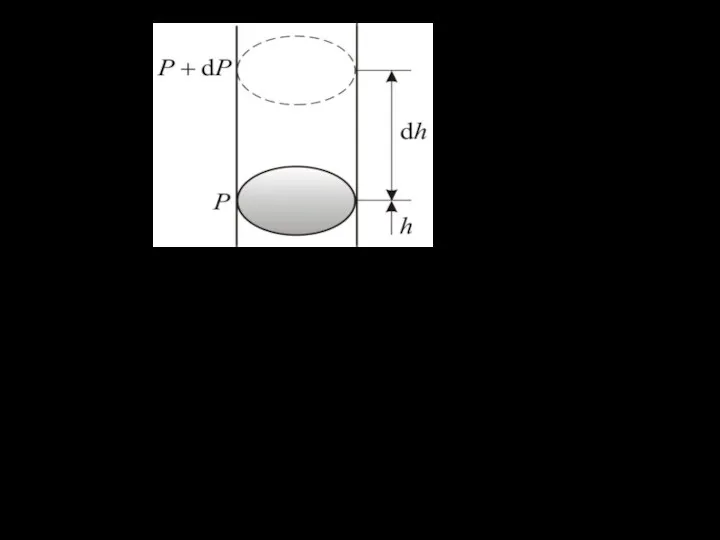
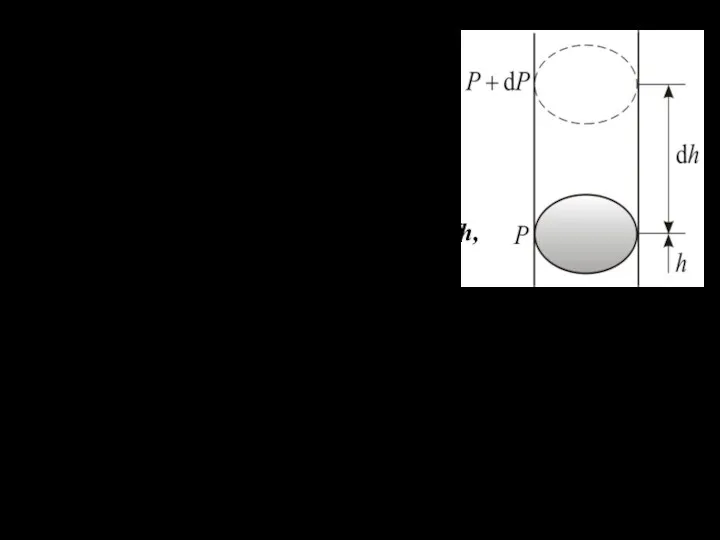
- 3. Пусть P – давление на высоте h, а – на высоте . С увеличением высоты давление
- 4. Разность давлений на двух указанных высотах равна давлению , создаваемому слоем dh - плотность газа на
- 5. Проинтегрируем последнее уравнение при (условие т/д равновесия) . получим где P1, P0, - давления на высоте
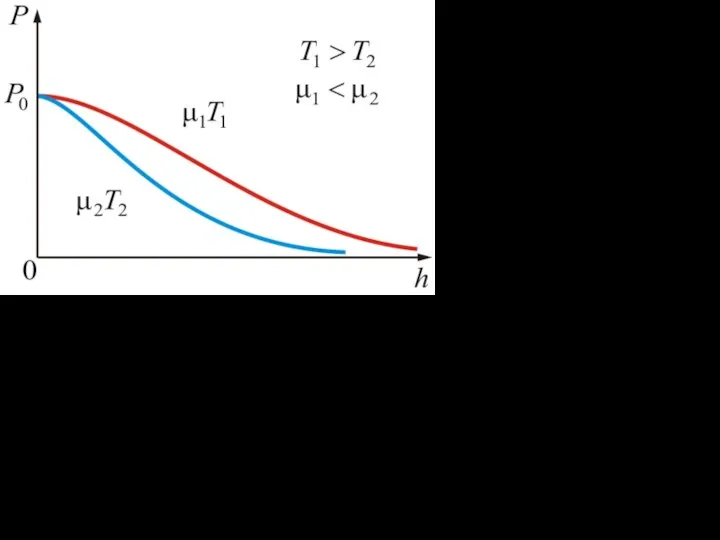
- 6. Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше
- 7. Распределение Больцмана Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. Воспользуемся основным
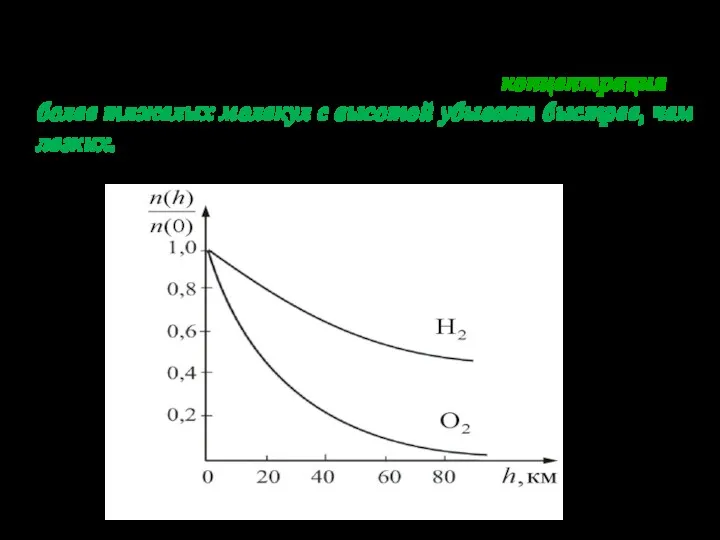
- 8. На рисунке показана зависимость концентрации различных газов от высоты. Видно, что концентрация более тяжелых молекул с
- 9. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА Так как – потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям потенциальной
- 11. Больцман Людвиг (1844 – 1906) – австрийский физик- теоретик, один из основоположников классической статистической физики. Основные
- 12. Закон распределения Максвелла-Больцмана Распределение Максвелла и Больцмана можно объединить в один закон Максвелла-Больцмана. Число частиц Δnx,y,z,
- 13. Объединяя обе формулы, получим: Функция распределения Максвелла-Больцмана — это относительное число молекул, находящихся в единичном. объеме,
- 14. Проблема устойчивости атмосферы планет Барометрическая формула Больцмана справедлива для Т = cost, g = const. В
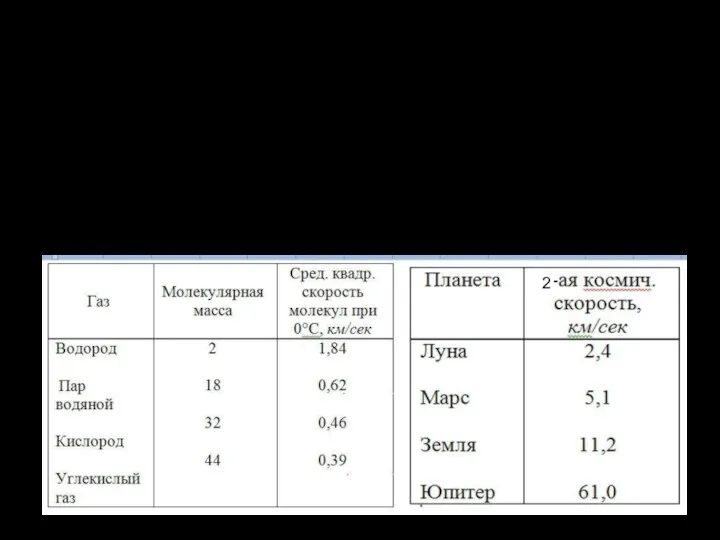
- 15. В астрономии считают устойчивой атмосферу, средняя скорость молекул которой не превышает 0,2 от второй космической скорости.
- 16. Закон о равнораспределении энергии по степеням свободы молекулы. Из закона Максвелла распределения молекул по скоростям следует,
- 17. Степени свободы Число степеней свободы механической системы - это количество независимых величин, с помощью которых может
- 18. Количество степеней свободы, которыми обладает молекула газа, зависит от ее структуры. Молекула одноатомного газа (He, Ne,
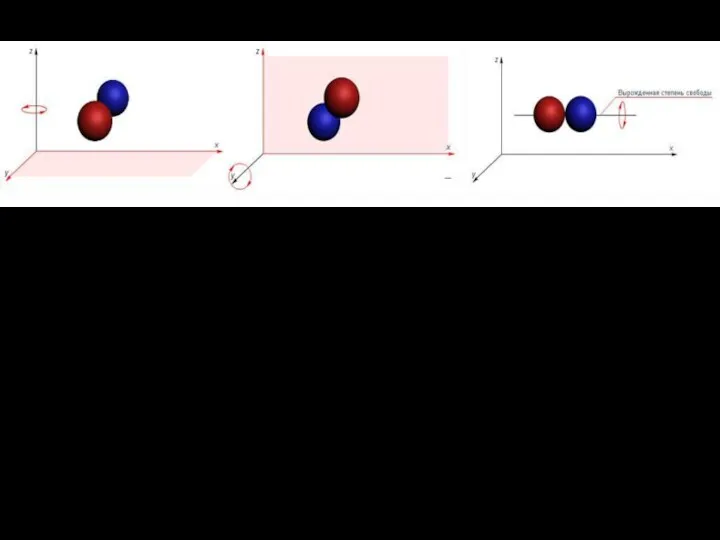
- 19. Молекулы двухатомных газов (Н2, O2, N2) можно представить себе как две материальные точки, связанные жесткой или
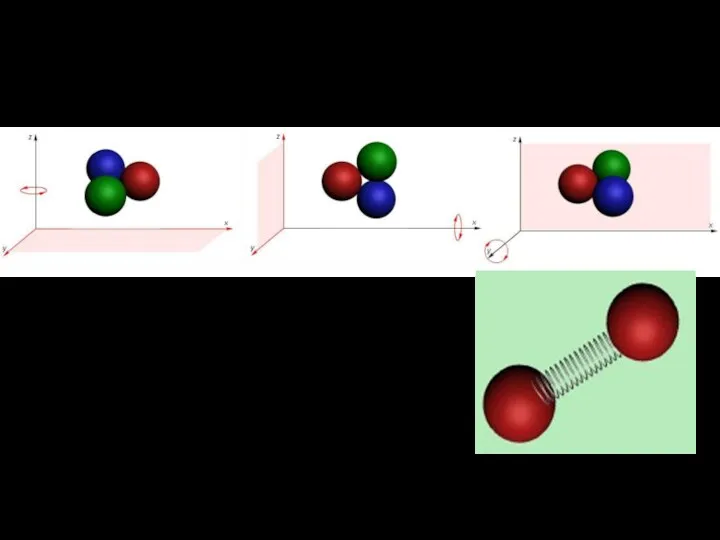
- 20. Молекулы трехатомных газов, не вытянутые в линейную цепочку, обладают двумерной или трехмерной структурой. Они могут вращаться
- 21. Итак, общее количество степеней свободы определяется структурой молекулы. Закон равнораспределения энергии по степеням свободы В статистической
- 22. При подсчете числа i следует учесть, что каждая колебательная степень свободы обладает вдвое большей энергетической емкостью,
- 23. Чтобы получить внутреннюю энергию Uμ одного моля идеального газа, нужно 〈ε〉 умножить на число молекул в
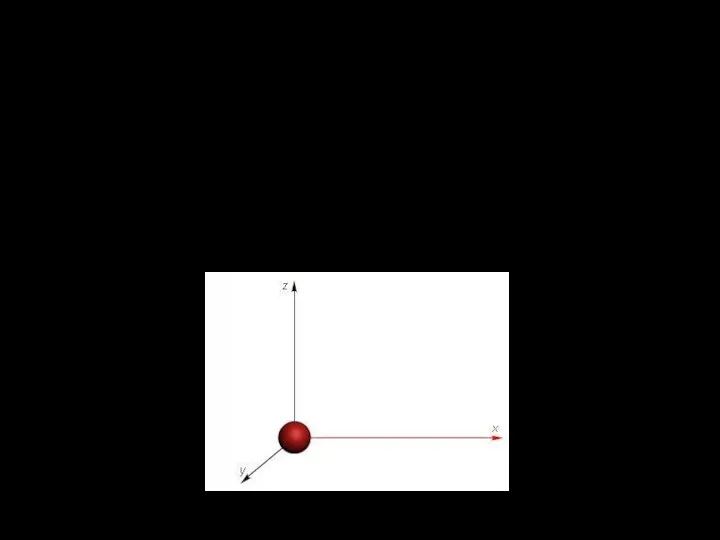
- 24. Положение материальной точки (одноатомной молекулы) задаётся тремя координатами (x, y, z), поэтому она имеет три степени
- 25. Теплоемкость двухатомного газа. Двухатомная молекула обладает тремя поступательными степенями свободы и двумя вращательными :
- 27. Скачать презентацию















 Внутрішнє тертя
Внутрішнє тертя Муфты. (Лекция 10)
Муфты. (Лекция 10) Уникальные физические свойства воды
Уникальные физические свойства воды Авиационные преобразователи электрической энергии
Авиационные преобразователи электрической энергии Равноускоренное движение
Равноускоренное движение Ремонт систем и механизмов двигателя
Ремонт систем и механизмов двигателя Обозначение физической величины
Обозначение физической величины Методы, основанные на электрохимическом импедансе
Методы, основанные на электрохимическом импедансе Где живет электричество?
Где живет электричество? Понятие дозы
Понятие дозы Техническое обслуживание генератора и стартера автомобиля ВАЗ- 2107. Ремонт стартера
Техническое обслуживание генератора и стартера автомобиля ВАЗ- 2107. Ремонт стартера Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8)
Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8) Напряженнодеформированное состояние массива горных пород. Распределение напряжений вокруг горных выработок. Тема 9
Напряженнодеформированное состояние массива горных пород. Распределение напряжений вокруг горных выработок. Тема 9 Механическое движение
Механическое движение Электрические характеристики электротехнических материалов (общие)
Электрические характеристики электротехнических материалов (общие) Техническое обслуживание и текущий ремонт сцепления, коробки передач, карданной передачи
Техническое обслуживание и текущий ремонт сцепления, коробки передач, карданной передачи Атомные спектры
Атомные спектры Внеклассное мероприятие Своя игра
Внеклассное мероприятие Своя игра БелАЗ. Горные машины
БелАЗ. Горные машины Явление электромагнитной индукции, самоиндукция, индуктивность
Явление электромагнитной индукции, самоиндукция, индуктивность Удельная теплота плавления
Удельная теплота плавления Презентация Строение атома
Презентация Строение атома Интеграция школьного курса физики с дисциплинами гуманитарного цикла
Интеграция школьного курса физики с дисциплинами гуманитарного цикла Строительная механика. Расчёт трёхшарнирных систем. Лекция 1
Строительная механика. Расчёт трёхшарнирных систем. Лекция 1 Электромагнитные волны
Электромагнитные волны Лінійні кола
Лінійні кола Фотоелемент. Його види та застосування
Фотоелемент. Його види та застосування Газовые законы
Газовые законы