Содержание
- 2. Перегонка – метод разделения жидкостей, основанный на различной летучести компонентов. Основные виды перегонки: - простая перегонка
- 3. Простая перегонка – процесс однократного частичного испарения жидкой смеси и конденсации образующихся при этом паров. Применяют
- 4. Ректификация – процесс разделения смесей летучих жидкостей, который заключается в многократном взаимодействии паров с жидкостью, в
- 5. Правило фаз Гиббса Число компонентов К, участвующих в массообменном процессе, равно двум; фаз также две Ф
- 6. Фазовое равновесие в системах «пар-жидкость»
- 8. Для двухкомпонентной смеси состава A – B: Парциальное давление компонента в парах над смесью жидкостей равно
- 9. Общее давление пара над раствором Pобщ равно сумме парциальных давлений его компонентов α – относительная летучесть
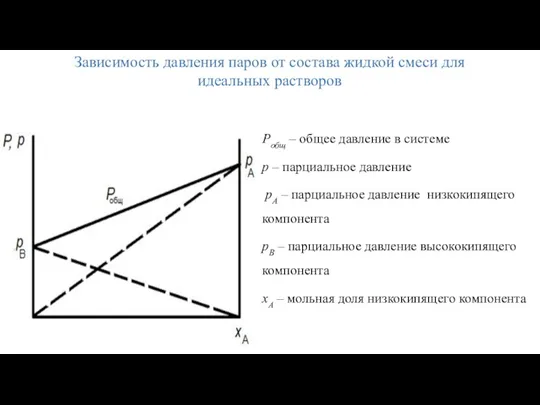
- 10. Зависимость давления паров от состава жидкой смеси для идеальных растворов Pобщ – общее давление в системе
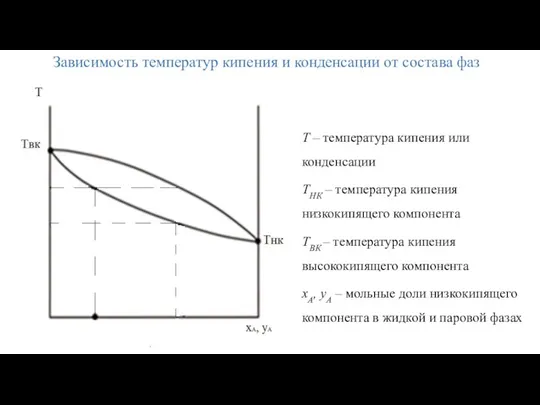
- 11. Зависимость температур кипения и конденсации от состава фаз T – температура кипения или конденсации TНК –
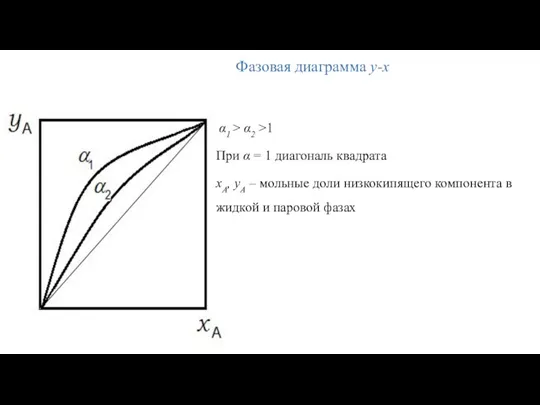
- 12. α1 > α2 >1 При α = 1 диагональ квадрата xA, yA – мольные доли низкокипящего
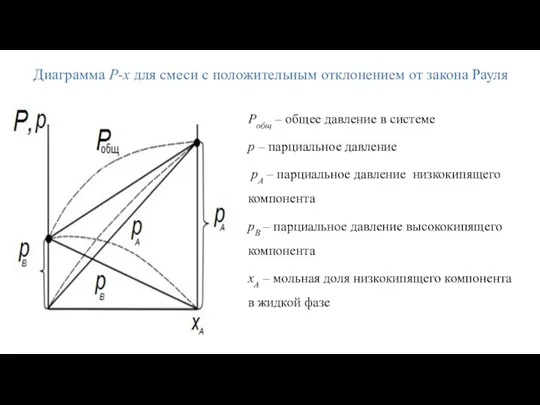
- 13. Pобщ – общее давление в системе p – парциальное давление pА – парциальное давление низкокипящего компонента
- 14. Законы Коновалова 1) Первый закон Коновалова: общее давление пара над раствором растёт с ростом доли в
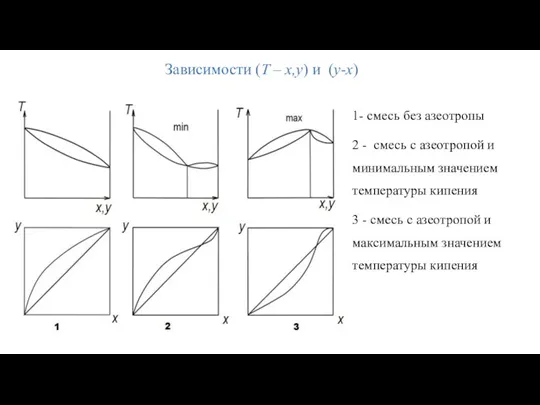
- 15. 1- смесь без азеотропы 2 - смесь с азеотропой и минимальным значением температуры кипения 3 -
- 16. p − давление, T − температура, R − универсальная газовая постоянная, r − удельная теплота фазового
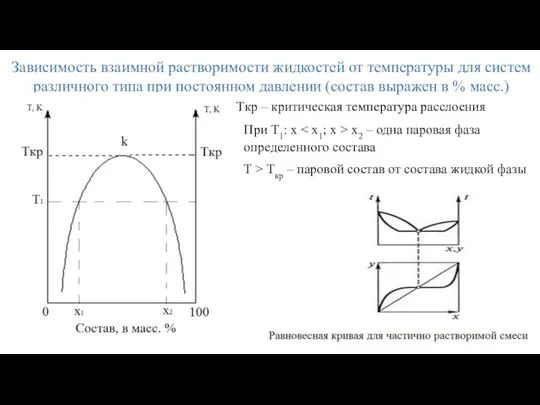
- 17. Зависимость взаимной растворимости жидкостей от температуры для систем различного типа при постоянном давлении (состав выражен в
- 18. Перегонка
- 19. Куб – кипятильник 2. Конденсатор -холодильник 3. Сборники Простая перегонка
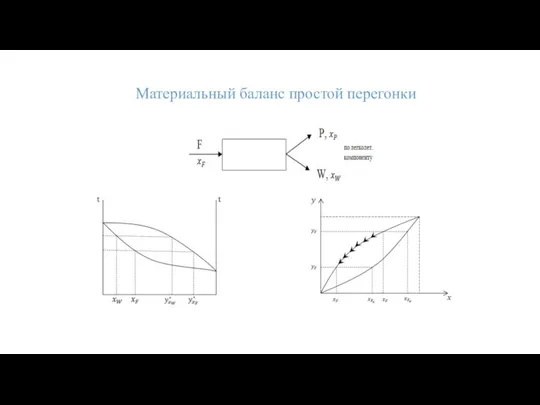
- 20. Материальный баланс простой перегонки
- 25. Тепловой баланс простой перегонки
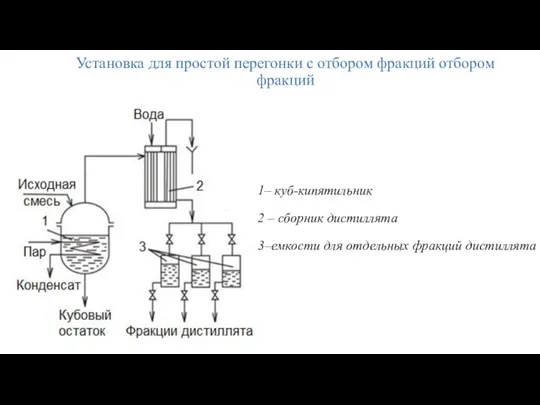
- 26. Установка для простой перегонки с отбором фракций отбором фракций 1– куб-кипятильник 2 – сборник дистиллята 3–емкости
- 27. Перегонка с водяным паром Принцип действия. Когда смешаны две взаимонерастворимые жидкости, то в этом случае парциальное
- 28. Расход острого водяного пара: Справедливо для смесей веществ с любыми свойствами (в том числе и для
- 29. Перегонка с дефлегмацией Куб – кипятильник 2. Конденсатор –холодильник 3. Сборники 4. Дефлегматор В конденсаторе конденсируется
- 31. Скачать презентацию




















 Основы теории оптических систем
Основы теории оптических систем Циклы поршневых двигателей внутреннего сгорания
Циклы поршневых двигателей внутреннего сгорания Презентация к уроку в 5 классе по теме Дефекты зрения и оптические иллюзии
Презентация к уроку в 5 классе по теме Дефекты зрения и оптические иллюзии Введение в магнитостатику (1). Лекция 1
Введение в магнитостатику (1). Лекция 1 Атом водорода
Атом водорода Неисправность актуатора муфты CVVT выпускного распредвала. P001400
Неисправность актуатора муфты CVVT выпускного распредвала. P001400 Электропневматикалық контакторлардың жұмысы және құрылысы
Электропневматикалық контакторлардың жұмысы және құрылысы ВКР: Устройство защиты асинхронных двигателей сельскохозяйственных электроустановок от аварийных режимов
ВКР: Устройство защиты асинхронных двигателей сельскохозяйственных электроустановок от аварийных режимов Ионизирующие излучения
Ионизирующие излучения Презентация по физике 7 класс. Тема: Плотность вещества
Презентация по физике 7 класс. Тема: Плотность вещества Экспериментальные исследования воспламенения древесины под воздействием динамического потока лучистой энергии
Экспериментальные исследования воспламенения древесины под воздействием динамического потока лучистой энергии Влияние электромагнитных волн на организм человека
Влияние электромагнитных волн на организм человека Запис магнітної інформації
Запис магнітної інформації Занимательная физика. Интеллектуальная игра
Занимательная физика. Интеллектуальная игра Деление ядер урана. Цепная ядерная реакция
Деление ядер урана. Цепная ядерная реакция Численное моделирование реагирующих потоков. Введение в предмет
Численное моделирование реагирующих потоков. Введение в предмет Спектры. Виды спектров. Спектральный анализ
Спектры. Виды спектров. Спектральный анализ Развитие ракетной техники
Развитие ракетной техники Элективный курс
Элективный курс Давление твердых тел. Способы изменения давления
Давление твердых тел. Способы изменения давления Ядерные реакции
Ядерные реакции Гравиразведка
Гравиразведка Архимед күші
Архимед күші Electrical Charges
Electrical Charges Плавание судов
Плавание судов Паровая машина
Паровая машина Геометрическая оптика
Геометрическая оптика Расчет режимов электрических сетей
Расчет режимов электрических сетей