Содержание
- 2. Литература: Глаголев К.В., Морозов А.Н. Физическая термодинамика: Учеб. пособие. – М.: Изд-во МГТУ им. Н.Э.Баумана, 2004.
- 3. Статистический метод описания состояний макроскопических тел (термодинамических систем) основывается на определении статистических закономерностей случайного (теплового) движения
- 4. Однако средние значения координат, скоростей, а также средние значения любых функций переменных, характеризующих движение (например, квадрата
- 5. Нахождение среднего квадрата случайных изменений этих функций позволяет описывать равновесные флуктуации параметров системы. Статистическая физика занимается
- 6. Функция распределения Пусть состояние некоторой макроскопической системы определяет параметр x, принимающий K дискретных значений: При проведении
- 7. – при всех измерениях наблюдалось только значение xi ⇒ система находится в детерминированном состоянии, характеризующемся параметром
- 8. Если набор возможных дискретных значений xi, i = 1, 2, …K, является полным (т.е. включает все
- 9. Рассмотрим статистическое описание для случая, когда измеренный параметр x может иметь любые значения в интервале (температура,
- 10. Пусть величина x с вероятностью dP(x) попадает в интервал от x до x + dx. Тогда
- 11. Вероятность попадания измеренного значения в интервал Условие нормировки ф-кции распределения – вероятность попадания измеренного значения в
- 12. Среднее значение любой функции φ(x) (15.3) Согласно (15.3) среднее значение параметра x (15.4) Если состояние системы
- 13. где f(x,y) – двумерная функция распределения (например, для координат и скоростей молекул газа). Для бесконечно малых
- 14. Барометрическая формула При статистическом описании распределения микрочастиц в пространстве координат x и y обычно используют концентрацию
- 15. Если на систему не действуют внешние силы и она находится в состоянии термодинамического равновесия, то При
- 16. Молекулы газа находятся в поле сил тяжести (в результате чего не разлетаются по всему мировому пространству)
- 17. Пусть идеальный газ находится во внешнем гравитационном поле (поле однородно). Предполагаем, что любой бесконечно малый объем
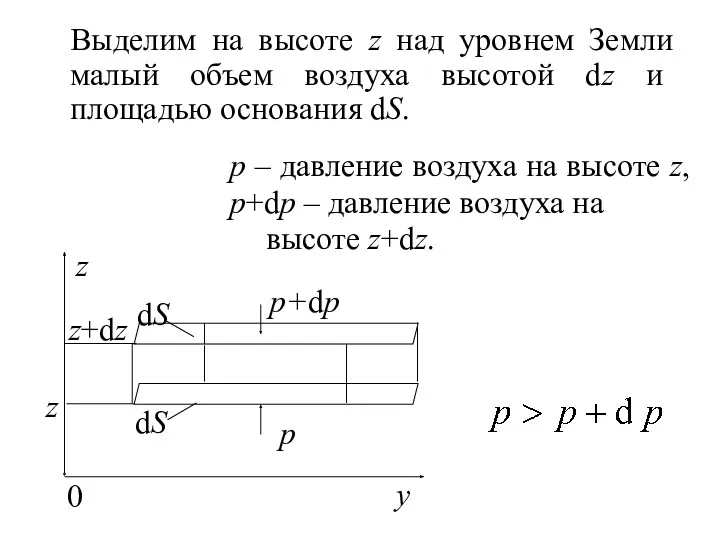
- 18. p p+dp Выделим на высоте z над уровнем Земли малый объем воздуха высотой dz и площадью
- 19. где dF – сила, действующая на выделенный малый объем воздуха, Условие механического равновесия объема газа где
- 20. Из основного уравнения МКТ выразим концентрацию тогда Здесь Ep = mgz – потенциальная энергия одной молекулы
- 21. Из Н.У.: (15.7) – барометрическая формула, справедлива для идеального газа. С ее помощью можно рассчитать давление
- 22. Распределение Больцмана Подставив основное уравнение МКТ в (15.7), получим распределение Больцмана (15.8) где n0 – концентрация
- 23. Формула (15.8) впервые получена Л.Больцманом в 1866 г. и позволяет рассчитать концентрацию газа, находящегося в равновесном
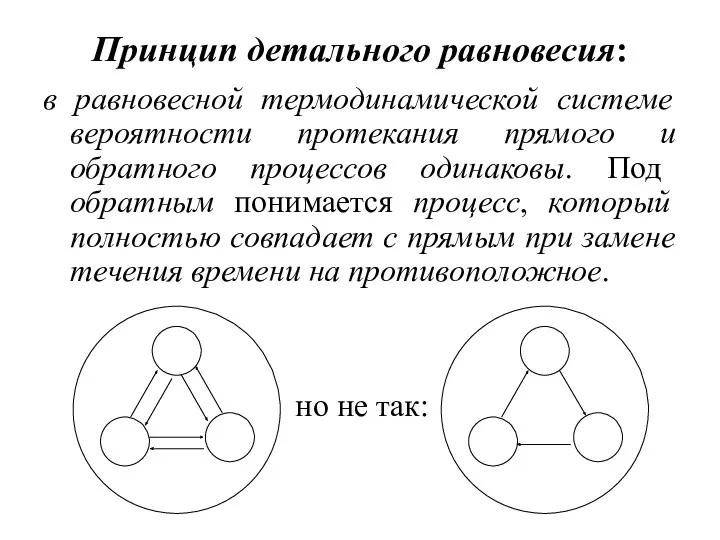
- 24. Принцип детального равновесия: в равновесной термодинамической системе вероятности протекания прямого и обратного процессов одинаковы. Под обратным
- 25. Самостоятельно: Глаголев К.В., Морозов А.Н. Физическая термодинамика: Учеб. пособие. – М.: Изд-во МГТУ им. Н.Э.Баумана, 2004.
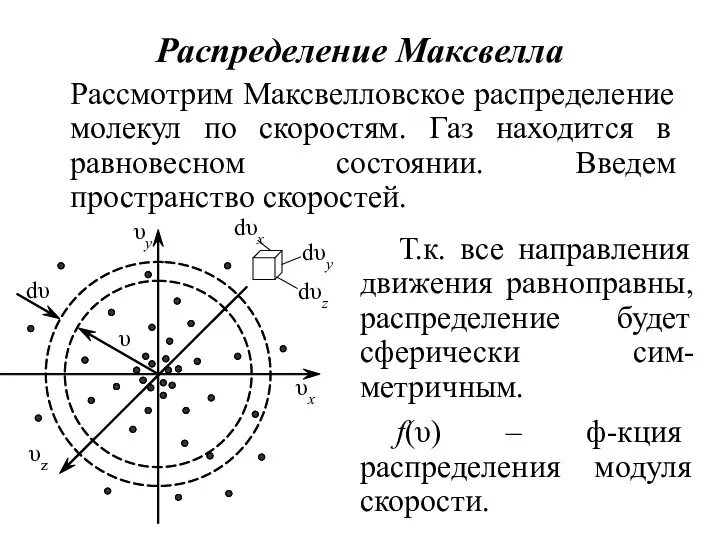
- 26. Распределение Максвелла Рассмотрим Максвелловское распределение молекул по скоростям. Газ находится в равновесном состоянии. Введем пространство скоростей.
- 27. Получение функции распределения Максвелла – самостоятельно. Глаголев К.В., Морозов А.Н. Физическая термодинамика: Учеб. пособие. – М.:
- 28. Функция распределения проекции скорости υx: (15.16а) Аналогично (15.16б) (15.16в)
- 29. Проекции скорости молекул на оси координат – статистически независимые величины. Тогда функция распределения молекул газа по
- 30. Функции (15.16) – (15.17) – распределения Максвелла. Вероятность того, что значения проекций скорости лежат внутри элементарного
- 31. Т.к. эта вероятность зависит только от абсолютного значения скорости и не зависит от направления ее вектора
- 32. Считая шаровой слой тонким, его элементарный объем Тогда (15.18): Функция F(υ)
- 33. называется распределением Максвелла по абсолютным значениям скоростей и характеризует вероятность того, что скорость молекулы имеет значения
- 34. наиболее вероятная скорость: (15.19) Площадь под всей кривой распределения =1 (т.е. частица имеет какую-либо скорость). В
- 35. Средний квадрат скорости средняя квадратичная скорость (15.21)
- 36. Значения скоростей υm, и υкв численно отличаются незначительно, причем Все полученные распределения справедливы только для равновесного
- 37. Экспериментальная проверка распределения Максвелла Опыт Штерна (рассматривался в лекции 11).
- 38. Фазовое пространство Фазовое пространство 6-ти мерное. Элементарный объем ячейки фазового пространства:
- 39. Распределение Максвелла-Больцмана Считая координаты и компоненты скорости статистически независимыми друг от друга величинами, на основании (15.6)
- 40. Распределения Максвелла и Больцмана можно объединить в закон распределения Максвелла-Больцмана, который определяет число молекул dN, проекции
- 41. Распределение Максвелла-Больцмана: (15.22) где
- 42. Равновесные флуктуации В любой, даже равновесной, системе существуют случайные отклонения от средних значений макроскопических параметров ее
- 43. Случайные отклонения значений какого-либо параметра термодинамической системы от его среднего значения называются флуктуациями. Возникают флуктуации вследствие
- 44. Статистическое обоснование второго начала термодинамики Флуктуации возникают в любых термодинамических системах. Для равновесных систем вероятность возникновения
- 45. Состояние макросистемы может быть охарактеризовано заданием таких макропараметров, как объем V, давление p, температура T и
- 46. Макроскопическое состояние газа с некоторыми значениями параметров представляет собой смену микроскопических состояний, которые отличаются одно от
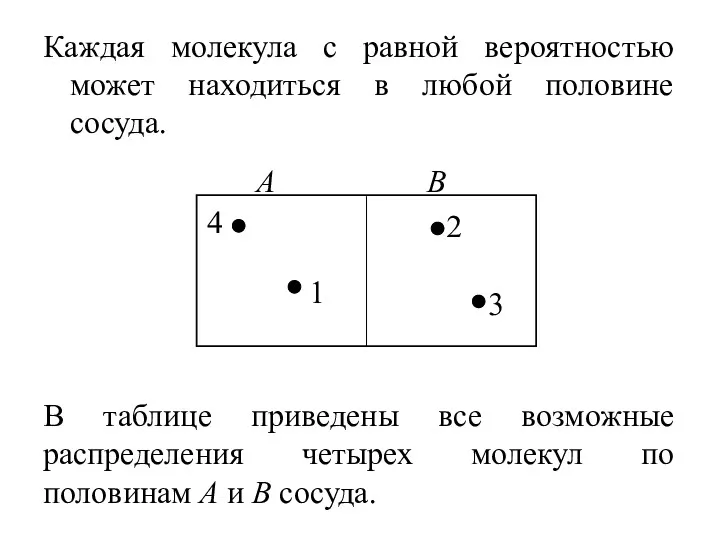
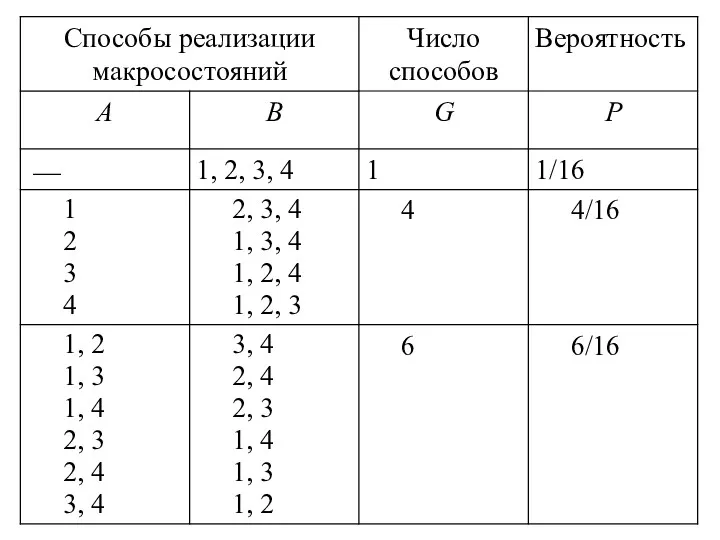
- 47. Каждая молекула с равной вероятностью может находиться в любой половине сосуда. В таблице приведены все возможные
- 50. Статистическим весом данного макросостояния называется количество равновесных микросостояний G, соответствующих этому макросостоянию. Статистический вес характеризует степень
- 51. Формула Больцмана для статистической энтропии Формула Больцмана. Статистическая энтропия системы (15.23) где k – постоянная Больцмана.
- 53. Скачать презентацию













































 Явление испускания света полупроводниками. Светодиоды
Явление испускания света полупроводниками. Светодиоды Урок №3 Энергетический баланс для механической части электропривода
Урок №3 Энергетический баланс для механической части электропривода Химические источники тока гальванические элементы, аккумуляторы
Химические источники тока гальванические элементы, аккумуляторы Контурные тепловые трубы в космической технике
Контурные тепловые трубы в космической технике Передаточные функции и частотные характеристики идеальных и реальных регуляторов
Передаточные функции и частотные характеристики идеальных и реальных регуляторов Лампы накаливания
Лампы накаливания Магнитные свойства вещества
Магнитные свойства вещества Изонить
Изонить Разработка участка тормозной системы на предприятии Гринлайт
Разработка участка тормозной системы на предприятии Гринлайт Физика пласта. Обучающий модуль для молодых специалистов
Физика пласта. Обучающий модуль для молодых специалистов Механические передачи. Червячные передачи. (Лекция 6)
Механические передачи. Червячные передачи. (Лекция 6) Введение в физику
Введение в физику Волновые свойства света
Волновые свойства света Электромагнитная волна, поляризация ЭМВ
Электромагнитная волна, поляризация ЭМВ Нагревание проводников электрическим током
Нагревание проводников электрическим током Динамика. Законы Ньютона
Динамика. Законы Ньютона Применение знаний законов физики в быту. Творческая работа
Применение знаний законов физики в быту. Творческая работа Атомная батарейка и радиоактивные подсветки
Атомная батарейка и радиоактивные подсветки Зубчатые механизмы. Основные виды зубчатых передач. (Лекция 2)
Зубчатые механизмы. Основные виды зубчатых передач. (Лекция 2) Майлау жүйесі
Майлау жүйесі Техническое обслуживание и текущий ремонт тележек модели 18-9810
Техническое обслуживание и текущий ремонт тележек модели 18-9810 Применение компьютера в демонстрационном эксперименте
Применение компьютера в демонстрационном эксперименте Плавание судов. Воздухоплавание
Плавание судов. Воздухоплавание Кинематика вращательного движения твёрдого тела
Кинематика вращательного движения твёрдого тела Основы проектирования. Детали машин и основы конструирования. Основные понятия деталей машин
Основы проектирования. Детали машин и основы конструирования. Основные понятия деталей машин Закон Ома на участке цепи. Диаграмма связи величин: U, I, R
Закон Ома на участке цепи. Диаграмма связи величин: U, I, R Әр түрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі
Әр түрлі иондаушы сәулелер көздері түрлерінің заттармен өзара әсерлесуі Источники и приемники оптического излучения
Источники и приемники оптического излучения