Содержание
- 2. Эффективтік диаметр Тасымалдау құбылысы Молекуллрдың өзара әсерлесуі Ван-дер-Ваальс теңдеуі Ван-дер-Ваальс изотермасы Фазалық ауысу Күй диаграммасы Дәріс
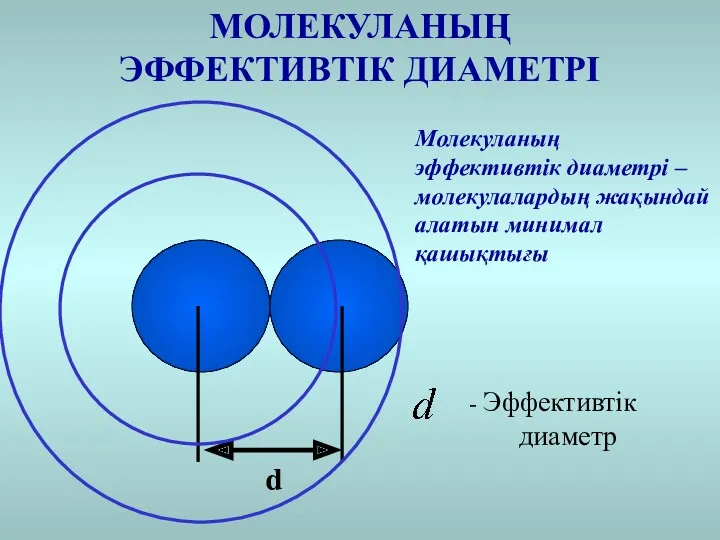
- 3. МОЛЕКУЛАНЫҢ ЭФФЕКТИВТІК ДИАМЕТРІ d Молекуланың эффективтік диаметрі – молекулалардың жақындай алатын минимал қашықтығы - Эффективтік диаметр
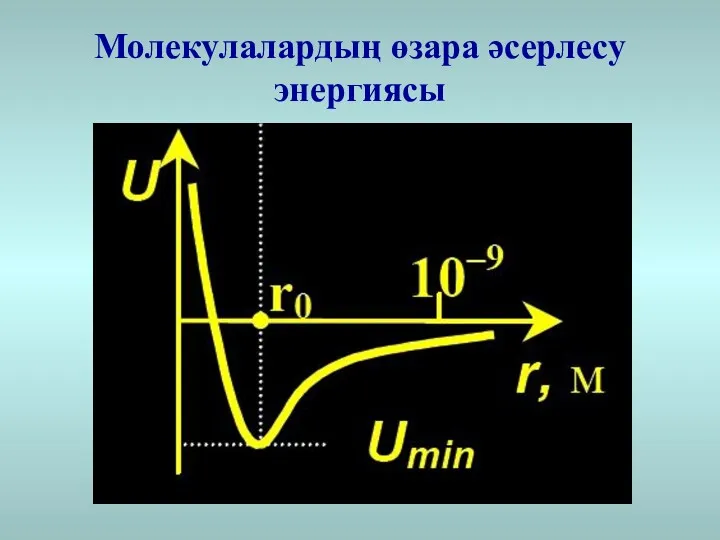
- 4. Молекулалардың өзара әсерлесу энергиясы
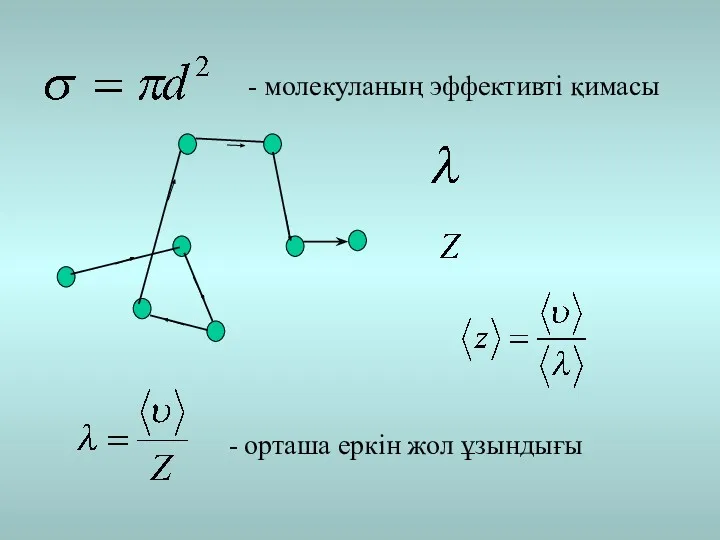
- 5. - молекуланың эффективті қимасы - орташа еркін жол ұзындығы
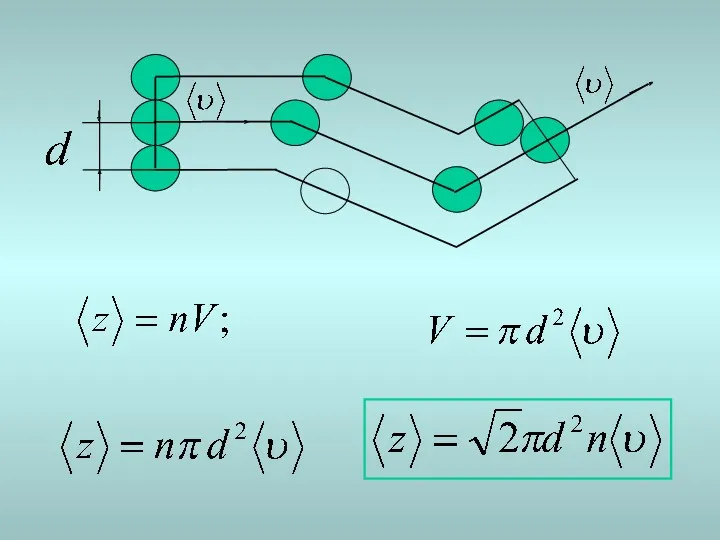
- 8. Орташа еркін жол ұзындығы
- 9. Диффузия Тасымалдау құбылысы Фик заңы
- 10. -диффузия коэффициенті
- 11. Тұтқырлық
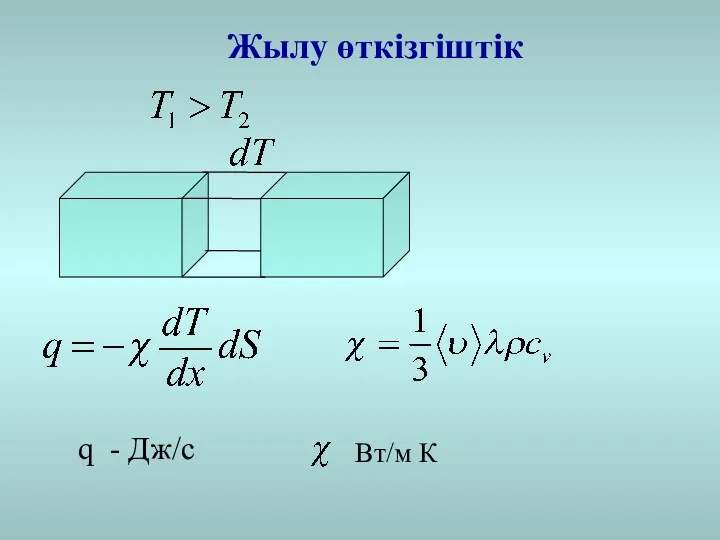
- 12. Жылу өткізгіштік q - Дж/c Вт/м К
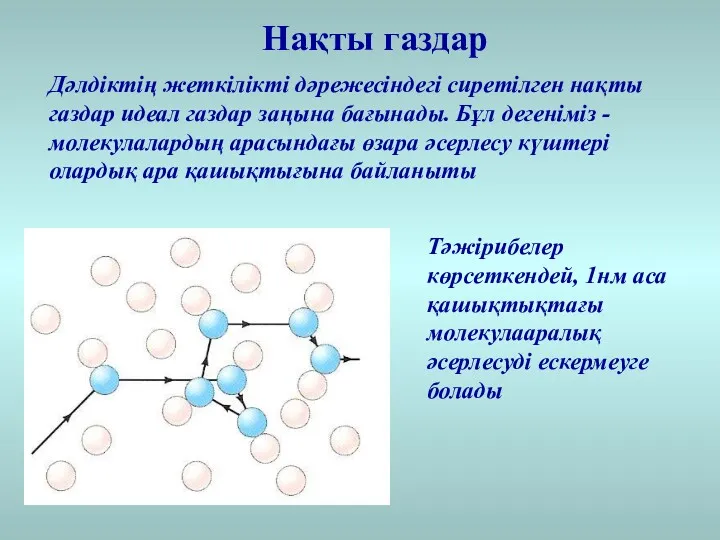
- 14. Нақты газдар Дәлдіктің жеткілікті дәрежесіндегі сиретілген нақты газдар идеал газдар заңына бағынады. Бұл дегеніміз - молекулалардың
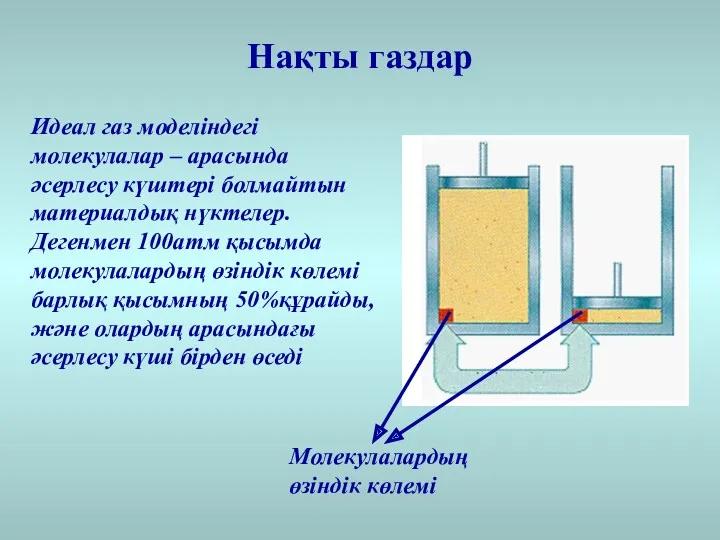
- 15. Идеал газ моделіндегі молекулалар – арасында әсерлесу күштері болмайтын материалдық нүктелер. Дегенмен 100атм қысымда молекулалардың өзіндік
- 16. Қысым ұлғайғанда сығылғын газ көлемі молекулалардың өздері алатын көлемге теңеседі
- 17. Идеал газ күйінің теңдеуі төмен қысымда және жоғары температурадағы газдар әрекетін сипаттауға пайдалы. Идеал газадың берілген
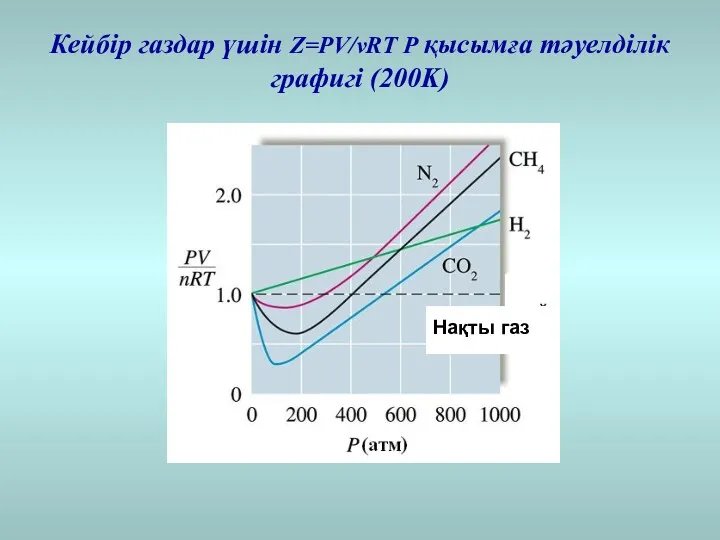
- 18. Кейбір газдар үшін Z=PV/νRT P қысымға тәуелділік графигі (200K)
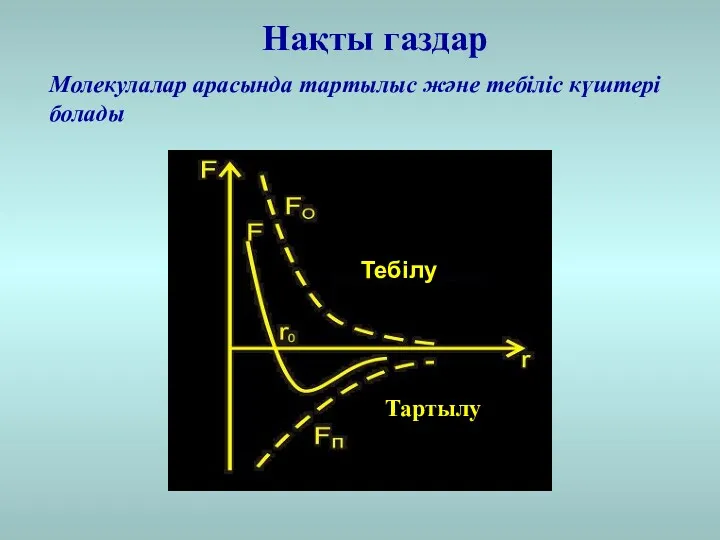
- 19. Нақты газдар Молекулалар арасында тартылыс және тебіліс күштері болады
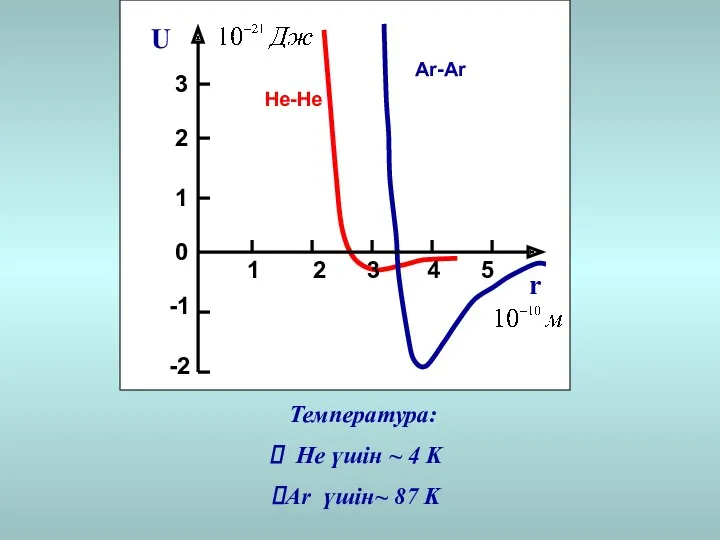
- 20. Температура: He үшін ~ 4 K Ar үшін~ 87 K Не-Не Ar-Ar U r
- 21. Молекулалардың потенциялдық және кинетикалық энергиялары арасындағы арақатынас агрегаттық күйлерге бөлу үшін сындық болып табылады
- 22. Нақты газ күйінің теңдеуі –Ван-дер-Ваальс теңдеуі Нақты газдарда келесі ескерілу керек: Бөлшектерде өз көлемі болады Молекулалар
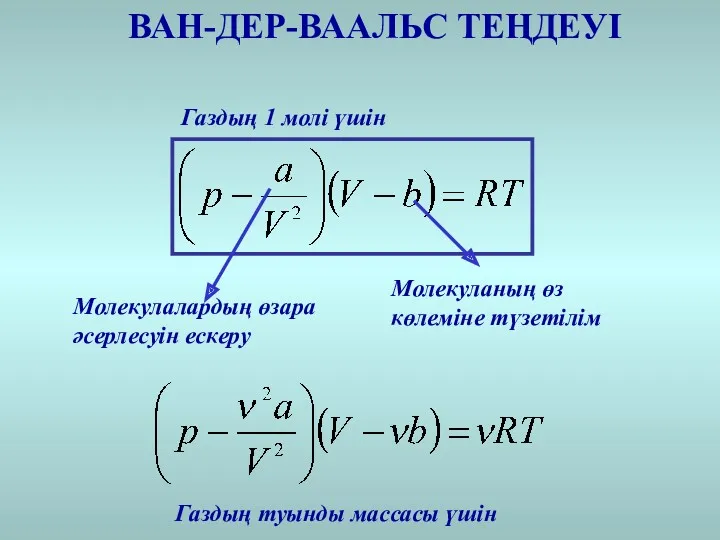
- 23. ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІ Молекулалардың өзара әсерлесуін ескеру Молекуланың өз көлеміне түзетілім Газдың туынды массасы үшін Газдың 1
- 24. Bтұрақтысы молекула өлшеміне байланысты: үлкен молекула үшін оның мәні де үлкен a молекулалар арасындағы тартылыс күшінің
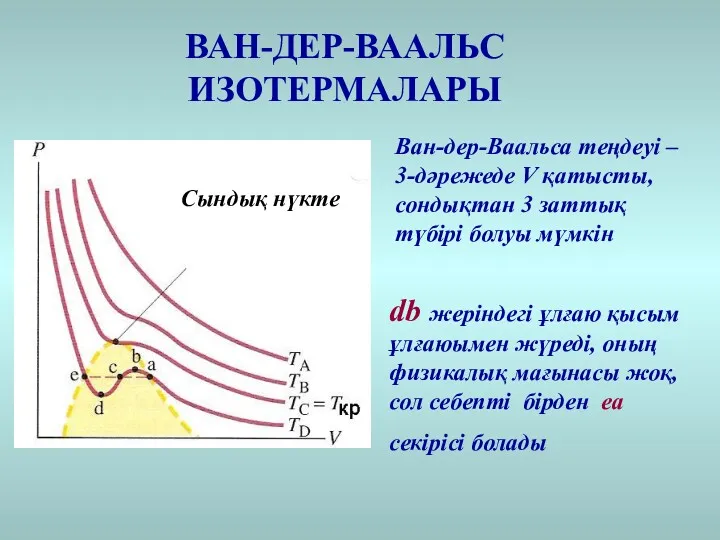
- 25. Сындық нүкте ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫ db жеріндегі ұлғаю қысым ұлғаюымен жүреді, оның физикалық мағынасы жоқ, сол себепті
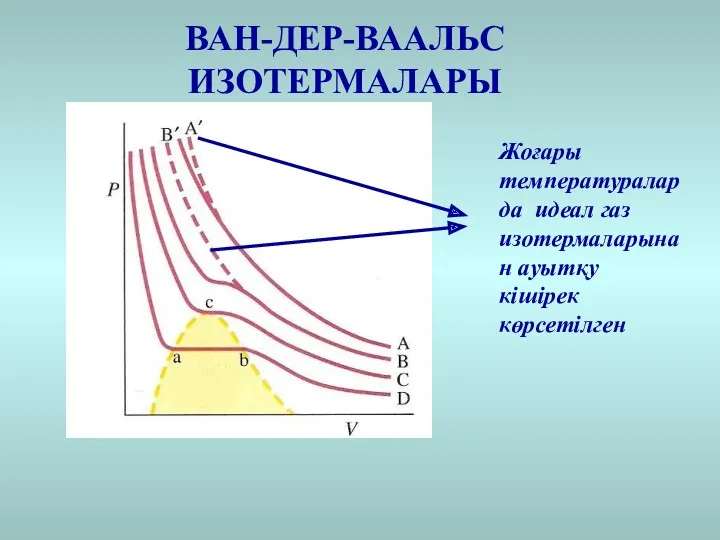
- 26. ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫ Жоғары температураларда идеал газ изотермаларынан ауытқу кішірек көрсетілген
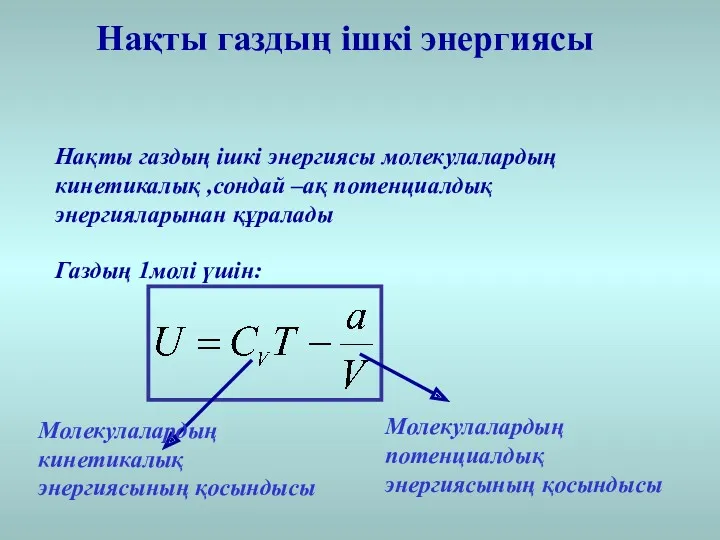
- 27. Нақты газдың ішкі энергиясы Нақты газдың ішкі энергиясы молекулалардың кинетикалық ,сондай –ақ потенциалдық энергияларынан құралады Газдың
- 28. Фазалық ауысулар Фаза – химиялық құрамы бірдей және 1 термодинамикалық күйдегі жүйенің барлық бөліктерінің байланысы 1
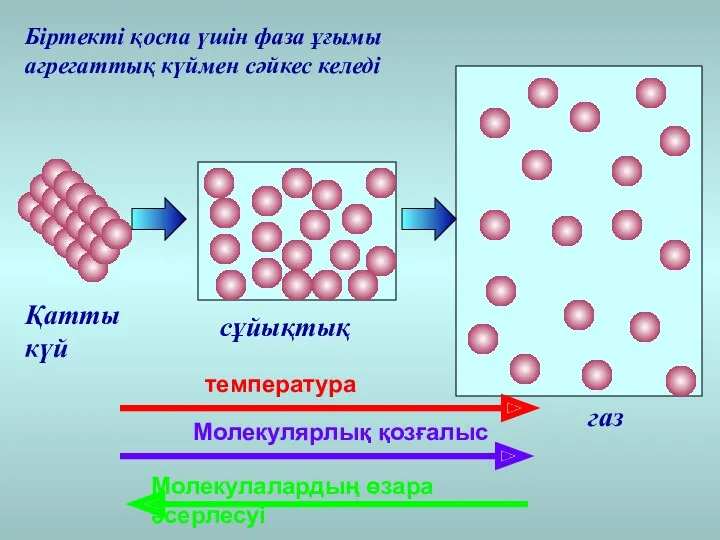
- 29. температура Молекулярлық қозғалыс Молекулалардың өзара әсерлесуі Қатты күй сұйықтық газ Біртекті қоспа үшін фаза ұғымы агрегаттық
- 30. Егер жүйе біртекті болса, онда фаза ұғымы агрегаттық күймен сәйкес келеді Күй диаграммасы – фазалық ауысудың
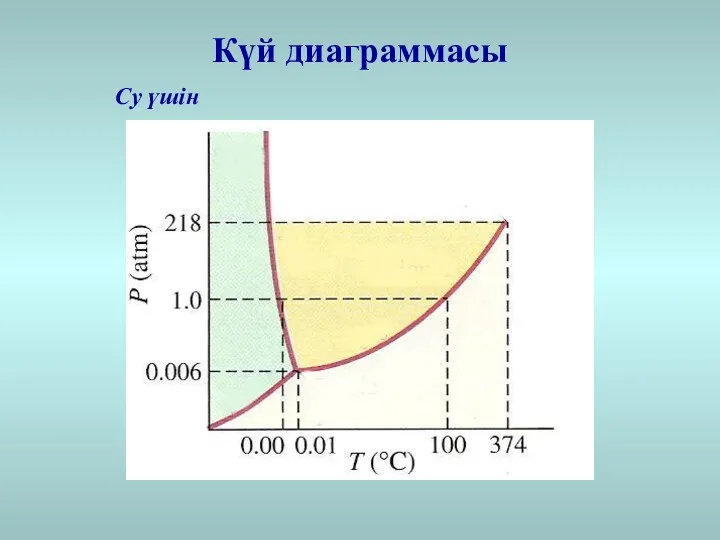
- 31. Күй диаграммасы Су үшін
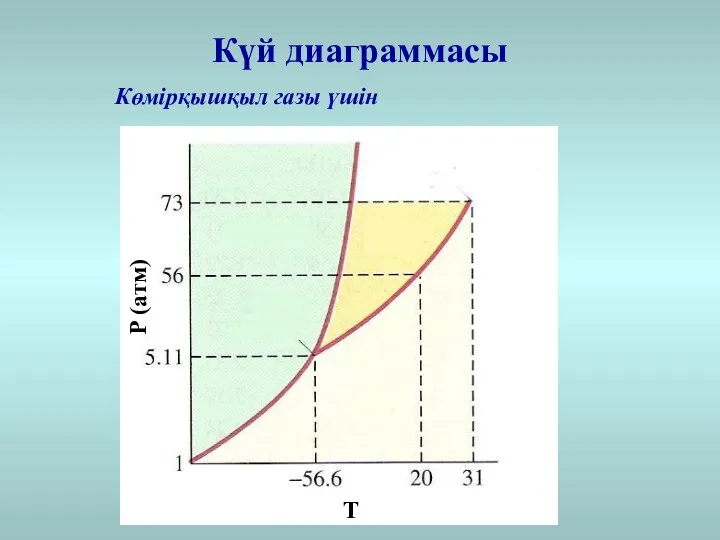
- 32. Күй диаграммасы Көмірқышқыл газы үшін Т Р (атм)
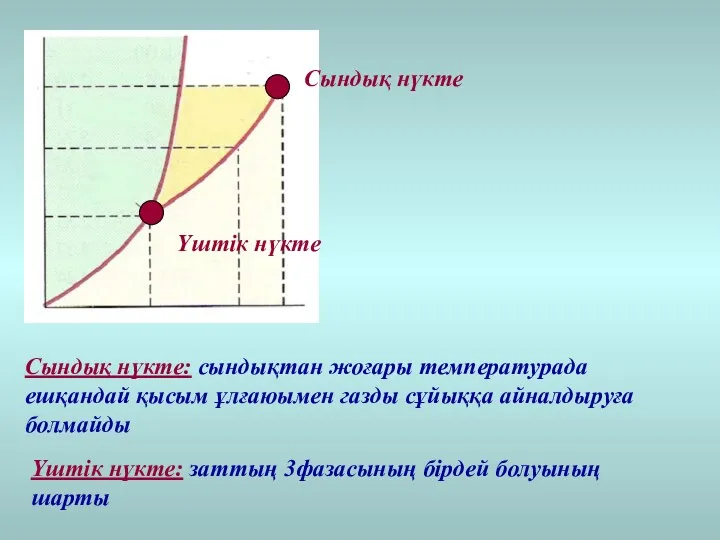
- 33. Үштік нүкте Сындық нүкте Сындық нүкте: сындықтан жоғары температурада ешқандай қысым ұлғаюымен газды сұйыққа айналдыруға болмайды
- 34. Ван-дер-Ваальс теңдеуіне бағынатын газ үшін күйлердің сындық шамаларының мәндері
- 36. Скачать презентацию






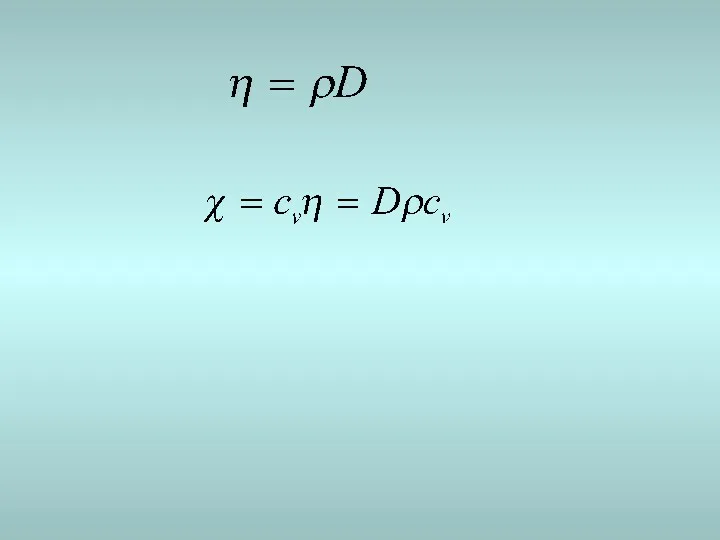








 Зрительная (подзорная) труба
Зрительная (подзорная) труба Маломощные радиостанции КВ диапазона. Тактико-технические данные радиостанции Р-130М. (Тема 4.1)
Маломощные радиостанции КВ диапазона. Тактико-технические данные радиостанции Р-130М. (Тема 4.1) Спектроскопия электронного парамагнитного резонанса
Спектроскопия электронного парамагнитного резонанса Приборы измерения мощности
Приборы измерения мощности Масса тела. Единицы массы
Масса тела. Единицы массы Теоретические основы надёжности технологических систем в технике
Теоретические основы надёжности технологических систем в технике Юные знатоки физики
Юные знатоки физики ЖРД. Устройство и принцип действия, внутрикамерные процессы. (Лекция 2)
ЖРД. Устройство и принцип действия, внутрикамерные процессы. (Лекция 2) Физика в белом халате
Физика в белом халате Микроскоптың шығу тарихы
Микроскоптың шығу тарихы Повторительно - обобщающий урок по теме: Архимедова сила. Плавание. Воздухоплавание.
Повторительно - обобщающий урок по теме: Архимедова сила. Плавание. Воздухоплавание. Устройство плавного пуска асинхронных и синхронных двигателей среднего и высокого напряжения
Устройство плавного пуска асинхронных и синхронных двигателей среднего и высокого напряжения Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 1
Трактори та мінітрактори, які використовуються у лісовому господарстві. Лекція 1. Частина 1 Физические поля и электромагнитные излучения
Физические поля и электромагнитные излучения Дипломный проект: Технологический процесс технического обслуживания и ремонта сцепления автомобиля
Дипломный проект: Технологический процесс технического обслуживания и ремонта сцепления автомобиля Магниторазведка. Магнетизм и магнетики
Магниторазведка. Магнетизм и магнетики Энергетические возможности ядерных реакторов различных типов
Энергетические возможности ядерных реакторов различных типов Ядерные реакции
Ядерные реакции Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы
Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Карданный вал
Карданный вал Электризация тел при соприкосновении. Взаимодействие заряженных тел. Два рода электрических зарядов
Электризация тел при соприкосновении. Взаимодействие заряженных тел. Два рода электрических зарядов Силы в природе
Силы в природе открытый урок-презентация на тему История Российской атомной энергетики
открытый урок-презентация на тему История Российской атомной энергетики Ядерна енергетика в Україні
Ядерна енергетика в Україні Презентация к уроку физики в 8 классе на тему: Кипение
Презентация к уроку физики в 8 классе на тему: Кипение Возбуждение и распространение детонации конденсированных взрывчатых веществ
Возбуждение и распространение детонации конденсированных взрывчатых веществ ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ
ÐекÑÐ¸Ñ 3. ÐÐТÐÐÐ