Содержание
- 2. Мудрые люди обдумывают свои мысли, глупые провозглашают их. Г. Гейне Учение без размышления бесполезно, размышление без
- 3. Теплоёмкость идеального газа при изопроцесах Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на
- 4. Удельная теплоёмкость Суд или с – есть количество теплоты, необходимое для нагревания 1кг вещества на 1
- 5. Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть
- 6. В общем случае так как U может зависеть не только от температуры. В случае идеального газа
- 7. СР – теплоемкость при постоянном давлении Если нагревать газ при постоянном давлении Р в сосуде с
- 8. Пусть мы нагреваем один моль идеального газа при постоянном объёме. Из первого начала термодинамики: т.е. бесконечно
- 9. Вывод уравнения Майера Уравнение Майера 2020 г. Чуев А.С.
- 10. Это уравнение Майера для одного моля газа. Из него следует физический смысл универсальной газовой постоянной. R
- 11. Для произвольного количества газов: , Из теории следует, что СV не зависит от температуры. Однако это
- 12. Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и т.п.),
- 13. Экспериментальная зависимость молярной теплоемкости газов от температуры Слайд прошлой лекции 2020 г. Чуев А.С.
- 14. Изменение теплоемкости с температурой 2020 г. Чуев А.С.
- 15. Температурный резонанс теплоемкости Изменение теплоемкости с температурой 2020 г. Чуев А.С.
- 16. Дискретные изменения энергии молекул 2020 г. Чуев А.С. факультативно
- 17. 3. АДИАБАТИЧЕСКИЙ ПРОЦЕСС. Уравнение Пуассона Адиабатический процесс - процесс, происходящий без теплообмена с окружающей средой. Адиабатический
- 18. Уравнение адиабаты: где γ – показатель (постоянная) адиабаты. На рис. показаны графики различных изопроцессов в PV-координатах.
- 19. Адиабатический процесс характеризуется показателем адиабаты Показатель адиабаты зависит от i, то есть строения молекул: γ 2020
- 20. Уравнение Майера С участием показателя адиабаты: Выражение внутренней энергии идеального газа с участием показателя адиабаты 2020
- 21. Вывод уравнения адиабаты Из первого начала ТД, с учетом: разделим на Уравнение Пуассона 2020 г. Чуев
- 22. - постоянная адиабаты (коэффициент Пуассона) Сделав подстановки из его можно преобразовать: в 2020 г. Чуев А.С.
- 23. 2020 г. Чуев А.С.
- 24. Работа при адиабатическом процессе Положительная работа осуществима лишь за счет уменьшения внутренней энергии С учетом: и
- 25. Процесс, при котором теплоёмкость газа остаётся постоянной. С = const. Политропический процесс – самый общий из
- 26. Вывод уравнения политропы дифференцируем , получая Для моля (1) подставляем в (1) Заменим на и разделим
- 27. продолжение вывода уравнения политропы Разделим все на тогда при где – показатель политропы Уравнение политропы 2020
- 28. Отсюда можно получить: Уравнение политропы преобразуемо : по аналогии с преобразованием уравнения адиабаты выводится Если уравнение
- 29. Выводы из последнего уравнения: При Отсюда : Аналогичный вывод делается при и Тогда и 2020 г.
- 30. Работа ИГ в политропических процессах Политропный: При Формула: 1) 2) Формула 2 применима при расчетах изотермических
- 31. Работа и внутренняя энергия ИГ в политропических процессах Изобарный процесс: 2020 г. Чуев А.С.
- 32. Работа и внутренняя энергия ИГ в политропических процессах Изотермический: Изохорный: 2020 г. Чуев А.С.
- 33. 2020 г. Чуев А.С.
- 34. 2020 г. Чуев А.С. Рекомендуется законспектировать
- 35. Показатель политропы и теплоемкость в изопроцессах конспектировать 2020 г. Чуев А.С.
- 36. факультативно 2020 г. Чуев А.С.
- 37. Уравнение Ван-дер-Ваальса для произвольного количества вещества ν реального газа учитывает конечный объем молекул νb и их
- 38. Поправка касается давления. Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления P* (иногда его называют
- 39. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними,
- 40. Внутренняя энергия газа Ван-дер-Ваальса Энергия одного моля газа Ван-дер-Ваальса слагается из: внутренней энергии молекул газа; кинетической
- 41. Избыточное внутреннее давление Pi пропорционально квадрату концентрации числа частиц Pi ~ nS nV ~ N 2/V
- 42. Дополнительное давление газа Ван-дер-Ваальса за счет взаимного притяжения молекул равно a/Vm2, тогда потенциальная энергия данного взаимодействия
- 43. 2020 г. Чуев А.С.
- 44. Полагают, что U(r = ∞) = 0 – при больших расстояниях потенциальная энергия взаимодействия равна нулю.
- 45. 2020 г. Чуев А.С.
- 47. Скачать презентацию












































 Основы теории размерных цепей
Основы теории размерных цепей Основные положения сопротивления материалов
Основные положения сопротивления материалов Дифракция.
Дифракция.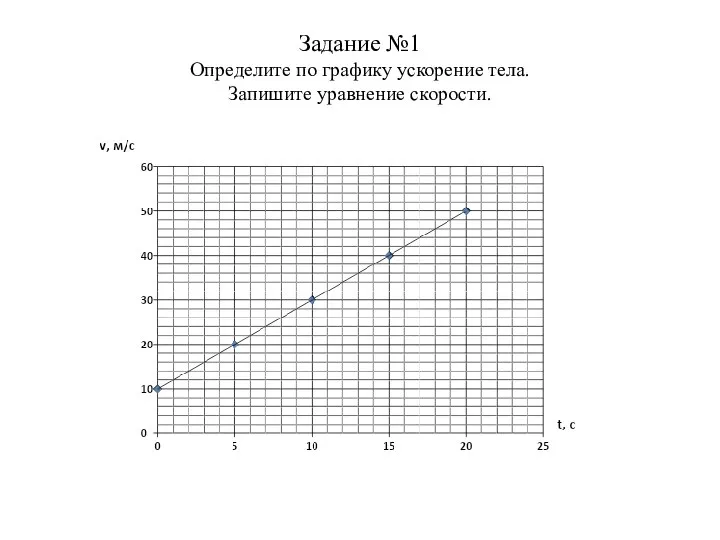 Зачет по теме График и уравнение скорости равноускоренного движения
Зачет по теме График и уравнение скорости равноускоренного движения Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости Плазма. Что такое плазма?
Плазма. Что такое плазма? Интерактивный учебный курс по изучению темы Оптика
Интерактивный учебный курс по изучению темы Оптика Природа света. Законы освещенности
Природа света. Законы освещенности Режимы работы промышленных электрических сетей
Режимы работы промышленных электрических сетей Неньютоновская жидкость
Неньютоновская жидкость Математические модели процессов тепломассообмена. Термодинамические процессы
Математические модели процессов тепломассообмена. Термодинамические процессы ‘06MY ELANTRA (HD) - Technical Highlights
‘06MY ELANTRA (HD) - Technical Highlights Результаты ЕГЭ по физике в Самарской области 2022 год
Результаты ЕГЭ по физике в Самарской области 2022 год Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1
Спектроскопия комбинационного рассеяния (Рамановская спектроскопия). Лекция_1 Люминесцентная спектроскопия
Люминесцентная спектроскопия Свойства топлив. Теплота сгорания топлив. Урок № 4
Свойства топлив. Теплота сгорания топлив. Урок № 4 История лампы накаливания
История лампы накаливания Лекция 3. Кристаллизация
Лекция 3. Кристаллизация Плазмалық технологиялардың физикалық негіздері
Плазмалық технологиялардың физикалық негіздері Домашняя лабораторная работа. Плотность куска мыла
Домашняя лабораторная работа. Плотность куска мыла Полевая геофизика. Вводная лекция
Полевая геофизика. Вводная лекция Сила тяжести на других планетах. Физические характеристики планет (закон всемирного тяготения)
Сила тяжести на других планетах. Физические характеристики планет (закон всемирного тяготения) Силы в природе
Силы в природе Основы гидродинамического подобия
Основы гидродинамического подобия презентация урока Закон Ома для участка цепи
презентация урока Закон Ома для участка цепи Виштовхувальна сила. Закон Архімеда
Виштовхувальна сила. Закон Архімеда Сопротивление материалов. (Лекция 1)
Сопротивление материалов. (Лекция 1) Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини
Діелектрики в електричному полі. Поляризація діелектриків. Діелектрична проникність речовини