Содержание
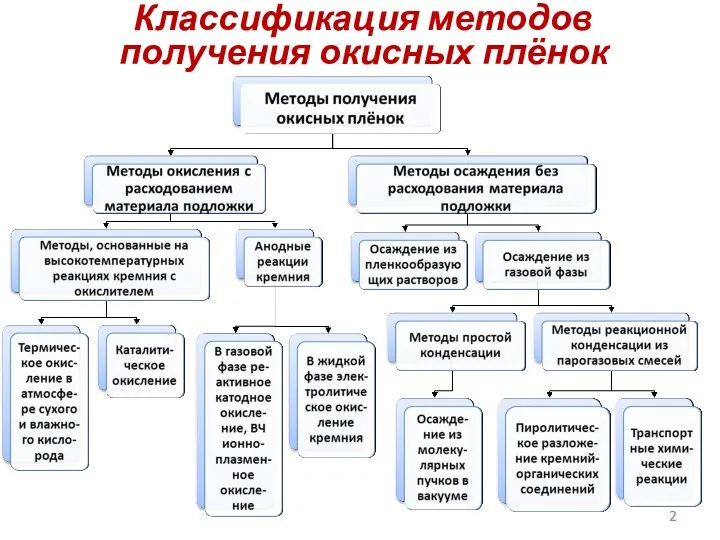
- 2. Классификация методов получения окисных плёнок
- 3. Особенности процесса термического окисления Процесс термического окисления относится к группе методов формирования диэлектрических пленок с частичным
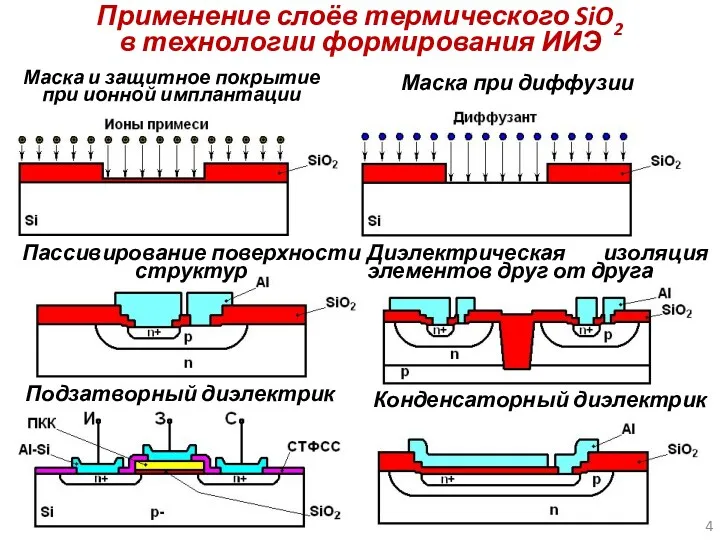
- 4. Применение слоёв термического SiO2 в технологии формирования ИИЭ Подзатворный диэлектрик Маска и защитное покрытие при ионной
- 5. Требования к слоям SiO2 Высокое удельное сопротивление (>1014 Ом×см); Определенная диэлектрическая проницаемость; Согласование ТКЛР с другими
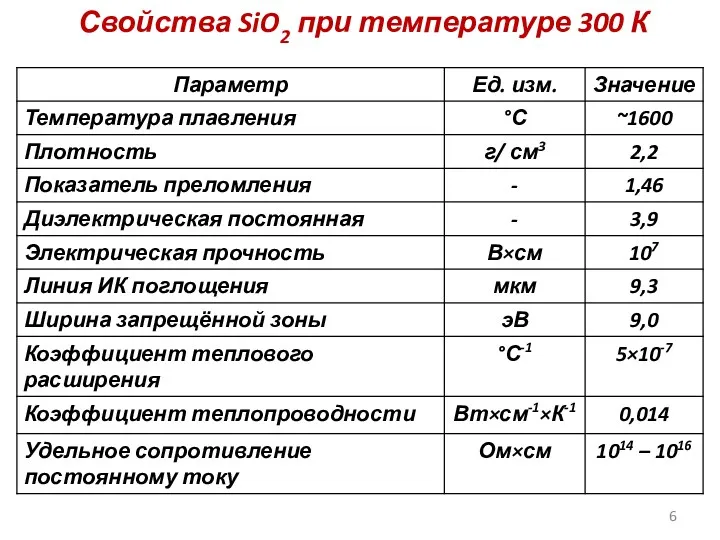
- 6. Свойства SiO2 при температуре 300 К
- 7. Основы теории роста SiO2 Поверхность кремния легко окисляется. При экспозиции кремниевой подложки в атмосфере происходит быстрое
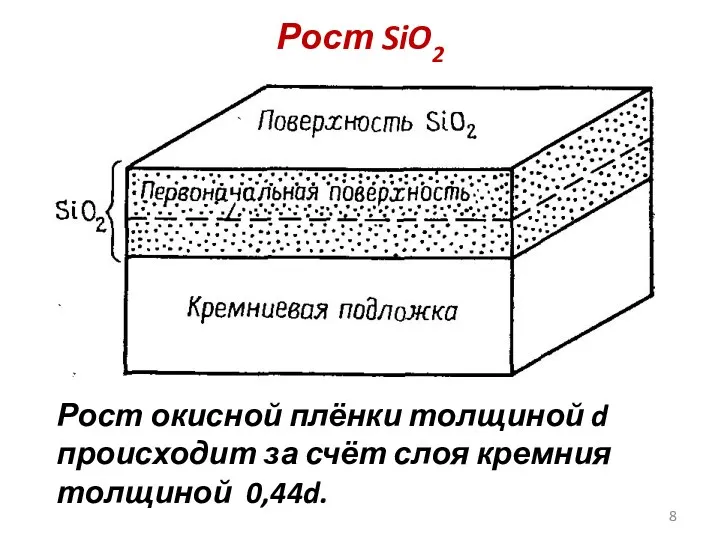
- 8. Рост SiO2 Рост окисной плёнки толщиной d происходит за счёт слоя кремния толщиной 0,44d.
- 9. Кинетика окисления кремния Кинетика окисления описывается моделью Дила и Гроува. Модель применима: в диапазоне температур 700
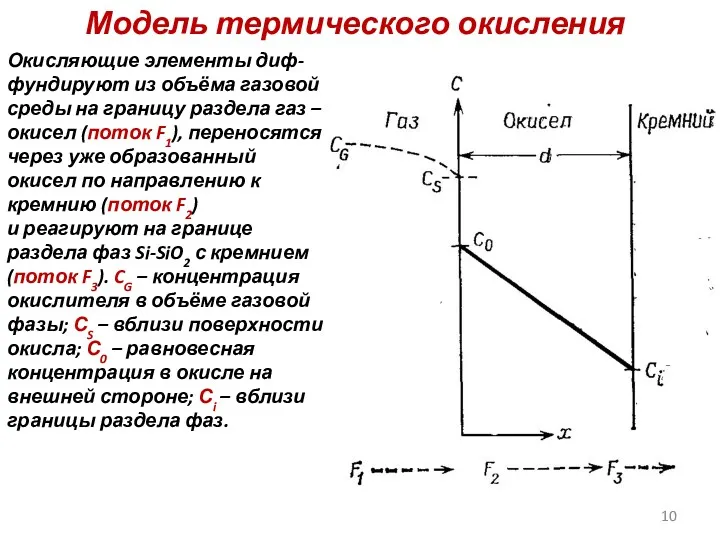
- 10. Модель термического окисления Окисляющие элементы диф-фундируют из объёма газовой среды на границу раздела газ – окисел
- 11. Уравнение для потока F1 Поток F1 пропорционален разности концентраций окислителя: где hG – коэффициент массопереноса в
- 12. Уравнение для потока F2 Поток частиц окислителя через окисел для любой точки d описывается законом Фика:
- 13. Уравнение для потока F3 Поток, соответствующий реакции, пропорционален Ci: где kS – константа скорости химической реакции
- 14. Решение уравнений для Сi и С0 Для установившегося потока соблюдается условие F1=F2=F3. Тогда совместное решение уравнений
- 15. Предельные случаи уравнений для Сi и С0 1. Если D слишком мал, то Сi→0, C0→C*, т.е.
- 16. Определение числа молекул окислителя, входящих в состав SiO2 Окисел содержит 2,2×1022 молекул SiO2 в 1 см3.
- 17. Зависимость толщины от времени процесса (*) где: Величина τ соответствует сдвигу по временной оси, учитывающему наличие
- 18. Предельные случаи решения уравнения для толщины окисла 1. Большое время окисления (t>>τ): Уравнение представляет собой параболический
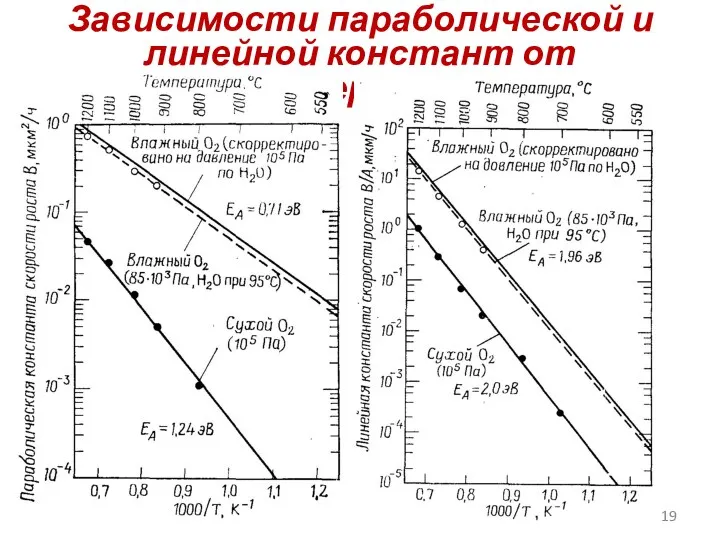
- 19. Зависимости параболической и линейной констант от температуры
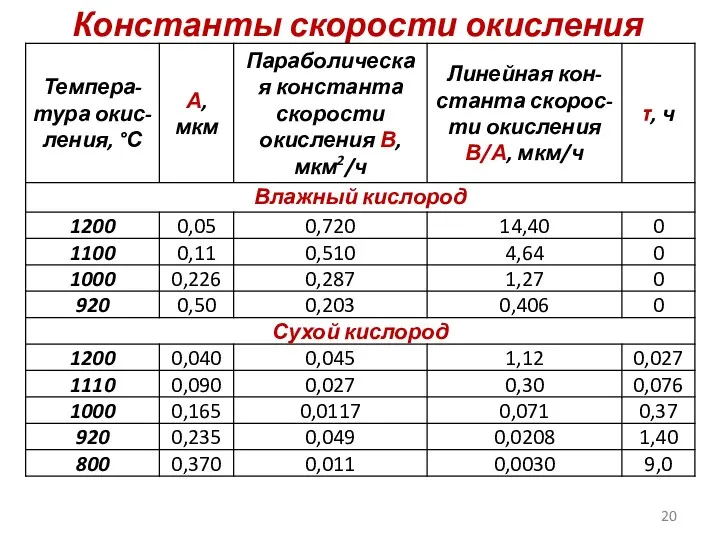
- 20. Константы скорости окисления
- 21. Особенности получения тонких слоев окисла Кинетика роста окисла для тонких плёнок окисла однозначно не установлена. При
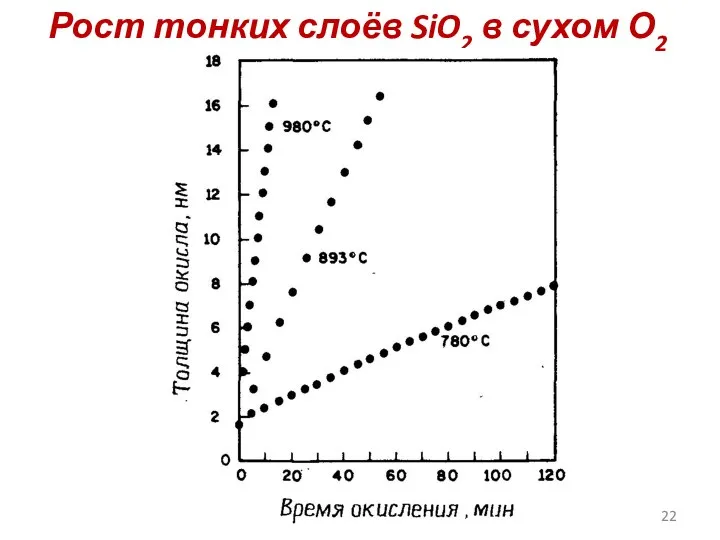
- 22. Рост тонких слоёв SiO2 в сухом О2
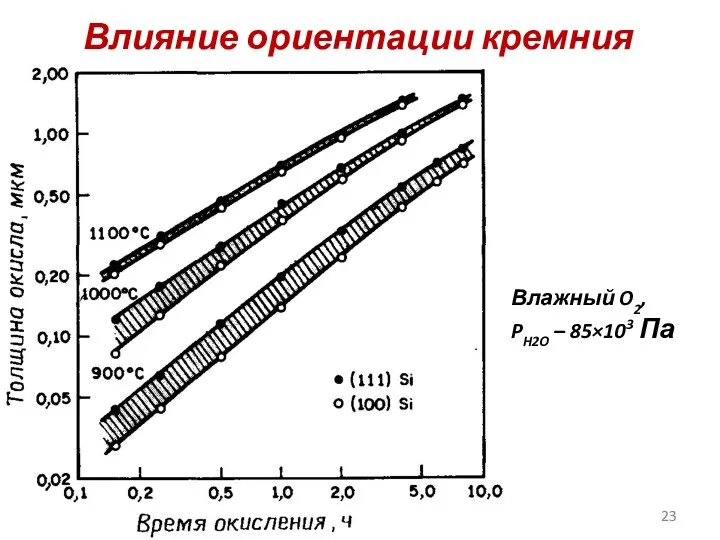
- 23. Влияние ориентации кремния Влажный O2, PH2O – 85×103 Па
- 24. Термодиффузионная система пирогенного окисления «Оксид 3ПО»
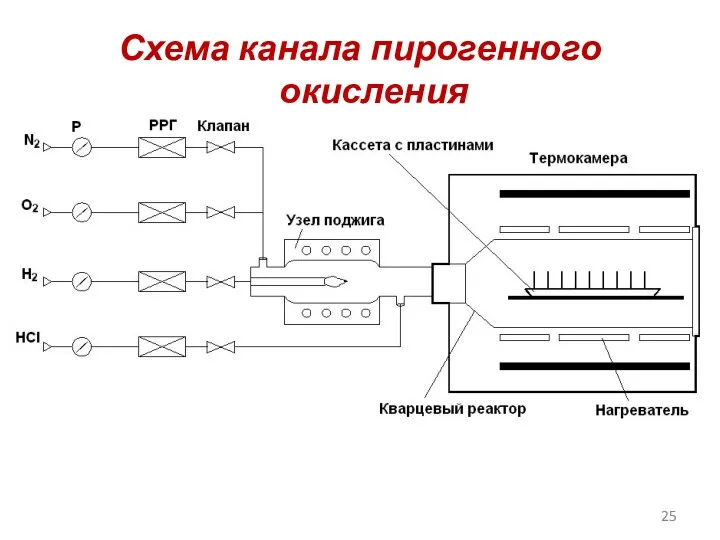
- 25. Схема канала пирогенного окисления
- 26. Выбор метода окисления Определяется необходимой толщиной и свойствами формируемого окисла: Относительно тонкие окисные плёнки с минимальным
- 27. Техника окисления Наиболее распространенный метод окисления при атмосферном давлении реализуется в кварцевых диффузионных трубах. Подложки кремния
- 28. Комбинирование сухого и влажного окисления Пленки, полученные в парах H20 и во влажном O2 растут с
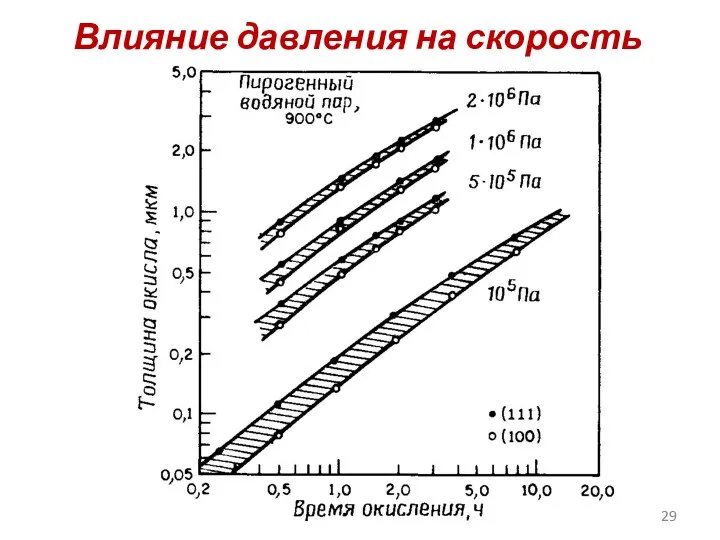
- 29. Влияние давления на скорость роста
- 30. Маскирующие свойства SiO2 Способность SiO2 служить в качестве локального маскирующего покрытия – одно из важнейших свойств
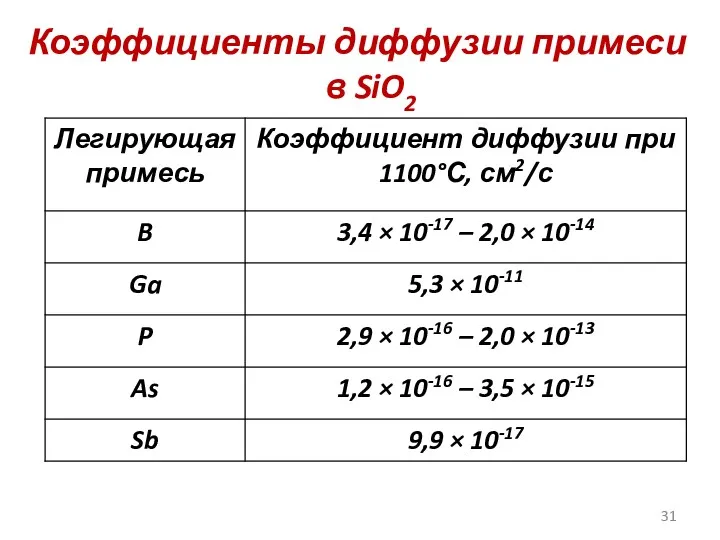
- 31. Коэффициенты диффузии примеси в SiO2
- 32. Применимость масок из SiО2 Наиболее часто используемые примеси (n-типа - P, Sb, As и р-типа -
- 33. Перераспределение примеси при окислении По мере продвижения границы SiO2-Si вглубь Si легирующая примесь, первоначально находившаяся в
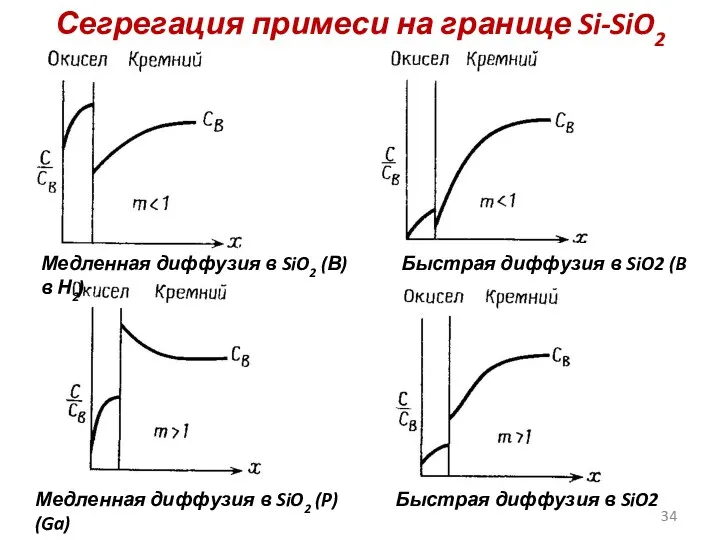
- 34. Сегрегация примеси на границе Si-SiO2 Медленная диффузия в SiO2 (В) Быстрая диффузия в SiO2 (B в
- 36. Скачать презентацию




















 Волновая оптика. Интерференция света
Волновая оптика. Интерференция света Магнитное поле в вакууме
Магнитное поле в вакууме Экспериментальные факты, лежащие в основе теории магнетизма
Экспериментальные факты, лежащие в основе теории магнетизма Техническое обучение по харвестерной головке Лог Макс 6000
Техническое обучение по харвестерной головке Лог Макс 6000 Плавление тел
Плавление тел Волновые свойства света: интерференция, дифракция
Волновые свойства света: интерференция, дифракция Машины для уборки и послеуборочной доработки картофеля. (Тема 13)
Машины для уборки и послеуборочной доработки картофеля. (Тема 13) Электромагнитные волны (ЭМВ)
Электромагнитные волны (ЭМВ) Микроскоп – знакомство, создание, опыты
Микроскоп – знакомство, создание, опыты Квантовая физика. Фотоэффект. Урок 29
Квантовая физика. Фотоэффект. Урок 29 Нахождение механической силы через силу и перемещение
Нахождение механической силы через силу и перемещение Кинематика твердого тела
Кинематика твердого тела Взаимозаменяемость шпоночных и шлицевых соединений
Взаимозаменяемость шпоночных и шлицевых соединений Методические рекомендации по организации экспериментальной работы на уроках физики и во внеурочное время
Методические рекомендации по организации экспериментальной работы на уроках физики и во внеурочное время использование энергии деления ядер
использование энергии деления ядер Ойын алаңы.Теориялық механика
Ойын алаңы.Теориялық механика Тема урока Последовательное соединение
Тема урока Последовательное соединение Электрические источники света. Светодиодные, люминесцентные и индукционные лампы, их достоинства и недостатки
Электрические источники света. Светодиодные, люминесцентные и индукционные лампы, их достоинства и недостатки Сравнение вариантов монтажных кранов
Сравнение вариантов монтажных кранов Дефектация деталей и ремонт типовых сборочных единиц ДСМ
Дефектация деталей и ремонт типовых сборочных единиц ДСМ Кинематика. Основные понятия. Траектория. Средняя и мгновенная скорости. Ускорение. Закон равноускоренного движения
Кинематика. Основные понятия. Траектория. Средняя и мгновенная скорости. Ускорение. Закон равноускоренного движения Наноматеріали
Наноматеріали Електромагнітна індукція
Електромагнітна індукція Планирование наземной экспериментальной отработки и летных испытаний космических аппаратов
Планирование наземной экспериментальной отработки и летных испытаний космических аппаратов Техническое обслуживание и текущий ремонт двигателя, системы охлаждения и смазки
Техническое обслуживание и текущий ремонт двигателя, системы охлаждения и смазки Көміртекті нанотүтікше
Көміртекті нанотүтікше Звуковые волны
Звуковые волны Гальваническое покрытие
Гальваническое покрытие